多粘类芽孢杆菌LRS-1诱导黄瓜抗疫霉病的苯丙烷类代谢基因表达与调控研究
罗雨晴,盛 浩,袁 红,周 清,张 亮1,*
(1. 湖南农业大学东方科技学院,湖南 长沙 410128;2. 湖南农业大学资源环境学院,湖南 长沙 410128)
【研究意义】瓜类疫霉菌(Phytophthoramelonis)是一种严重威胁蔬菜产量与品质的恶劣土传病原真菌,能够侵染黄瓜、土豆以及茄科等多种寄主,防治难度大。因此,研究该菌种的致病机理对于防止作物土传病害有着重要的意义。【前人研究进展】随着绿色生物防治研究的兴起,根际促生菌等有益微生物逐渐被证实为土传病原菌的天然克星,更是提高植物抗逆性与土壤生态修复的绿色好伙伴[1-2]。现有生防菌作用机理研究结果证实在“植物-病原菌-促生菌”互作模式下部分生防菌具有诱导植物系统性抗性(ISR),能够作为受非致病微生物诱导寄主植株产生一系列系统性抗性,从而协助寄主作物防御致病微生物的侵害[3-5]。【本研究切入点】苯丙烷类代谢途径是植物次生代谢产物合成的重要途径,其下游分支途径中的木质素与黄酮类合成途径所生成的多种代谢产物在植物抵抗病害方面具有非常重要的作用[6-8]。多粘性芽孢杆菌LRS-1筛选于酸性水稻土壤,前期温室试验证实该菌株对包括疫霉病等土传病害具有良好的防治效果和生防潜力[9]。【拟解决的关键问题】为深入探究该菌株在“植物-病原菌-促生菌”互作模式中是否具有ISR机制,笔者运用实时荧光定量PCR技术对“黄瓜-疫霉菌-LRS-1”互作进程中黄瓜根内苯丙烷类代谢基因及其关键性的路径调控基因的表达进行了分析,以期从诱导植物系统抗性的角度揭示LRS-1的生防作用机制,从而为该生防菌后续的深入研究与利用提供必要的理论依据。
1 材料与方法
1.1 供试材料
供试诱导菌株为多粘类芽孢杆菌(Paenibacilluspolymyxa)LRS-1,保存于本实验室;病原菌为疫霉菌PhytophthoramelonisTX-8 (P.m),由湖南农业大学植物保护学院提供;所有菌株均保存于-80 ℃。
供试黄瓜品种:蔬研十号(长沙兴蔬种业有效公司)。
供试土壤:水稻土,有机质含量为15.4 g·kg-1,pH 5.4。
1.2 培养基、引物、PCR试剂与试剂盒
NBY培养基:营养肉汤粉8 g,酵母提取物2 g,磷酸氢二钾2 g, 磷酸二氢钾0.5 g,葡萄糖2.5 g,1M七水合硫酸镁 1 mL,去离子水1 L,琼脂18 g;PDA培养基:马铃薯200 g,葡萄糖20 g,去离子水1 L,琼脂18 g。液体培养时均不添加琼脂。
试剂:SYBRTMSafe DNA染料(Invitrogen公司),SYBR green master mix (SsoFast公司),DEPC水(Invitrogen公司)。
试剂盒:RNeasy Plant Mini植物总RNA提取试剂盒,RNeasy纯化试剂盒以及SuperScript®RIII反转录试剂盒,均购自于江苏康为世纪生物科技有限公司。
引物:见表1(武汉奥科鼎盛生物科技有限公司合成)。
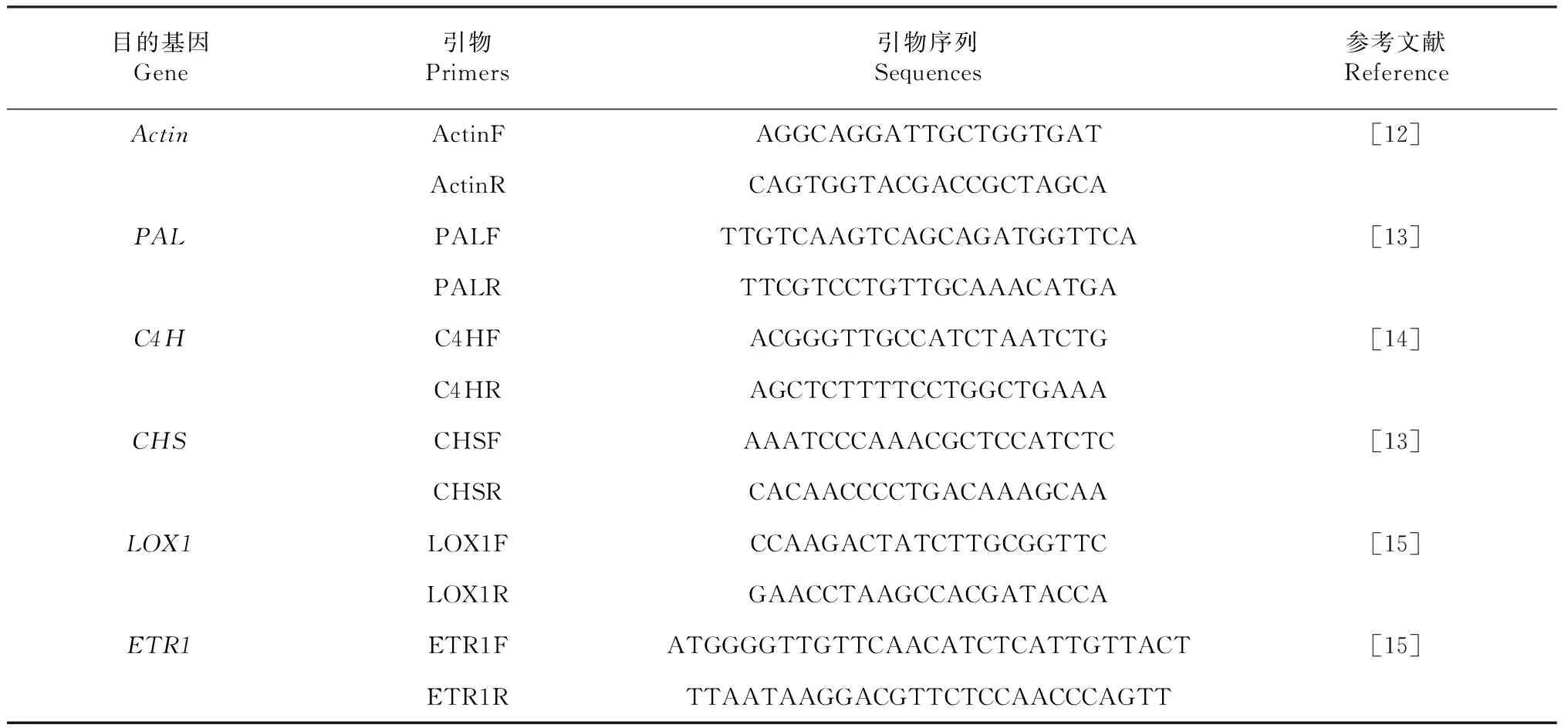
表1 黄瓜苯丙烷类代谢关键基因与调控路径基因表达RT-PCR检测引物
1.3 诱导试验设计
试验共布置4个处理,分别为清水阴性对照(CK)、黄瓜疫霉病阳性对照(P.m)、疫霉菌+多粘芽孢杆菌诱导(LRS-1+P.c)、多粘芽孢杆菌诱导(LRS-1)。
诱导剂制备[10]:挑取纯化后的LRS-1单菌落并接种于液体NBY培养基中,于180 r·min-1、室温条件下振荡培养48 h,离心,生理盐水悬浮(109CFU·mL-1)后与灭菌泥炭粉按1∶10比例(V∶M)混合均匀作为诱导剂(108CFU·mL-1),备用。
感病土壤配制:接种病原菌(P.m)于PDB培养基,于24 ℃、180 r·min-1条件下振荡培养120 h,双层灭菌纱布过滤,无菌水稀释至106CFU·mL-1,与健康壤土按1∶10(V∶M)比例混合,备用。
盆栽诱导实验:每盆(直径10 cm)含200 g感病土壤并移栽3叶1心黄瓜幼苗1株,每株根部包裹3 g相应处理的诱导剂,以清水无菌泥炭包裹处理为对照。每个处理设24盆。日常管理。
1.4 样品采集
分别于试验第12、24、48、72小时(相同时间点)后,各处理随机挑选3盆,轻轻拔离植株根部周围土体,自来水快速冲洗,无菌纸吸干,置于液氮运输并转-80 ℃冰箱保存、备用。
1.5 RT-PCR基因表达监测
模板制备:称取0.1 g黄瓜根部样品,试剂盒法提取植物总RNA,纯化,分别进行核酸仪浓度监测与1 %琼脂糖凝胶电泳检测。
反转录:分别以0.5 μg RNA为模板与oligo (dT 12-18) 引物按照反转录试剂盒操作步骤配制20 μl反应体系,反转录为cDNA,备用。
RT-PCR检测:经CFX96实时荧光定量PCR仪检测完成。10 μl PCR扩增反应体系为:3 μl(1/10稀释)cDNA, 1 μl 0.5 μΜ引物(F/R), 5 μl SYBR green master mix。反应条件为:95 ℃ 30 s,95 ℃ 15 s, 60 ℃ 30 s, 72 ℃延长30 s,40个循环。每次检测均在反应完成后再进行一个72~95 ℃的反应溶解曲线对检测基因的扩增进行单峰特异性检验。每个样品的定量PCR反应重复3次。以Actin内参基因表达值作参比,计算各样品目的基因的相对表达量[11]。
1.6 数据统计与分析
数据采用Excel 2010、DPS软件进行分析。
2 结果与分析
2.1 多粘芽孢杆菌LRS-1诱导黄瓜苯丙烷类代谢关键基因表达
通过数据分析可以看出,与清水阴性对照相比,各处理黄瓜根系的苯丙烷类代谢关键基因都能被诱导表达,其基因表达情况因处理及诱导时间的不同而存在差异(图1~3)。
就PAL基因情况而言,与对照相比,各接种处理的PAL基因均随时间的延长而逐渐表达上调;病原菌阳性对照处理(P.m)在72 h时达到最高,其相对基因表达量为对照基因表达量的2.65倍;P.m+LRS-1诱导处理与单独LRS-1诱导处理的PAL基因的相对表达量则在48 h时出现峰值,此时的相对基因表达量分别为对照的2.60和1.82倍(图1)。
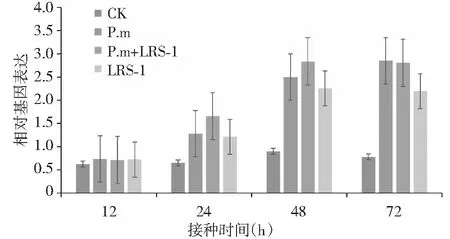
图1 黄瓜疫霉菌胁迫下接种多粘类芽孢杆菌LRS-1对黄瓜PAL基因表达的影响Fig.1 Expression of the PAL gene on cucumber inoculated with P.b LRS-1 under P.m stress
对C4H基因研究发现,与对照相比,各接种处理的C4H基因均随时间的延长而呈现出递增表达趋势;即72 h的相对基因表达量最高,其中病原菌阳性对照处理(P.m)在72 h的相对基因表达量为对照的2.00倍,而P.m+LRS-1诱导处理与单独LRS-1诱导处理的C4H基因的相对表达量则分别为对照的3.18和1.55倍(图2)。
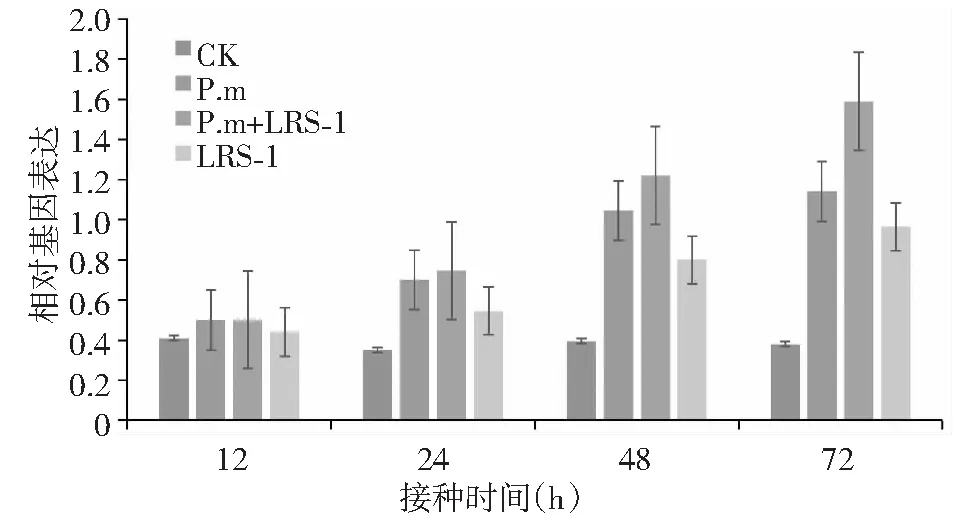
图2 黄瓜疫霉菌胁迫下接种多粘类芽孢杆菌LRS-1对黄瓜C4H基因表达的影响Fig.2 Expression of the C4H gene on cucumber inoculated with P.b LRS-1 under P.m stress
如图3所示,与对照相比,24 h内黄瓜CHS基因均能倍诱导上调表达,但12 与24 h时的相对表达量变化不大,而24 h后的相对表达量则明显增加,并在72 h时最高,其中病原菌阳性对照处理(P.m)在第72小时的相对基因表达量为对照的2.59倍,而P.m+LRS-1诱导处理与单独LRS-1诱导处理的CHS基因的相对表达量则分别为对照的2.76和1.63倍。
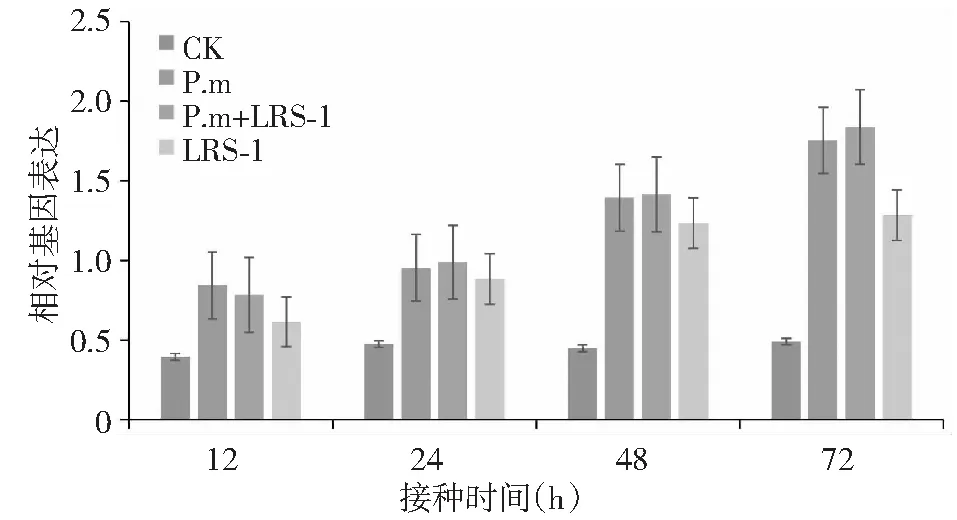
图3 黄瓜疫霉菌胁迫下接种多粘类芽孢杆菌LRS-1对黄瓜CHS基因表达的影响Fig.3 Expression of the CHS gene on cucumber inoculated with P.b LRS-1 under P.m stress
2.2 多粘芽孢杆菌LRS-1诱导黄瓜系统性抗性信号调控路径监测
如图4所示,与对照相比,第12小时起,各接种处理根系的LOX1基因均受到诱导而上调表达量,且峰值均出现于第24小时,然后增幅逐渐降低;就峰值水平而言,不同接种处理的LOX1相对基因表达量表现为P.m+LRS-1>LRS-1>P.m,分别为对照相对表达量的1.60、2.33、2.13倍。
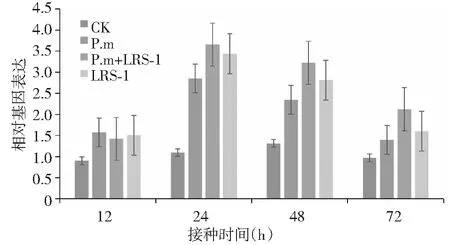
图4 黄瓜疫霉菌胁迫下接种多粘类芽孢杆菌LRS-1对黄瓜茉莉酸信号调控路径基因LOX1表达的影响Fig.4 Expression of the jasmonic acid (JA) pathway regulated gene LOX1 on cucumber inoculated with P.b LRS-1 under P.m stress
如图5所示,与对照相比,接种了多粘芽孢杆菌LRS-1的2个处理(P.m+LRS-1与LRS-1)的ETR1基因表达均随时间的延长而逐渐上调,且在72 h时表现最高,其相对表达量分别为对照的4.53和4.30倍;病原菌处理(P.m)根系的ETR1基因表达虽然略有上调,但增幅不大,且表现较为波动。
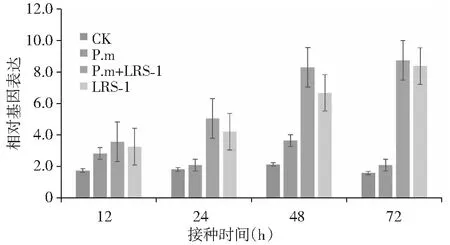
图5 黄瓜疫霉菌胁迫下接种多粘类芽孢杆菌LRS-1对黄瓜乙烯信号调控路径基因ETR1表达的影响Fig.5 Expression of the ethylene (ET) pathway regulated gene ETR1 on cucumber inoculated with P.b LRS-1 under P.m stress
3 讨 论
苯丙烷类代谢已被证实在类黄酮素和木质素等合成中具有关键作用,其代谢强弱是表征植物抵御病原菌侵染能力的重要体现。有关植物苯丙烷类代谢研究的相关报道显示,采用接种水杨酸、柠檬酸、苯丙噻重氮(BTH)、壳聚糖、茉莉酸甲酯等化学物质以及尖镰孢、镰刀菌等微生物后能够诱导植物产生并获得抗性[16-21]。本文结合根部接种诱导盆栽试验与荧光定量PCR检测技术对多粘类芽孢杆菌LRS-1诱导黄瓜寄主根系苯丙烷类代谢基因PAL、C4H、CHS等关键基因以及乙烯、茉莉酸等诱导信号调控路径关键基因的表达予以了研究。试验结果表明单独接种疫霉菌能够诱导黄瓜寄主根系获得SAR抗性反应,单独接种多粘性芽孢杆菌LRS-1可诱导黄瓜根系产生ISR抗性反应,而疫霉病原菌胁迫条件下的黄瓜根系相关防御基因的表达则受SAR和ISR共同作用的影响。与阴性对照相比,无论是接种疫霉菌或多粘性芽孢杆菌LRS-1均可诱导黄瓜根系组织的PAL、C4H、CHS等苯丙烷类代谢关键基因的表达进行上调,各基因的诱导表达效果与规律与SAR和ISR抗性诱导生物源类型及诱导时间有关,证实了多粘芽孢杆菌LRS-1对苯丙烷类代谢基因具有诱导效应。接种疫霉菌后,黄瓜根系的茉莉酸调控路径关键基因LOX1的相对表达量在第1天时就已达到最高水平,暗示了疫霉菌对黄瓜植株的SAR抗性诱导主要依赖于茉莉酸调控途径;接种多粘类芽孢杆菌LRS-1第1天,黄瓜植株的茉莉酸调控路径关键基因LOX1的相对表达量也达到最高水平,且乙烯传导路径关键调控基因的相对表达量随诱导时间的延长而明显上调,表明该生防菌对黄瓜寄主具有ISR抗性诱导且该防御机制主要依赖茉莉酸和乙烯调控路径。Pieterse等研究发现受茉莉酸和乙烯信号传导路径调控的诱导植物系统性抗性(ISR)是根际促生菌防控植物病原菌侵染的重要机制之一[22]。本研究结果即证实了多粘芽孢杆菌类生防微生物能够诱导植物ISR抗性反应,佐证了相关报道,也为完善生防菌在诱导寄主植物苯丙烷类代谢途径抗性表达方面提供了理论依据。
4 结 论
(1)单独接种疫霉菌可诱导黄瓜获得SAR抗性,单独接种多粘性芽孢杆菌LRS-1可诱导黄瓜产生ISR抗性,而疫霉病原菌胁迫条件下黄瓜相关防御基因的表达受SAR和ISR共同影响。
(2)黄瓜PAL、C4H、CHS等苯丙烷类代谢关键基因接受诱导表达的效果和规律与诱导源类型及诱导时间有关。
(3)疫霉菌对黄瓜SAR抗性诱导主要依赖于茉莉酸调控途径,而多粘类芽孢杆菌LRS-1对黄瓜ISR抗性诱导主要依赖茉莉酸和乙烯调控路径。

