凡纳滨对虾WAP基因重组表达及抗病功能分析
马春霞,黄 婷,卢 敏,陆专灵,谢宗升,雷爱莹,陈福艳 ,熊建华* ,黎 铭*
(1.广西兽医研究所/广西兽医生物技术重点实验室,广西 南宁 530001;2.广西水产科学研究院/广西遗传育种与健康养殖遗传重点试验室,广西 南宁 530021;3.广西北部湾海洋生物多样性养护重点实验室/北部湾大学海洋学院,广西 钦州 535011)
【研究意义】凡纳滨对虾(Litopenaeusvannamei)又称南美白对虾,隶属于节肢动物门甲壳纲十足目对虾属对虾科,是世界各地的主要养殖对虾品种[1],也是三大养殖对虾(凡纳滨对虾、日本斑节对虾和罗氏沼虾)品种中单产最高的虾种。凡纳滨对虾具有个体大、生长快、营养需求低、抗病力强及对水环境因子变化适应能力强和离水存活时间长等优点,自引进我国以来,已逐渐成为集约化高产养殖的优良品种,并在我国水产养殖产业中占据重要地位[2-3]。白便病是目前危害凡纳滨对虾养殖业最严重的一种疾病,主要由细菌、寄生虫、毒素及投喂过量等因素引起[4-7]。虽然白便病已经流行多年,但目前仍未找到有效的预防控制药物和治疗方法[8-9]。因此,分析凡纳滨对虾的抗病基因及抗病机制,对开发凡纳滨对虾抗“白便病”药物及促进沿海对虾养殖产业的健康发展具有重要意义。【前人研究进展】随着凡纳滨对虾养殖规模的扩大,其病害机理及防治技术一直深受关注[4,9-10]。凡纳滨对虾属较低等水生动物,生长发育的生命周期较短,机体各器官系统形成迅速,新陈代谢水平较高,器官结构较简单,在养殖过程中较易发病[11]。凡纳滨对虾对养殖环境有一定要求,水环境条件恶劣会直接影响其鳃结构,病原体较易感染鳃部而影响其生长发育[10]。虾病暴发或长期带毒蔓延不仅造成较大经济损失,还会使对虾种质退化[11-12]。以往对对虾养殖病害的防控主要依靠抗生素及各种化学药物,虽然这些药物对细菌性疾病和寄生虫疾病有一定效果,但对病毒性疾病效果不理想,且存在严重的药物残留及产生耐药菌株等问题[13-15]。抗菌肽是一类具有抑菌活性的多肽物质,具有多种优点,包括安全无毒、抗菌谱广、稳定性好、杀菌浓度低、分子质量小和致敏性弱等,已成为生物领域的研究热点之一[16-17]。已有报道称,抗菌肽已作为凡纳滨对虾、罗非鱼、锦鲤进入草鱼等水产动物的免疫增强剂和促生长剂应用[18-21],且应用前景广阔。【本研究切入点】WAP是存在于凡纳滨对虾体内的一个抗菌肽(Crustin)基因,但目前国内外关于其功能及表达物应用的研究鲜见报道。【拟解决的关键问题】开展凡纳滨对虾WAP基因克隆表达及抗病功能研究,分析WAP基因在凡纳滨对虾组织中的表达特性,为凡纳滨对虾抗白便病药物的开发提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 对虾 健康凡纳滨对虾样品由广西防城港SPF凡纳滨对虾良种场提供,白便病凡纳滨对虾样品由北海某对虾养殖场提供,规格为4~5 g/尾。收集对虾的眼柄、血细胞、腮、肝胰腺、心脏、胃、肌肉、神经、肠道、后盲囊和表皮组织,分别置于装有1.0 mL RNA Later保存液的1.5 mL离心管中,低温运回实验室,存放于-80 ℃冰箱备用。
1.1.2 试验试剂和耗材 TransZol UP Plus RNA Kit 试剂盒购自北京全式金生物技术有限公司,第一链cDNA合成试剂盒购自北京全式金生物技术有限公司,DNA胶纯化试剂盒、质粒小提试剂盒购自美国Axygen公司,0.22 μm无菌滤器和透析袋购自美国Millipore公司,Ni-IDA亲和层析胶购自美国Novagen公司,其他试剂均为国产分析纯或化学纯;PCR管和枪头等耗材购自美国Fisher公司。
1.1.3 仪器设备 定量PCR仪(德国Biometra公司);Allegra 21R台式高速冷冻离心机(美国Beckman公司);台式高速离心机(德国Sorval公司);Biologic LP层析系统、Mini Protean II垂直平板电泳系统、Gel Doc2000成像系统、水平电泳系统(美国BIO-RAD公司);PTC-200基因扩增仪(美国MJ Research公司);320-S pH计(美国Mettler Toledo公司);MultiTemp III 恒温水浴锅、Hofer ΜV-25紫外透射仪(美国Amersham Pharmacia公司);超净工作台(中国苏净集团);NANODROP2000(美国Thermo公司)。
1.2 试验方法
1.2.1 引物设计与合成 参照GenBank(AY464465.1)公布的WAP基因序列,通过Primer 5设计普通PCR及荧光定量PCR引物(表1)。
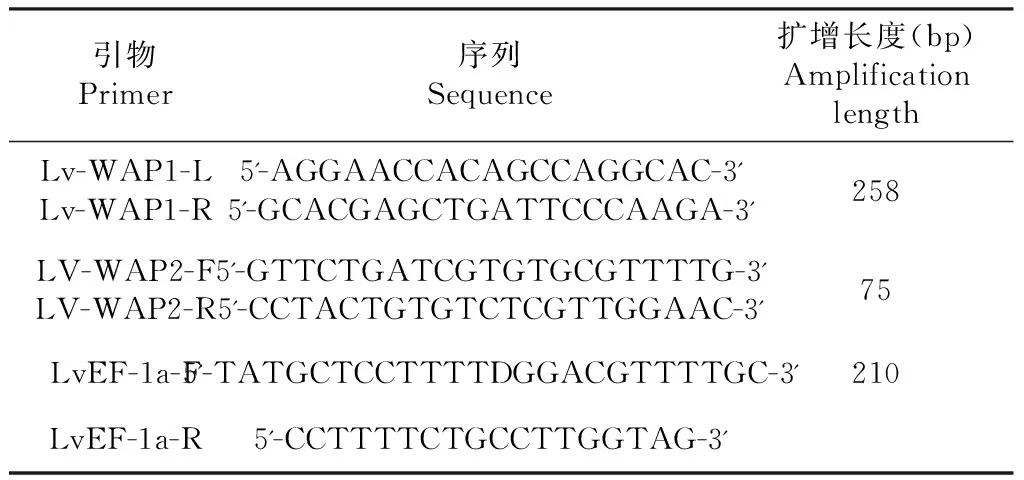
表1 引物设计
1.2.2 总RNA样品提取 参照TransZol UP Plus RNA Kit试剂盒说明提取凡纳滨对虾的11个组织总RNA,-80 ℃保存备用。所得RNA样品用分光光度计分别在260和280 nm处测定含量,取吸光比值(A260∶A280)大于1.8的RNA样品进行下一步试验。
1.2.3 RT-PCR逆转录 cDNA合成采用20.0 μl逆转录体系。在反应管中加入RNA模板3.0 μl,Reaction Mix(4×)2.0 μl,RNase-free H2O 3.0 μl,放入PCR仪42 ℃ 2 min,取出;加入Reaction Stopper(5×) 2.0 μl;5×All-in-one Matter Mix 4.0 μl,RNase-free H2O 6.0 μl。扩增程序:25 ℃ 10 min,42 ℃ 50 min,85 ℃ 5 min,4 ℃结束,cDNA第一链合成,取出置于-20 ℃保存备用。
1.2.4 PCR扩增WAP基因表达区域片段 PCR反应体系按照表2所示的用量置于0.2 mL PCR离心管中,加ddH2O混合定容至20.0 μl(均放在冰盒子上操作)。将装有样品的PCR离心管放入PCR仪中按下列程序进行PCR扩增。扩增程序:98 ℃预变性5 min;98 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,进行39个循环;72 ℃延伸10 min,4 ℃保存结束。PCR产物进行1.0 %琼脂糖凝胶电泳,电泳条件:110 V电泳20 min。电泳结束后对凝胶进行成像系统检测。
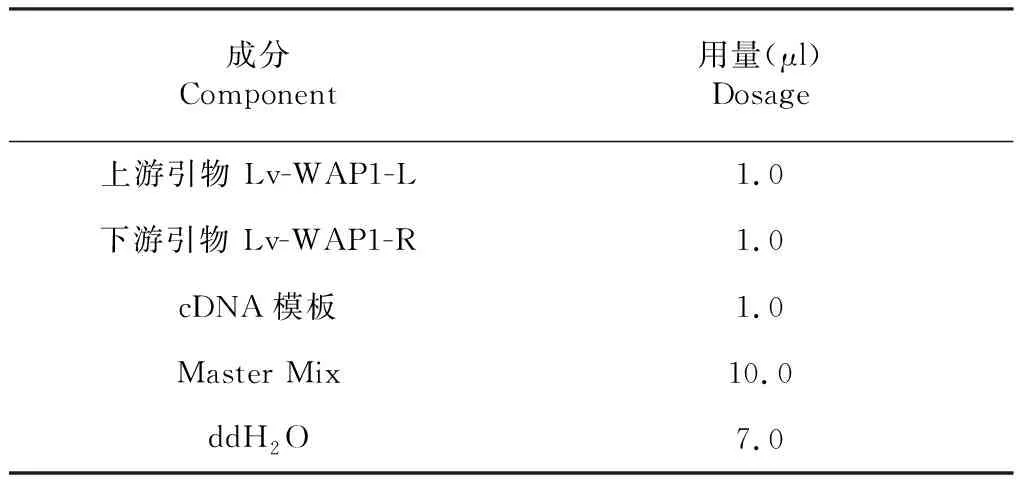
表2 PCR反应体系
1.2.5 实时荧光定量PCR 反应体系10.0 μl:PowerUpTMSYBR®Master Mix 5.0 μl,LV-WAP2-F 1.0 μl,LV-WAP2-R 1.0 μl,ddH2O 2.0 mL,cDNA模板1.0 μl;轻弹八连管管底将溶液混合,6000 r/min短暂离心。扩增程序:93 ℃ 3 min;93 ℃ 1 min,55 ℃ 30 s,共40个循环;72 ℃ 1 min。WAP基因的表达量经内参基因EF-1α(NCBI登录号GU136229)均一化处理数值后使用Livak(2-ΔΔCT)标准化方法计算。
1.2.6 WAP融合蛋白的表达 ①基因合成。pET-32a(+)-WAP测序验证采用基于PAS(PCR-based accurate synthesis)的方法合成WAP基因表达区全长片段,将其连接至pET32a(+)载体,获得的重组质粒pET32a-WAP转入TOP10克隆菌株,挑取阳性克隆子测序。质粒酶切鉴定酶切体系:质粒3.00 μl,内切酶XhoI 0.25 μl,内切酶ApaI 0.25 μl,10×Buffer 1.00 μl,加ddH2O定容至10.0 μl。②重组质粒pET32a-WAP转化至大肠杆菌Arctic Express。将1.0 μl重组质粒加入100.0 μl感受态细菌中,置冰上20 min;42 ℃热激90 s,迅速置冰中5 min,加入600.0 μl LB培养液;37 ℃、220 r/min摇床培养1 h,离心后全部涂布于含50.0 μg/mL Amp的LB培养基上,37 ℃倒置培养过夜。③IPTG诱导WAP融合蛋白表达。挑取转化培养基上的单克隆接种于含50.0 μg/mL Amp的3.0 mL LB培养液试管中,37 ℃、220 r/min摇床培养过夜;次日按1∶100接种于50.0 μg/mL Amp的30.0 mL LB培养液中,37 ℃、220 r/min摇床培养至菌体OD600为0.6~0.8;取出1.0 mL培养物,10 000 r/min室温离心2 min,弃上清液,用100.0 μl 1×上样缓冲液重悬菌体沉淀;向剩余的培养物中加入IPTG至终浓度为0.5 mmol/L,37 ℃、220 r/min摇床培养4 h,诱导融合蛋白表达;取出1.0 mL培养物,10 000 r/min室温离心2 min,弃上清液,用100 μl 1×上样缓冲液重悬菌体沉淀;剩余培养物4000 r/min离心10 min,弃上清液,用PBS重悬菌体沉淀;重悬液进行超声波破碎后,分别取上清液与沉淀液加入上样缓冲液重悬;进行12 % SDS-PAGE检测分析,考马斯亮蓝染色显带。④融合蛋白Ni柱亲和纯化。利用低压层析系统,上清液以0.5 mL/min流速上样至Ni-IDA Binding-Buffer预平衡的Ni-IDA-Sepharose Cl-6B亲和层析柱;用Ni-IDA Binding-Buffer以0.5 mL/min流速冲洗,至流出液OD280达基线;用Ni-IDA Washing-Buffer(20 mmol/LTris-HCl,20 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1.0 mL/min流速冲洗,至流出液OD280达基线;用Ni-IDA ELution-Buffer(20 mmol/L Tris-HCl,250 mmol/L咪唑,0.15 mmol/L NaCl,pH 8.0)以1.0 mL/min流速洗脱目的蛋白,收集流出液;上述收集的蛋白溶液加入透析袋中,使用20 mmol/L Tris-HCl、0.15 mol/L NaCl、pH 8.0进行透析过夜;进行12 % SDS-PAGE分析。⑤Western blotting鉴定。取纯化蛋白样品上样5.0 μl;上样完毕后,聚丙烯酰胺凝胶先90 V跑完积层胶,再将电压升至200 V直到电泳结束;电泳结束后取下凝胶进行恒压100 V转膜,约1.5 h,恒流250 mA;电转结束后,取下膜先用PBST洗涤4次,每次洗5 min;将膜置于5 %脱脂奶粉封闭液中37 ℃下封闭1 h;用封闭液稀释一抗(鼠抗His抗体),将膜放在一抗稀释液中4 ℃孵育过夜;次日将膜取出用PBST洗膜4次,每次洗5 min;用含5 %牛奶的封闭液稀释二抗(羊抗鼠),膜在二抗中37 ℃反应1 h;反应完毕后将膜取出置于干净盒子中洗膜4次,每次洗5 min。ECL显影,曝光。
1.2.7 重组蛋白与细菌多糖(LPS/PGN/LTA)结合分析 设计酶标板布局,每孔加4.0 μg LPS/PGN/LTA,37 ℃过夜;微孔板60 ℃下放置 30 min,然后用BSA(1.0 mg/mL)200.0 μl、37 ℃包被2 h;TBS洗3遍;用纯化的重组WAP蛋白(终浓度为0~25.0 μg/mL)200.0 μl加入相应反应孔,37 ℃孵育3 h,TBS洗4遍;加入HRP标记抗HIS抗体(1∶3000)100.0 μl/孔,孵育1 min,TBS洗4遍;按100.0 μl/孔的量加入平衡室温的TMB Solution显色液,37 ℃避光孵育15 min;在450 nm处读取数据。重复3次。
2 结果与分析
2.1 WAP基因在凡纳滨对虾组织的表达分布情况
利用RT-PCR对凡纳滨对虾眼柄、血细胞、鳃、肝胰腺、心脏、胃、肌肉、神经、肠道、后盲囊和表皮进行检测,结果发现WAP基因在11个组织均有表达(图1),表达量排序为血细胞>鳃>心脏>后盲囊>肌肉>肠道>胃>神经>表皮>眼柄>肝胰腺。其中,在血液细胞的表达量最高,在表皮、眼柄和肝胰腺的表达量较低。
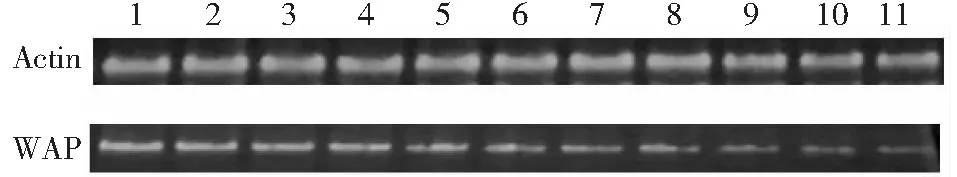
1:血细胞;2:鳃;3:心脏;4:后盲囊;5:肌肉;6:肠道;7:胃;8:神经;9:表皮;10:眼柄;11:肝胰腺1:Hemocytes;2:Gill;3:Heart;4:Cecum;5:Muscle;6:Intestines;7:Stomach;8:Nerve;9:Epidermis;10:Eyestalk;11:Hepatopancreas
2.2 WAP基因在感染病原凡纳滨对虾与健康凡纳滨对虾中的表达变化
实时荧光定量PCR检测结果(图2)表明,WAP基因在感染白便病凡纳滨对虾鳃组织的表达量是健康凡纳滨对虾表达量的5.9258倍,二者间差异显著(P<0.05,下同),在患白便病凡纳滨对虾肠道组织的表达量是健康凡纳滨对虾表达量的1.5147倍,二者间差异显著。说明感染白便病后凡纳滨对虾的WAP基因表达量显著上升。
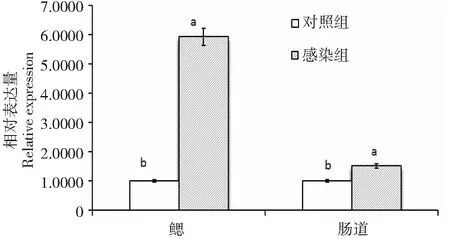
不同组织图柱上不同小写字母表示差异显著(P<0.05)Different lowercase letters on the bar of the different tissues represented significant difference(P<0.05)
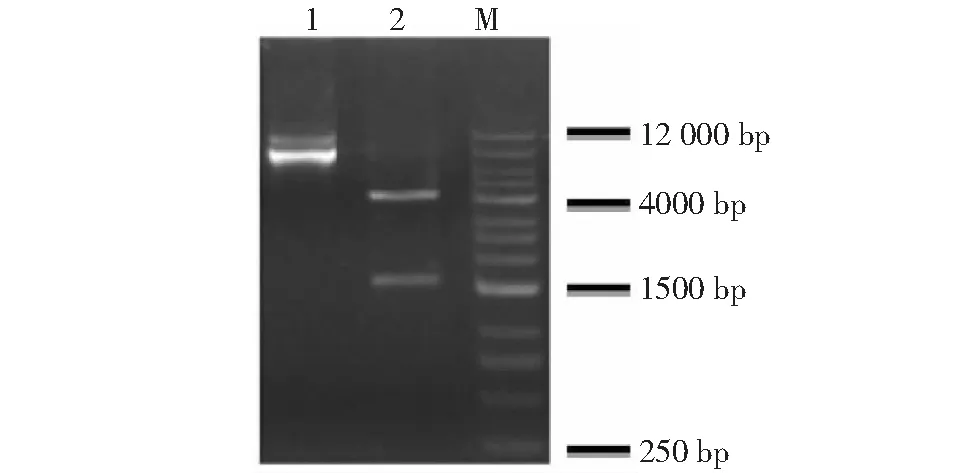
M:Marker;Line 1:酶切前质粒;Line 2:酶切后质粒M:Marker;Line 1:Plasmid before enzyme digestion;Line 2:Plasmid after enzyme digestion
2.3 WAP蛋白重组表达结果
2.3.1 重组表达载体双酶切鉴定结果 将基于PAS合成的WAP基因表达区全长片段连接至pET32a(+)载体,获得重组质粒pET32a-WAP,经XhoI和ApaI双酶切,结果(图3)显示,第二泳道有两条条带,一条为载体条带,一条为目的基因条带,表明原核表达载体构建成功。
2.3.2 WAP融合蛋白表达鉴定结果 使用 IPTG诱导表达目的蛋白WAP,优化表达条件,将诱导条件调整至 37 ℃,经SDS-PAGE检测分析,发现WAP融合蛋白呈可溶形式表达(图4)。
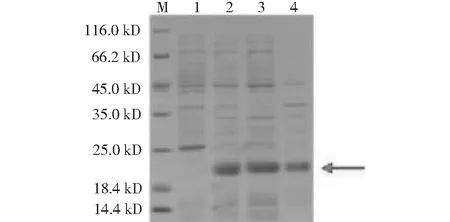
M:蛋白质分子质量标准;1:未诱导;2:诱导后;3:诱导破碎后上清;4:诱导破碎后沉淀M:Protein molecular mass standard;1:Uninduced;2:Induced;3:Induced supernatant after crushing;4:Induced precipitation after crushing
2.3.3 WAP融合蛋白纯化鉴定结果 利用IPTG诱导蛋白表达,经Ni柱亲和纯化后的SDS-PAGE检测分析结果表明,融合蛋白存在于上清液中,如箭头所示(图5);通过Western blotting鉴定分析,发现融合蛋白处在14~25 kD之间,位置如箭头所示(图6)。
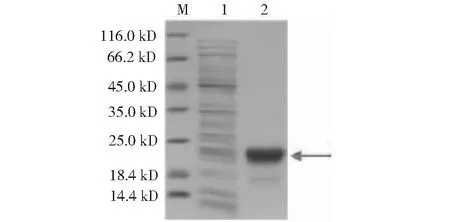
M:蛋白质分子质量标准;1:流出液 ;2:洗脱液M:Molecular standards for proteins;1:Effluent;2:Eluent
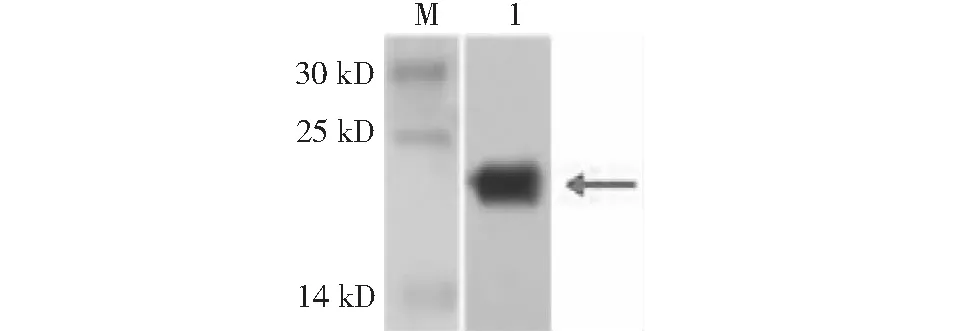
M:蛋白质分子质量标准;1:纯化后样品M:Protein molecular mass standard;1:Purified sample
2.5 WAP融合蛋白与细菌多糖的结合作用
将WAP融合蛋白与细菌多糖(LPS/PGN/LTA)混合,ELISA检测结果(图7)显示,随着WAP融合蛋白浓度的增加,除BSA对照组外其余各检测孔的OD均增加,且呈线性比率关系。相同WAP融合蛋白浓度下,各检测孔OD表现为PGN>LPS>LTA,且差异极显著(P<0.01)。说明WAP融合蛋白与细菌多糖(LPS/PGN/LTA)具有直接结合作用,且细菌多糖(LPS/PGN/LTA)结合WAP融合蛋白的能力排序为PGN>LPS>LTA。
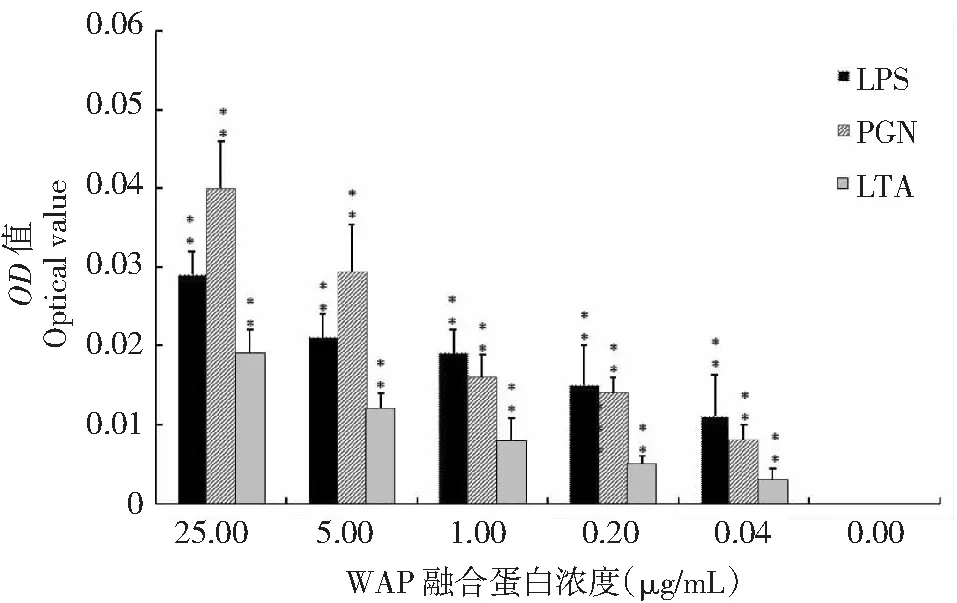
图7 WAP融合蛋白与细菌多糖结合作用分析结果Fig.7 WAP fusion protein expression binds to bacterial polysaccharides
3 讨 论
Crustins是富含半胱氨酸的阳离子抗菌肽,在N端包含一个富含甘氨酸、半胱氨酸或脯氨酸的区域,在C端包含WAP蛋白结构域[22-23]。已有研究表明,甲壳类Crustins具有蛋白酶抑制和抗菌活性[24-27]。对虾Crustins主要在血细胞表达,由于血细胞在其他组织的渗透及黏附,导致其他组织也常检测到Crustins存在[27-28]。但并非所有的Crustins都在血细胞中表达,日本囊对虾的MjCRS8和MjCRS9只在腮组织表达,斑节对虾的Crustin Pm 5主要在眼柄表达,在血液不表达[29-30];甲壳类动物抗菌肽主要在血细胞表达,然后通过血循环参与识别、吞噬、细胞毒性和黑化等过程,在抵御入侵微生物方面发挥重要作用[31]。本研究用RT-PCR检测WAP基因在凡纳滨对虾组织的表达情况,结果发现WAP基因在11个被检组织均有表达分布,其中在血细胞的表达量最高,在表皮、眼柄和肝胰腺的表达量较低,与Liu等[27]、Smith[28]的研究结果一致。作为Crustins家族的一员,WAP基因在凡纳滨对虾血液中最高量表达,推测其可能参与机体抗病作用。
白便病是目前凡纳滨对虾养殖业常见的一种疾病。本研究对比分析患白便病凡纳滨对虾与健康凡纳滨对虾的WAP基因表达差异,发现前者鳃和肠道组织的WAP基因表达量升高,据此推断WAP基因表达与对虾白便病具有某种程度的联系,作为一个抗病基因,WAP基因可能具有抗对虾白便病作用。对虾白便病的病因目前仍存在多种假说,藻毒素、微生物感染、微孢子虫、饲料霉变及投喂过量等因素均可能促使其发生[5]。但通过解剖和病理切片分析发现,患白便病对虾的肝胰腺结构和功能受损,肠道黏膜脱落[6],说明患病对虾炎症较严重。由于甲壳类的Crustins具有抗微生物作用[32-34],WAP蛋白被大量表达并通过血液被运输至炎症部位,而有利于消除病原微生物。因此,WAP基因表达量上升可能是对虾机体应对白便病炎症及抵抗外源微生物入侵的一种保护反应。
为了进一步明确WAP蛋白与抗微生物相关,本研究构建pET32a-WAP表达载体,经重组表达获得WAP融合蛋白。据报道,重组Crustins在体外具有细菌结合性能,斑节对虾的Crustin Pm 1和Crustin Pm 7、中国对虾的Fc-Lec 2、日本囊对虾的MjCru I-1及LPS、PGN和LTA均具有细菌结合特性[25,27,35]。Crustin特殊的分子结构使其带正电荷,且可能通过静电吸引作用与细菌的细胞膜相互作用,进而整合成脂质双分子层,形成膜孔或膜破裂[28,36]。Liu等[27]通过电镜观察证实MjCru I-1与K.pneumoniae共孵育后引起K.pneumoniae菌壁破碎及菌体萎缩。本研究发现,WAP融合蛋白同样具有与LPS、PGN和LTA结合的特性,推断WAP蛋白可结合到革兰氏阳性或阴性细菌,说明WAP蛋白可能参与了抗菌作用。
自瑞典科学家Boman于20世纪80年代首次发现天蚕素(Cecropins)以来,人类在植物、昆虫、鱼类、鸟类、哺乳动物、真菌和细菌等体内发现了上千种在结构与功能方面具有复杂多样性的抗菌肽[17]。除抗微生物作用外,Crustins还具有生理应激、创伤修复、组织再生及蜕皮等重要生物学功能[26,28,37]。因此,WAP基因在对虾白便病发展过程是否发挥了生理应激、创伤修复及组织再生作用,尚有待进一步探究。本研究虽证实患白便病凡纳滨对虾体内WAP基因表达量升高,但未确定WAP蛋白对白便病具有特异性作用,WAP蛋白的作用也许仅是众多抗病因子中的一员。同样,WAP蛋白与细菌表面的结合,也未具体确定到某种细菌,而这些细菌是否与对虾白便病有密切关联也有待进一步探究。
4 结 论
WAP基因与凡纳滨对虾抗病免疫功能密切相关,WAP蛋白在开发凡纳滨对虾抗病药物方面具有潜在应用价值。

