化学交换饱和转移衍生新技术的开发与临床应用
李丽, 王振雄, 方纪成, 甘桐嘉, 申楠茜, Kejia Cai, 朱文珍
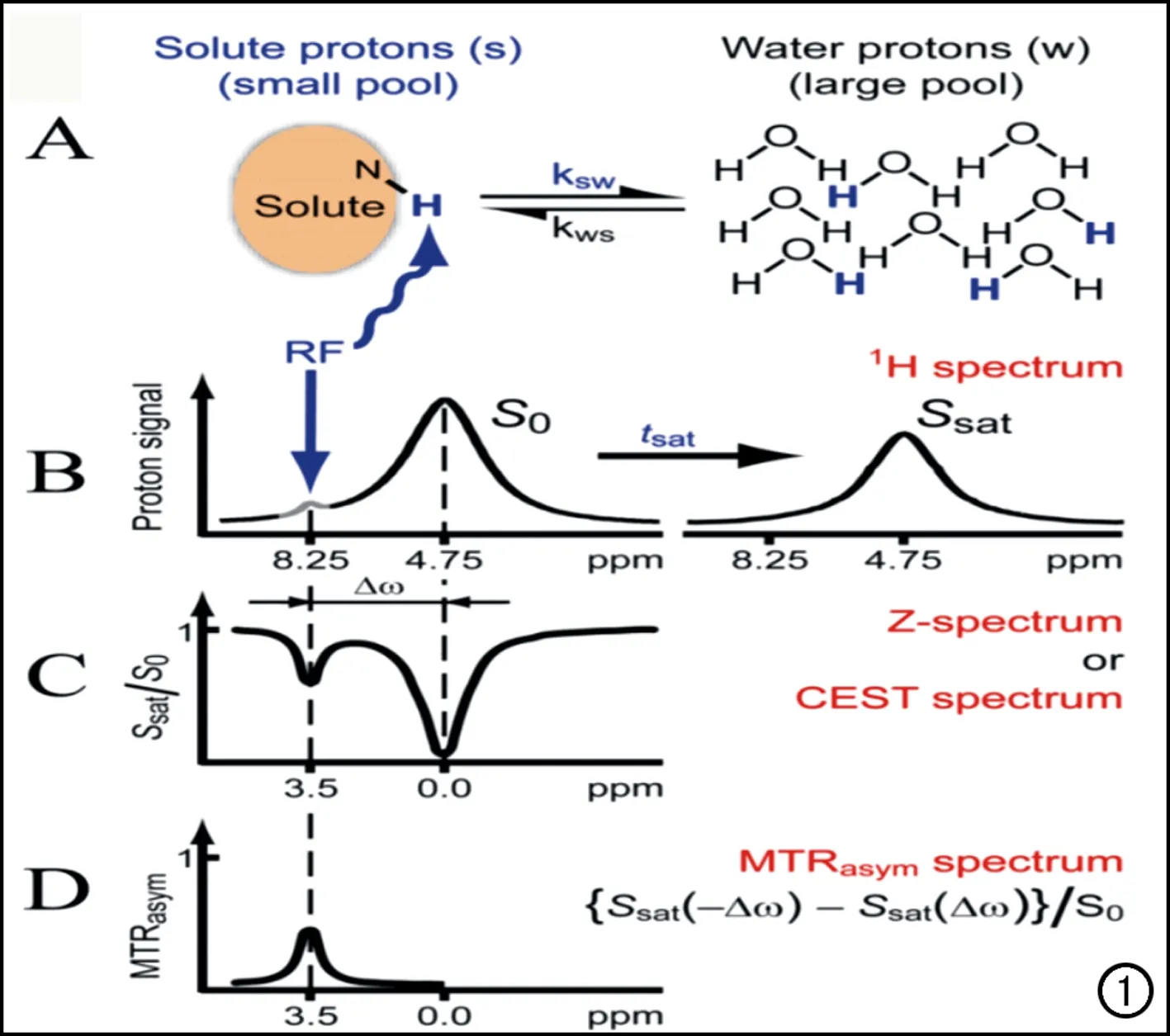
图1 CEST技术成像原理及交换效应的测量方法[11]。
化学交换饱和转移(chemical exchange saturation transfer,CEST)是一种新型的MRI分子成像技术,由Ward和Balaban提出[1],可以反映内源性和外源性含有可交换的质子或生物分子浓度。CEST具有独特的无创性、利用体内物质作为天然对比剂、无辐射等优点, 而且其成像原理灵活,受益面广,可以检测许多不同物质,使得CEST广泛应用于各个系统,并由此衍生出部分新技术,用于各种生物大分子物质及环境因素[内源性活性氧簇(reactive oxygen species,ROS)[2]、脂肪[3]、pH值[4]、蛋白质及多肽[5]、葡萄糖(Glucose)[6]、谷氨酸(Glutamate)[7]、肌酸(Creatine)[8]、肌醇(myo-inositol)[9]及葡聚糖(glycosaminoglycan,GAG)[10]等]的检测。根据CEST的基本原理及影响因素,多种CEST衍生新技术被开发出来,并应用于全身各个系统,用于测量各种物质在正常机体及疾病中的分布及其在病理生理过程中的作用。本文拟进一步阐述CEST衍生新技术的开发原理及其临床应用,旨在推动CEST衍生技术的进一步创新研究开发及应用。
CEST的基本原理
CEST基本原理中最为经典的是二池理论,也是最为容易理解的。如图1所示,两次模型中包括小池(溶质池)和大池(自由水池)。溶质池(一些生物大分子、脂质体等)含有可交换质子,CEST技术利用选择性射频脉冲使可交换质子达到饱和状态,通过化学交换作用将饱和效应传递给自由水池的水质子,从而引起水质子磁共振信号的降低,以此来获得生物体内这些分子的相关信息,从而间接反映物质浓度[11]。图1中以饱和酰胺质子NH为例,A图和图B显示溶质中的质子(蓝色)在被给与特定的饱和脉冲(8.25 ppm,此时水的特定位置为4.75)进行饱和。这些饱和的质子会与自由水中的质子(黑色)进行交换,形成交换速率(ksw)。经过足够长的饱和时间后(tsat),就可以检测出水磁共振信号的减低。S0是指没有进行饱和脉冲饱和时,测得的水的磁共振信号。Ssat是指进行饱和脉冲饱和后,测得的水的磁共振信号。C图显示将测得的Ssat进行标准化(Ssat/S0),作为曲线的Y轴,以饱和频率为X轴,即产生Z谱(或CEST谱或MT谱)。当以4.75 ppm的饱和脉冲饱和水质子时,水信号消失。这个频率在Z光谱中被指定为0 ppm。因此,酰胺质子的波谷位置位于3.5 ppm。D图显示最常用的参量是非对称磁化转移率[magnetization transfer asymmetry (MTRasym),MTRasym={Ssat(-Δω)-Ssat(Δω) }/S0,Δω为饱和的基团与水之间的频率位置差],通过消除水直接饱和(direct saturation,DS)的影响,获取MTRasym谱。
Pankowska等[12]利用CEST技术,在7T MR 扫描仪上进行大鼠丘脑扫描,获得体内的Z谱曲线(图2),显示不同体内物质在Z谱上的波谷位置。羟色胺类物质(5-羟色胺,色氨酸)位于5.4 ppm左右,酰胺类物质(蛋白,多肽)位于3.5 ppm左右,第一类胺类物质(GABA,谷氨酸,谷氨酸盐)位于3.0 ppm,第二类胺类物质(磷酸肌酸,肌酸)位于2.0 ppm,胺和羟基类物质(肌醇,胆碱)位于0.8~1.0 ppm,NOE效应(脂质,脂肪族类)位于-1.6~-4.6 ppm。借此,可以根据不同物质的饱和频率位置,进行选择性饱和,从而间接反映测量物质的含量。根据饱和峰位置不同的不同基团,衍生多种基于基团的CEST技术,如酰胺质子转移成像(amide proton transfer,APT)成像[5]、葡萄糖CEST成像(Gluco CEST)[6]、谷氨酸CEST成像(Glu CEST)[7]、肌酸CEST成像(Cr CEST)[8]、 肌醇CEST成像(MI CEST)[9]、葡聚糖CEST成像(gag CEST)[10]。
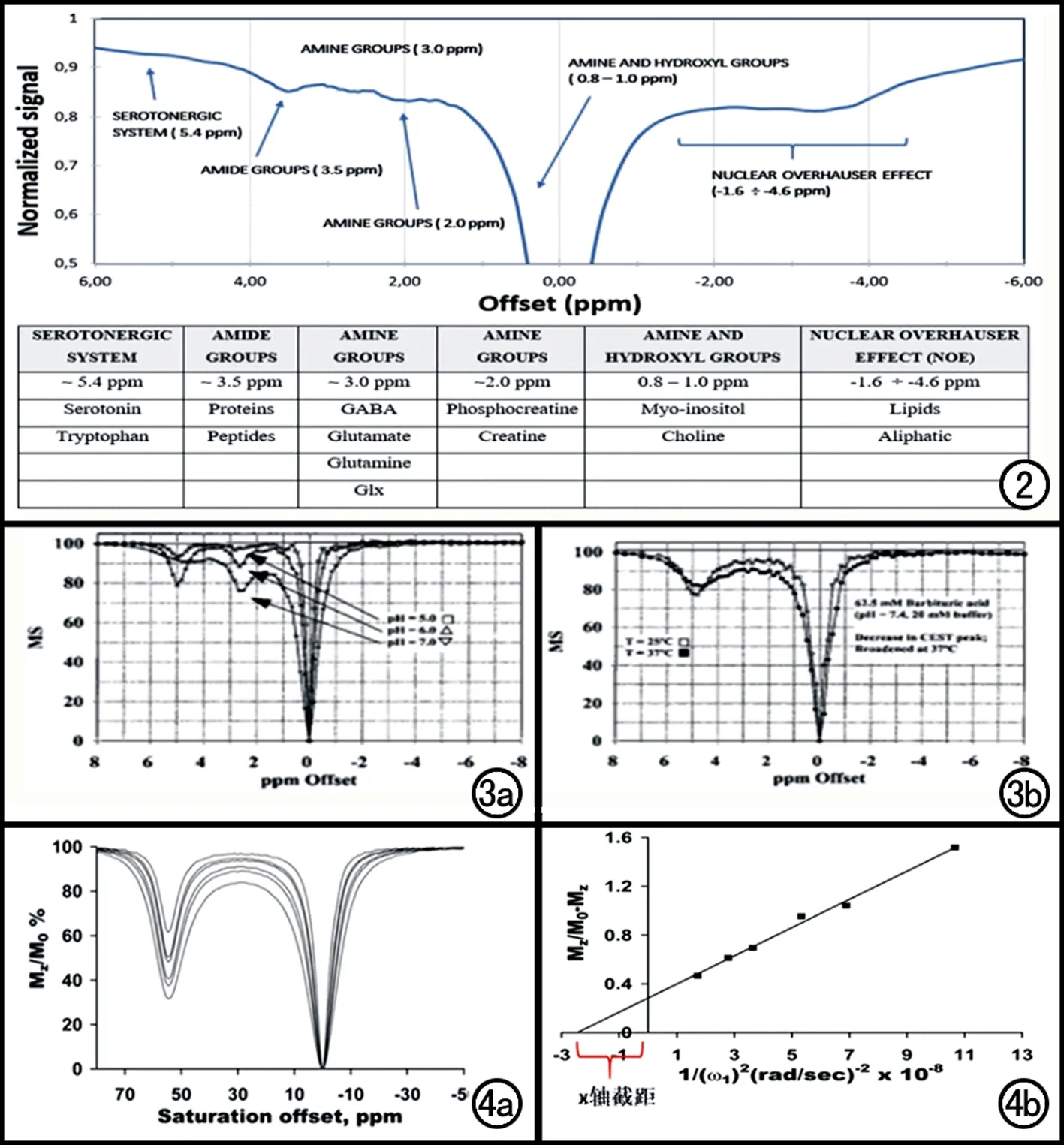
图2 大鼠丘脑的体内Z谱图:+6ppm到-6ppm频率范围之间的物质显示[12]。 图3 不同环境因素下,在7T场的磁共振扫描仪下获取的Z谱曲线。a) pH值分别为5.0、6.0、7.0的Z谱; b) 温度分别为25℃、37℃的Z谱[1]。 图4 a) 不同B1场强(487、 606、 689、 833、 952、 1212Hz)下,溶液pH值为7,温度为25℃,预饱和时间为10s,在9.4T场的磁共振扫描仪下获取的Z谱曲线; b) 利用A图生成Omega plot(y轴为Mz/(M0- Mz),x轴为1/(ω1)2)。ω 为B1场强,利用公式可以计算出x轴截距[22]。
CEST效应的影响因素
基于CEST效应的原理, CEST效应对被饱和的质子浓度(体内固有质子或对比剂),饱和质子与水质子之间的交换率,以及影响交换率的参数(如pH值、温度、缓冲液浓度等)敏感[1]。除此之外,CEST效应还取决于弛豫速率、磁场强度,实验参数包括重复时间、辐射频率的强度及时长和方案[13],以及图像读出方法这些设置参数[14-17]。van Zijl等[18]将200 mM的糖原溶液于相同的环境条件(37℃,pH=7.4)分别置于不同B0场(4.7T与9.4T)的磁共振扫描仪,发现9.4T中获取的CEST效应所致的化学位移差更好。因此,B0场场强越高,越有利于CEST效应研究。而Sun等[13]通过研究发现辐射频率的强度(RF power)受多因素的影响,包括B0场强、弛豫参数(弛豫速率,弛豫时长等),同时频率强度和时长对CEST效应的产生具有决定性作用[15-17]。此外,CEST效应对T1弛豫率(T1W)有较强的依赖性,而T2弛豫率(T2W)对CEST效应中的自由水的直接饱和DS发挥作用[14]。

图5 突发脑梗塞患者,梗塞位置位于右侧额顶叶,梗塞区域的Kex明显高于对侧对照(本院病例)。a) DWI图; b) Kex图。 图6 间变型少突胶质细胞瘤(Ⅲ级)患者,肿瘤位于右侧丘脑(本院病例)。a)T1WI图像;b)T2WI图像;c)T2 FLAIR加权图像; d) DWI加权图像; e) T1增强扫描图像; f) Kex图像。
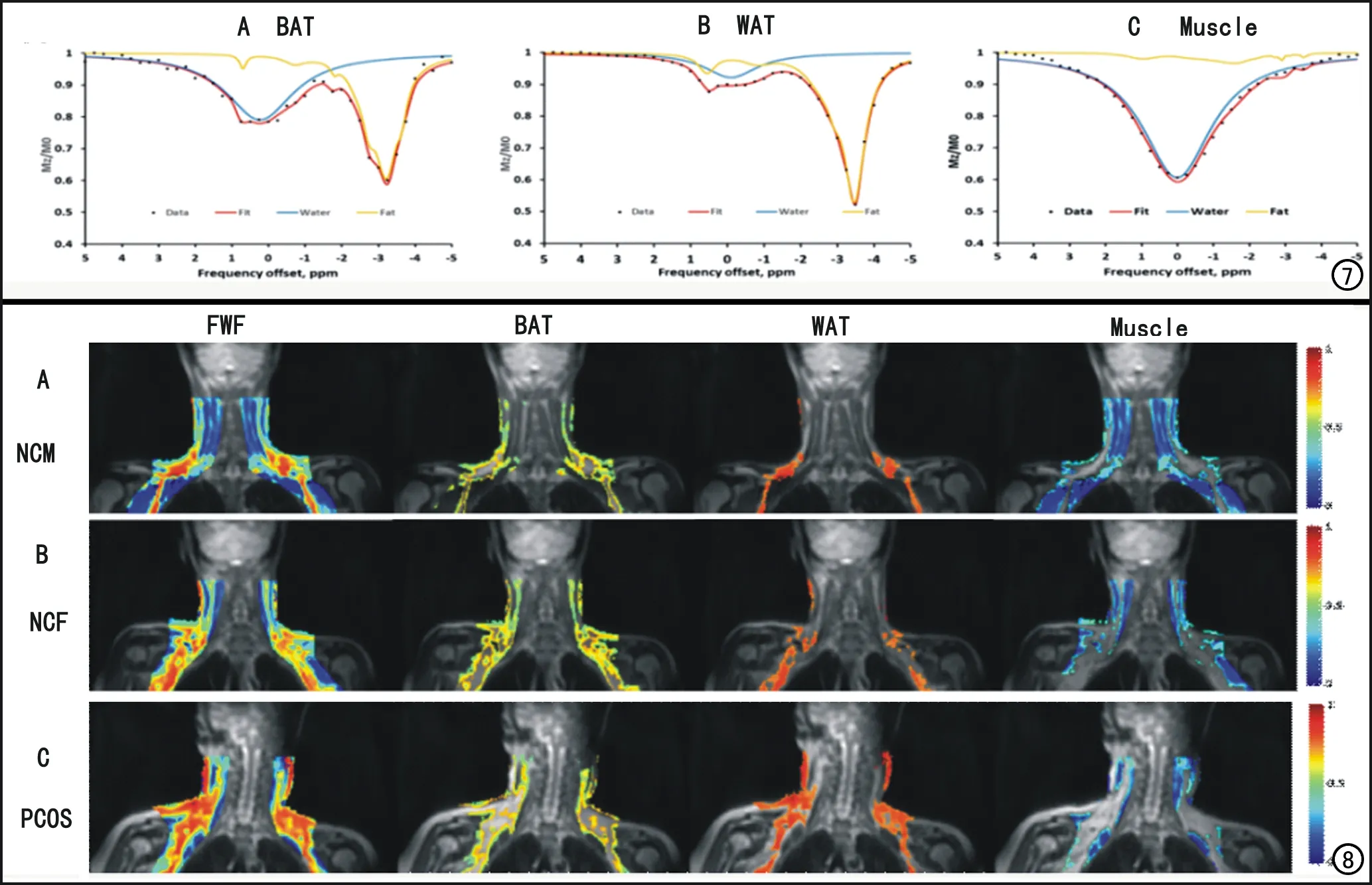
图7 典型的棕色脂肪(A)、白色脂肪(B)和肌肉(C)的Z谱曲线。水(蓝色曲线),脂肪峰(黄色曲线),直接拟合的多洛伦兹函数曲线(红色)[3]。 图8 正常男性NCM (A)、 正常女性NCF (B)和PCOS患者PCOS(C)的水脂分数(FWF)图,棕色脂肪(BAT)图,白色脂肪(WAT)图,肌肉(Muscle)图[3]。
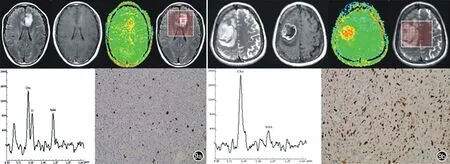
图9 低级别胶质瘤的Cho峰的升高和NAA峰的降低均比高级别胶质瘤要轻,APT值轻度升高,Ki-67指数相对较小。高级别恶性胶质母细胞瘤,表现为明显升高的Cho峰和降低的NAA峰,明显升高的APT值以及高Ki-67指数[5]。a) 低级别胶质瘤;b) 高级别胶质瘤。
而在体内应用CEST观察体内组织时,除了参数设置会影响CEST效应之外,组织本身的环境条件也会影响效应的测量。其中,最为重要的是组织的pH值及温度,图3显示的是不同的pH值和不同温度对CEST效应的影响[1]。因此,也可以基于pH值和温度的影响,利用CEST效应测量组织内的pH值及温度,探测疾病的病理生理过程[19],由此衍生出pH mapping和Temperature mapping等新的技术。
CEST衍生新技术
1.内源性活性氧簇(ROS)磁共振(endogenous ROS MR)技术
根据不同辐射频率的强度(B1场)产生不同的CEST效应,由此衍生出基于质子交换速率(proton exchange rate,Kex)的内源性ROS磁共振技术[2,20]。ROS MR可以检测机体内的ROS,从代谢水平对体内组织进行成像。ROS包括超氧阴离子(.O2-)、羟自由基(.OH) 和过氧化氢(H2O2)等[21]。当组织内的 ROS含量增加时,会促进组织内物质中氢H质子与水中氢H质子的交换速率加快[20]。而CEST成像通过预饱和射频脉冲激发物质基团中的质子,然后饱和磁化,再通过化学方法转移到水体中,从而使得MRI检测到的水体信号衰减,衰减后的信号通过饱和功率量化交换(QUantifying Exchange using Saturation Power,QUESP)计算出CEST中的质子交换速率Kex[2]。Shaghagh等[20]又利用Omega-plot方法计算Kex进行进一步优化。如图4所示,不同B1场下生成的Z谱存在差异,取1/(ω1)2为x轴,Mz/(M0-Mz) 为y轴,生成Omega plot图[22],再利用公式(1),就可以计算出x轴截距,即1/(Kex)2,从而可以计算出Kex,
(1)
从而反映组织内的ROS含量。ROS MR可以较好地显示正常志愿者的灰白质的Kex的不同,因为灰质的Kex明显高于白质,可利用Kex可以很好地分割灰白质。同时,该技术已应用于脑卒中(图5)与脑肿瘤(图6)患者中。在脑卒中患者的研究中发现Kexmap可以很好地显示梗塞区域,而且发现梗塞区域的Kex明显高于对侧对照,由此反映梗塞区域的ROS含量高于对侧,相关研究仍在进行。而在脑肿瘤患者的研究中(图6)Kex图可清晰显示间变型少突胶质细胞瘤的病灶,并显示了外囊受累,但是与ROS含量的关系尚在研究中。
2.水脂分数(FWF) ZSI image水脂分数相关Z谱成像技术
相关研究证实,棕色脂肪(brown adipose tissue,BAT)通过产生热量来改善葡萄糖耐量,增加胰岛素敏感性,促进体重减轻,从而影响全身代谢[23]。然而,由于PET/CT 辐射量大,且只能显示激活的棕色脂肪,使其的应用受到局限[24]。与白色脂肪组织(white adipose tissue,WAT)相比,棕色脂肪的含水量较高,而脂质含量相对较低[23],因此水脂分数(fat water fraction,FWF)已成为棕色脂肪检测的天然生物标志物[24]。MR中的Dixon技术和基于CEST的Z谱成像技术均可用于计算FWF和检测体内棕色脂肪含量,但是Z谱成像克服了Dixon技术受水和脂肪信号直接饱和对相位伪影的固有敏感性这一缺陷,具有更明显的优势[24]。如图7所示,基于棕色脂肪(BAT)、白色脂肪(WAT)、肌肉(Muscle)的Z谱曲线,可以较好地区分这三种组织。棕色脂肪具有中等大小的脂肪峰,中等大小的水峰;而白色脂肪具有较尖耸的脂肪峰,小而宽的水峰;肌肉具有大而宽的水峰,非常细小的脂肪峰。根据曲线的水峰和脂肪峰,可以根据公式(2)计算出FWF。
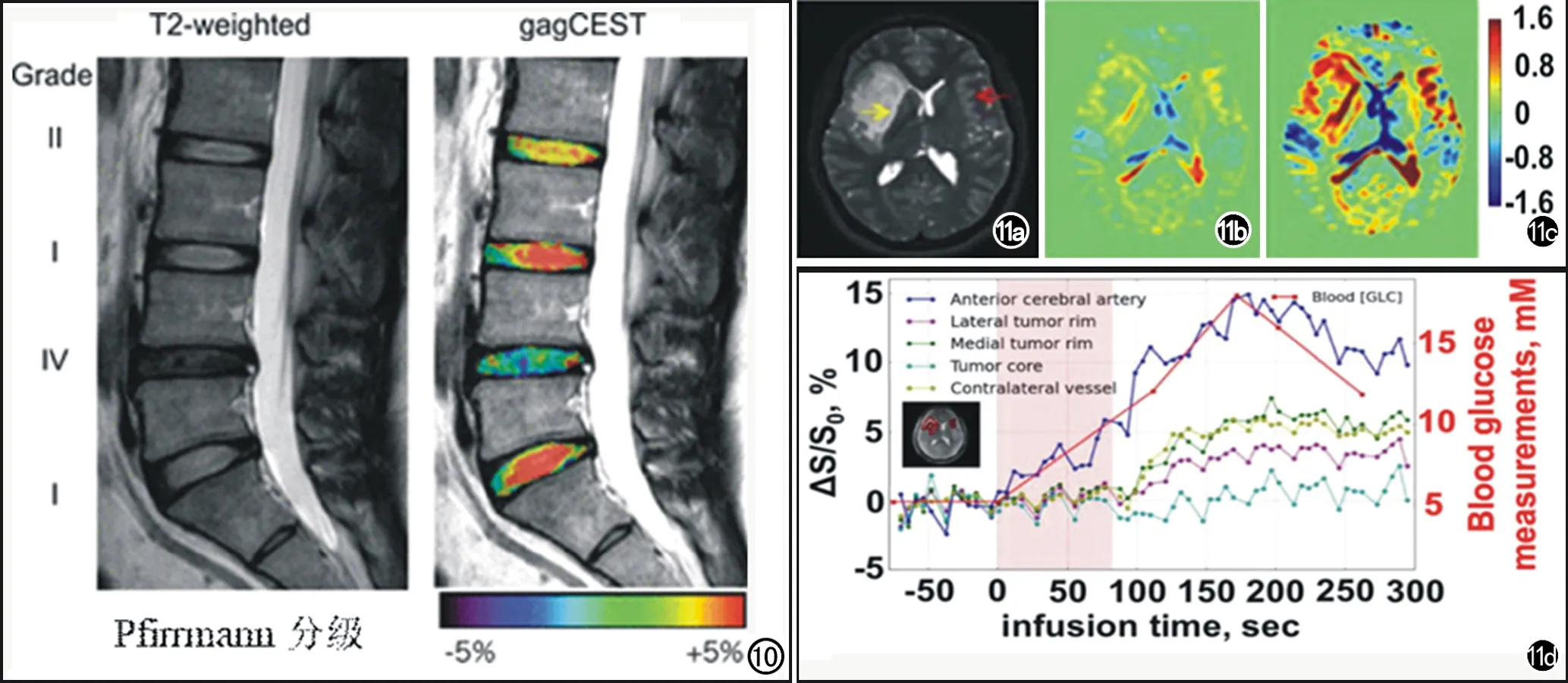
图10 T2图像上显示,由上向下椎间盘的Pfirrmann分级依次为Ⅱ,Ⅰ,Ⅳ,Ⅰ级,等级越高,gag CEST越低。 图11 a) T2WI图像; b) 葡萄糖注入早期的AUC图像; c)葡萄糖注入晚期的AUC图像;d) 不同感兴趣区的动态信号时间曲线,可以显示肿瘤区域及对侧的葡萄糖摄取情况。
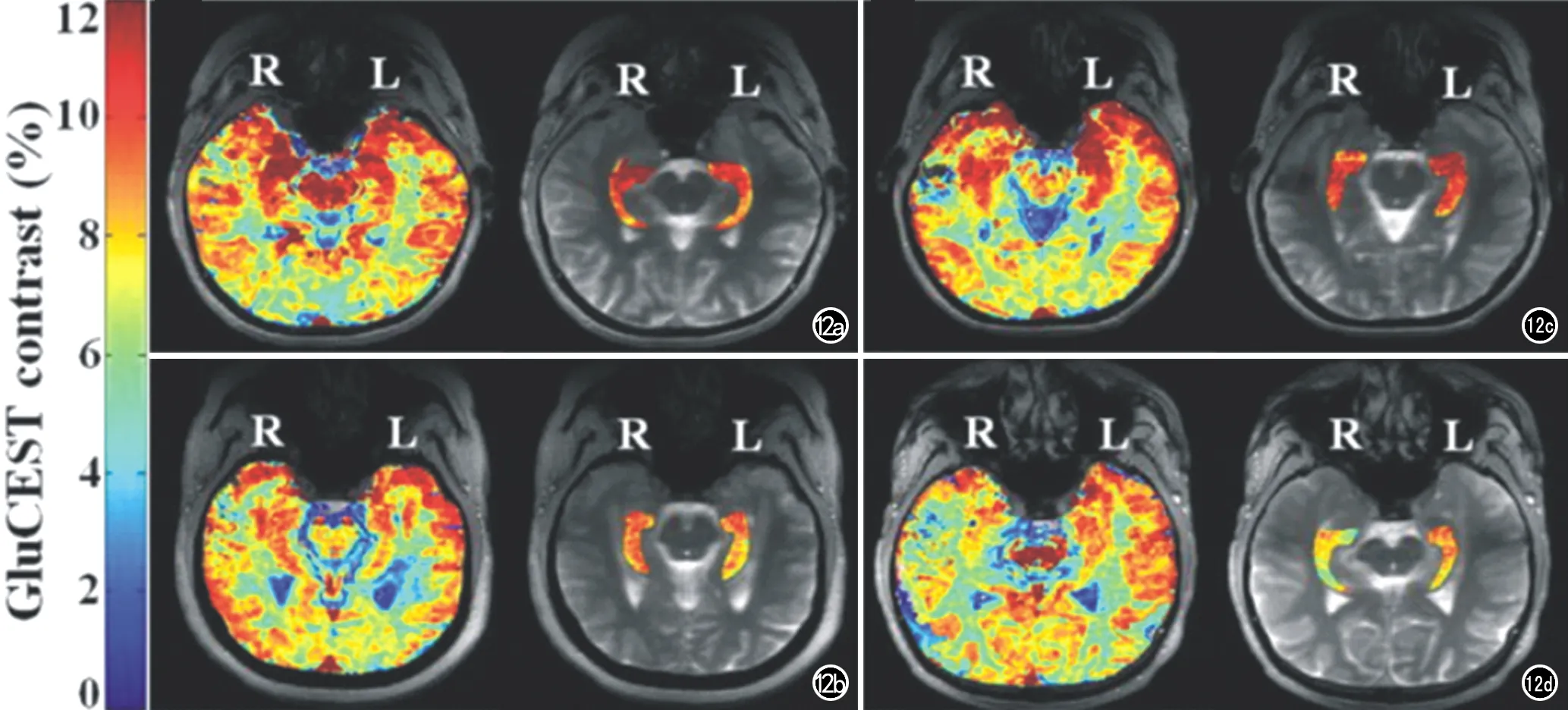
图12 颞叶癫痫的GluCEST-MRI表现。a、b) 右侧颞叶无灶性癫痫患者,右侧海马GluCEST信号明显增强; c、d)左侧颞叶无灶性癫痫患者,左侧海马GluCEST信号明显增强[28]。
(2)
然后,根据FWF的取值范围,FWF大于0.7的组织,为白色脂肪;FWF小于0.4的组织,为肌肉;FWF介于0.4~0.7之间的为棕色脂肪[3]。通过上述标准,即可在脂肪组织内区分出白色脂肪和棕色脂肪。本研究团队将FWF ZSI成像应用于正常女性、男性及多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者中,发现三者中正常男性具有较多的肌肉,正常女性具有较多的棕色脂肪,而PCOS患者具有较多的白色脂肪(图8)。通过统计学分析发现正常男性与正常女性在棕色脂肪含量上没有统计学差异,但是正常女性的棕色脂肪含量高于PCOS患者。正常男性的棕色脂肪活性最高,其次是正常女性,而PCOS患者的棕色脂肪活性受损。这一研究结果将有助于PCOS患者治疗疗效的监控,以及未来为以棕色脂肪为靶点的治疗方案提供依据[3]。
3.酰胺质子转移(APT)成像
酰胺质子转移(amide proton transfer,APT)成像技术是CEST技术中应用最为广泛,也是最为稳定和敏感的,主要应用于脑卒中与肿瘤。APT成像通过饱和酰胺基(-NH)中的质子,从而测定内源的游离蛋白质和多肽含量[5]。Sun等[25]将APT应用于脑卒中动物模型中,发现MTRasym能很好地显示卒中病灶,并与CBF和ADC减低区相对应,且 DWI-APT错配区可认定为缺血半暗带,此区血流灌注降低且存在酸中毒, 如果不加干预,进一步会发展为梗死区。而APT-PWI错配区仅灌注降低,并未出现酸中毒,为良性缺血区。根据APT技术,可衍生出内源性和定量pH加权的APT成像[26],用于显示脑缺血组织的pH值改变以及代谢紊乱。另外,APT技术也较多地应用于脑肿瘤。本研究团队将APT技术应用于胶质瘤中,发现APT在高、低级别胶质瘤中有统计学差异,且与肿瘤级别和反映肿瘤增殖活性的Ki-67有很好的相关性[5](图9)。此外,APT也被应用于其他系统的肿瘤及疾病中。
4.葡聚糖CEST成像(GAG CEST)
糖胺聚糖是软骨组织的重要组成成分,含有1个-NH基与3个-OH基,可以作为内源性CEST对比剂,与水进行质子交换。利用GAG CEST可以对葡聚糖进行直接的测量及成像。Togao等[27]利用GAG CEST研究正常椎间盘及退变椎间盘时发现与未退化的椎间盘相比,退化椎间盘中髓核的GAG CEST值显著降低(图10)。而Trattnig等[10]利用GAG CEST研究膝关节软骨成分,并将之与23Na MR进行比较,发现GAG CEST获得的关节软骨GAG分布图与23Na MR获得的GAG分布图一致,且空间分辨率较好。
5.葡萄糖CEST成像(Gluco CEST)
葡萄糖被认为是一种潜在的可生物降解的MRI造影剂,可用于肿瘤的葡萄糖摄取成像。Xu等[6]率先通过注入葡萄糖,利用Gluco CEST 研究正常志愿者及脑胶质瘤患者。因为葡萄糖分子结构中含有羟基(-OH),以其羟基中的氢质子作为可交换的质子,可以帮助实现对非标记的葡萄糖的摄取情况进行检测。通过对4例正常志愿者和3例脑胶质瘤患者的动态葡萄糖增强图像的观察,证实Glucose CEST可用于研究人体葡萄糖摄取,提供动脉输入功能、组织灌注、葡萄糖通过血脑屏障和细胞膜的转运以及葡萄糖代谢的信息(图11)。
6.谷氨酸 CEST 成像(Glu CEST)、肌酸CEST成像(Cr CEST)及肌醇CEST成像(MI CEST)
谷氨酸是中枢神经系统中常见的神经递质,与信号处理功能有关,其含有较多的胺基(NH),以其胺基中的氢质子作为可交换的质子,从而检测其含量。肌酸是生物能量系统中的主要代谢产物,与细胞能量代谢相关,在细胞营养供给方面发挥着重要作用。肌酸中的胺基的氢质子可作为交换的质子,从而检测肌酸含量。肌醇是神经胶质细胞增殖的标志物,以肌醇中的羟基的氢质子可作为交换的质子,从而检测肌醇含量。
Cai等[7]通过GluCEST技术对谷氨酸进行成像,分别显示了大鼠脑卒中模型、大鼠脑肿瘤模型及正常人脑的GluCEST图谱,证实了采用GluCEST绘制谷氨酸浓度的可行性,以及其他脑代谢物对GluCEST效应的贡献。Davis等[28]将GluCEST应用于无灶性癫痫患者中,发现癫痫侧的海马GluCEST的信号明显增强,说明谷氨酸与癫痫的发生密切相关(图12)。
Cai等[8]利用Cr CEST 技术对颅内胶质肉瘤和胶质瘤大鼠进行研究,发现CrCEST有助于区分不同侵袭性的胶质瘤。Kogan等利用Cr CEST 技术,在3T场强下观察运动前后骨骼肌能量代谢的游离肌酸(Cr)的空间分布,证实Cr CEST具有良好的空间分辨率,能够区分受试者肌肉运动前后的差异。
肌醇是神经胶质细胞增殖的标志物,在早期阿尔茨海默病(AD)的病理学中已被证实增加。利用内源性MICEST技术,可以定位脑内MI的浓度和胶质细胞增殖。Haris等[9]将MICEST技术应用于AD转基因小鼠模型以及对照小鼠的脑中,发现AD小鼠的MI含量增高,与病理中胶质纤维酸性蛋白的免疫染色显示出的胶质细胞增殖相一致,证实胶质细胞增殖在AD病理早期诊断中的潜在意义。
展望
CEST作为一种极具灵活性的分子成像技术,具有很大的临床应用前景。CEST根据其饱和基团的不同,可测量的物质种类丰富;CEST也基于各种影响因素的影响,恰恰可以用于展现组织内微观环境的改变,从而反映病理生理学的机制。随着研究的深入,CEST将在临床影像诊断及疗效监控等应用领域进一步拓展,而且极有可能在分子及微观机制研究水平方面发挥重要作用。

