安康鱼肠中胶原蛋白与多糖的提取与保湿性
杨辉,赵新宇,解海洋,宋洁,杨东晓,刘笑茹
(辽东学院,辽宁 丹东 1 1 8 0 0 3)
胶原蛋白在化妆品、皮革、食品、生物医学材料、膜工业、制药业等方面应用广泛[1],是动物来源最丰富的蛋白,大概占动物总蛋白的30%[2]。
安康鱼属冷温性底层鱼类,常栖伏海底,分布于北太平洋西部,我国产于东海北部、黄海及渤海[3]。由于安康鱼不仅营养丰富还具有一定的药用价值,逐渐受到人们的欢迎,其需求量连年上涨,加之出口需求旺盛,产量和价格大幅增加,安康鱼出口已成为我国的新兴产业。但在安康鱼的深加工中,被视为下脚料的鱼肠遭到大量废弃,这不仅浪费了渔业资源而且污染环境。
目前已有研究报道水产动物的胶原蛋白在一些方面明显优于陆生动物的胶原蛋白,比如具有低抗原性、低过敏性等特性。因此水产胶原蛋白可能逐步替代陆生动物胶原蛋白[4]。而多糖具有良好的保湿作用,故两者可作为化妆品的有效成分。此外,胶原蛋白水解物还可用马来酸酐酰化后与丙烯酸共聚,制得一种阴离子蛋白复鞣剂。
实验从安康鱼肠中提取胶原蛋白和多糖,探索安康鱼肠的高价值加工利用途径和经济效益。以安康鱼肠为原料,通过实验确定安康鱼肠胶原蛋白和多糖的最佳提取条件。
1 材料与方法
1.1 实验仪器
AB204-E电子天平(精确到0.0001),梅特勒-托利多仪器(上海)有限公司;UV-9000紫外可见分光光度计,北京普析通用仪器有限公司;高速台式离心机,湖南湘仪实验仪器开发有限公司;RE-2010旋转蒸发仪,广州市星烁仪器有限公司;RHG-100在线干燥仪,武汉瑞恒工控技术有限公司;Corneometer 825 Courage Khakaza Cologne Germany皮肤水分含量测试仪;CN63M索氏提取器,北京中西远大科技有限公司;DHG-9055A台式鼓风干燥箱,重庆市松朗电子仪器有限公司。
1.2 试剂及其配制
氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、氯仿、(NH4)2SO4、Tris- 醋酸、醋酸钠、EDTA、SDS(十二烷基硫酸钠)、葡萄糖、95%乙醇、正丁醇、石油醚、苯酚、浓硫酸均为分析纯,均购自福晨(天津)化学试剂有限公司;胃蛋白酶(比活力1∶3000),上海沪震实业有限公司;Sevag试剂 [氯仿∶正丁醇=5∶1(V/V)];PBS(磷酸缓冲溶液:氯化钠 2.0000 g,氯化钾0.0500 g,磷酸氢二钠0.3600 g,磷酸二氢钾0.0600 g,加蒸馏水定容至250 mL);细胞裂解液(0.04 mol/L Tris-醋酸溶液,0.02 mol/L醋酸钠,0.001 mol/L EDTA,1%SDS)。
1.3 样品预处理
①鱼肠预处理[5]:安康鱼肠解冻洗净,除去内层杂物与外层肥膏,切成块状,用2.5%NaCl溶液处理10 h,离心,去除废液,作为提取的原料;
②80℃恒温烘干(冷冻过的鱼肠,烘干较快),在烘干之前将鱼肠剪碎,以增大烘干速率,鱼肠烘干至重量不再变化;
③将烘干的鱼肠磨成粉末,封藏备用。
1.4 胶原蛋白和多糖提取
1.4.1 胶原蛋白的提取
①粗提:将研磨的鱼肠粉放入高速台式离心机中调节转速2000 rpm离心10 min;弃上清,沉淀用预冷的PBS悬浮,2000 rpm离心10 min;弃上清,将沉淀重悬于预冷的缓冲液中冲洗,4℃,2000 rpm离心10 min;弃上清,将沉淀重悬于200 mL预冷的细胞裂解液中,摇匀、冰浴30 min,得到沉淀粗产物低温烘干备用。
②酶解除去杂蛋白:将①得到的沉淀与蒸馏水以一定的料液比取好,加入定量的胃蛋白酶,调节溶液pH值及酶解时间,在10℃下匀浆后过滤,滤液以8000 rpm低温离心20 min,取上清液;
③盐析:取上清液用NaOH(0.4%)溶液调试样pH至7.0,缓慢加入固体(NH4)2SO4,使其浓度达到1.5 mol/L,不断搅拌至固体完全溶解,静置10~12 h。盐析完成后低温离心取沉淀,最后用0.5 mol/L HAc溶液洗脱沉淀,于-18℃低温保存,按文献[6]方法计算提取率。
④测量保湿性:在室温(25℃)环境下,用电容皮肤水分含量测试仪测定皮表含水量。
1.4.2 多糖提取
①将鱼肠粉用滤纸包装后,用石油醚进行索氏脱脂处理,脱脂1.5 h后用80℃烘箱烘干;
②以蒸馏水为溶剂,在一定的料水比、温度和提取时间下,进行鱼肠多糖的提取。将鱼肠提取液抽滤,合并滤液,浓缩至25 mL,加入95%乙醇至终浓度为75%,醇沉,静置24 h,待多糖呈絮状沉淀析出后,5000 rpm离心15 min得沉淀(如果醇沉效果好无需离心);
③沉淀中加入50 mL蒸馏水复溶,将水溶液置于分液漏斗中,加入12 mL Sevag试剂,以除去溶液中的蛋白质;上清液中加入0.5%的活性炭,摇匀,恒温静置30 min,过滤得多糖溶液,采用苯酚硫酸法[7]测其含量,其多糖提取率按下式计算。

④测量保湿性:在室温(25℃)环境下,用电容皮肤水分含量测试仪测定皮表含水量。
2 结果与讨论
2.1 提取胶原蛋白最佳酶条件的确定
要想提高安康鱼肠胶原蛋白的提取率,必须想办法增大其溶解度,本实验选用酶法提取鱼肠中的胶原蛋白。实验从选择不同的料液比、胃蛋白酶的添加量和提取时间三个方面来确定最佳的提取工艺。
2.1.1 用单因素法确定胃蛋白酶的最佳添加量
分别选取胃蛋白酶质量分数 (胃蛋白酶占鱼肠的百分数)0.5%、1.0%、1.5%、2.0%,进行实验。实验时先将其它四个量固定,如料液比为1∶10,酶解时间4 h,酶解温度10℃,pH 1.9。结果如图1所示,在胃蛋白酶添加量为1%时,提取效果较好。当胃蛋白酶添加量为0.5%时,提取液中胶原蛋白得率偏低,而胃蛋白酶添加量为1.5和2%时,提取液中胶原蛋白得率虽然比1%时高,但高的不多,2%时也只高了0.13%,而酶用量却增加了一倍,这是因为酶量过低,底物不能充分反应,过高又会引起酶分子之间的相互作用,阻止酶解反应的顺利进行[8],所以1%的胃蛋白酶添加量是最佳胃蛋白酶添加量。

图1 最佳胃蛋白酶添加量的确定
2.1.2 最佳酶解时间
由2.1.1可知胃蛋白酶添加量为1%时,按料液比为1∶10,酶解温度10℃,pH 1.9的条件,选择酶解时间分别为 1 h、2 h、3 h、4 h、5 h 进行实验。由图 2所示,提取效果最好的是酶解时间4 h。随着提取时间的增加,鱼肠中胶原蛋白提取率开始逐渐增加,到4 h后,鱼肠中胶原蛋白得率开始降低,故确定最佳酶解时间为4 h。
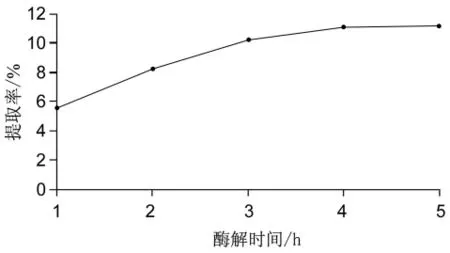
图2 最佳酶解时间
2.1.3 最佳料液比的确定
在固定了胃蛋白酶质量分数1%,酶解时间4 h,酶解温度10℃,pH 1.9条件下,考察料液比对胶原蛋白提取率的影响。分别取料液比为1∶5、1∶10、1∶15和1∶20四个水准,以料液比为变量进行考察,实验结果如图3所示。结果表明,当料液比为1∶10时提取效果最好。当料液比继续增加,鱼肠中胶原蛋白得率逐渐降低,故确定最佳料液比为1∶10。
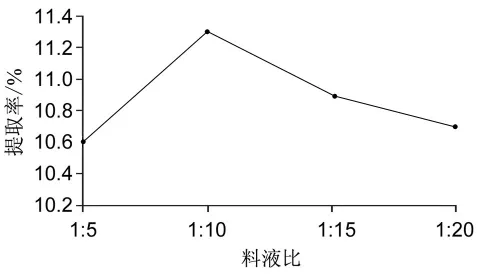
图3 最佳料液比的确定
2.2 提取多糖最佳条件的选择
2.2.1 最佳料水比的选择
因为多糖易溶于水,所以用蒸馏水为溶剂,固定提取温度为90℃,提取时间为2 h,比较料水比1∶3、1∶4、1∶5、1∶6、1∶7 时鱼肠多糖的提取率。如图4所示,当料水比为1∶5时多糖的提取率最高,故最佳料水比定为1∶5。
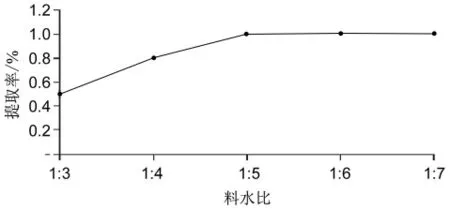
图4 最佳料水比
2.2.2 最佳提取时间的选择
由2.2.1可知最佳料水比为1∶5,同时固定提取温度 90℃,比较提取时间 1 h、2 h、3 h、4 h 时的多糖提取率。以鱼肠多糖提取率为指标,以提取时间为横坐标,进行鱼肠多糖的提取研究。由图5可见,当提取时间为2 h时,提取效果最好。
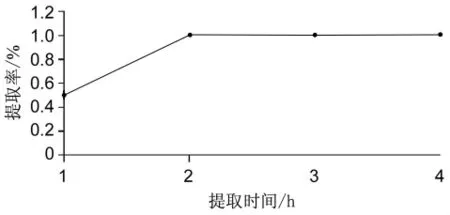
图5 最佳提取时间
3 吸湿性(M M V/%)测试结果
在室温下使用电容皮肤水分含量测试仪测试皮表水分,以不涂试剂为空白,比较了常用的保湿剂透明质酸原液、丙三醇和本实验从安康鱼肠中提取的胶原蛋白、多糖[9](各5 g)在人体皮肤上的保湿性,结果如表1所示。
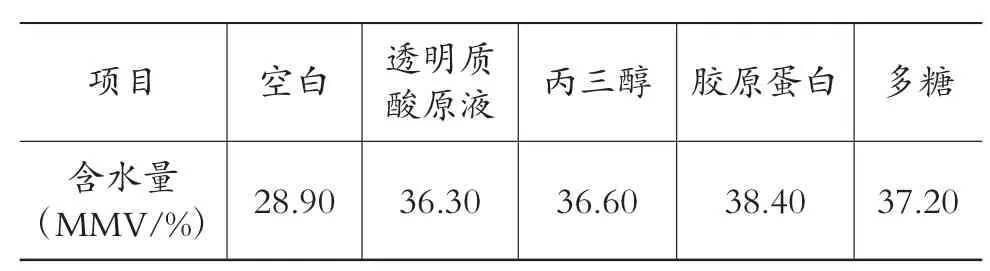
表1 各种保湿剂在皮肤上的含水量
由表1可见,安康鱼中的胶原蛋白和多糖有一定的保湿功效。
4 结语
利用单因素实验选取了提取安康鱼肠中胶原蛋白及多糖的最佳工艺,结果发现安康鱼鱼肠胶原蛋白提取时,最佳液料比为1∶10,最佳胃蛋白酶质量分数为1%,最佳酶解时间为4 h条件下,提取效果最好,其提取率为11.3%。多糖在脱脂1.5 h后以蒸馏水为溶剂,料水比1∶5、温度90℃和提取时间2 h时,提取效果最好,其提取率为1%。分析发现,本实验提取胶原蛋白的价值较大,对于多糖的提取效果较差,有待于进一步改进。
安康鱼肠中多糖与胶原蛋白质均具有良好的吸水性和保湿性,如果和一些无机吸水物质复配可以配成良好的化妆品[10]及皮革复鞣剂,为皮革复鞣剂合成提供了新思路,这是我们下一步要做的工作。若能对大量废弃鱼肠规模化处理,有效提取鱼肠中的胶原蛋白和多糖,不仅可以节约资源及减少环境污染,而且还绿色环保,符合现代的绿色可持续发展理念。

