利用废革屑制备不同分子量肽-Zn螯合物的工艺探究
王明英 ,葛淑华 ,袁艳 ,刁 ★,王全杰 ,,段宝荣 ,王雪 ,栾俊
(1.烟台大学化学化工学院,山东烟台2 6 4 0 0 5;2.国家制革技术研究推广中心,山东烟台2 6 4 0 0 5)
我国是世界第一制革大国,每年皮革产量约6亿平方米,约占世界的四分之一。制革业作为我国轻工业中的支柱产业,每年在为我国社会发展带来利益的同时也产生大量的废水、废气和固体废弃物,并对环境及生态平衡带来巨大的压力,制革废弃物的产生和无法处理或者处理不当已经严重阻碍制革行业发展[1]。据统计,目前我国原料皮利用率只有约35%,剩下大部分以制革废弃物的形式被丢弃。这些固体废弃物中除了有少量的毛发、肉渣等非胶原蛋白以外,大部分是原皮修边角料、灰皮片削皮屑等不含铬胶原和蓝革削匀、修边等产生的含铬胶原废弃物,造成极大的资源浪费[2-4]。据报道,印度每年产生15万吨的制革固体废弃物;美国每年产生的制革废弃物就达30万吨(只限含铬废弃物);而我国每年产生的皮革固体废弃物就达140多万吨[5]。面对如此严峻的环境压力,提高固体废弃物的利用,使之向高值化方向发展,避免利用中的二次污染已经成为该领域的难点和热点。
微量元素多肽螯合物的最早研究始于60年代。70年代后期,首次由美国Albion实验室,以动植物蛋白和铁元素为原料合成了蛋白铁的螯合物,由此开始了蛋白或多肽螯合物的研究与开发[6-8]。对于微量元素多肽螯合物的研究,国内直到上世纪90年代初期才开始有了对它的研究。锌是几种植物生理过程中植物和花序的必需营养元素,即光合作用,呼吸作用,蛋白质、DNA、RNA和植物激素的合成[9]。缺锌是全球植物最常见的微量营养素缺乏症之一[10]。
化学肥料通常用于增加土壤中的锌可利用性,并在营养液培养中保持该元素对植物的理想浓度[9]。农业土壤中使用的锌的来源是无机锌肥料、合成和天然有机螯合物[11]。无机锌肥源在锌质土壤中的效率相对较低,因为某些农艺限制,即沉淀为不溶性固体及其高杂质[12]。合成螯合物可以有效解决缺锌的问题,但价格昂贵。合成螯合物载体的低降解性也是一个环境问题[13]。P.Mohammadi[14]等人合成三种锌氨基酸螯合肥,并应用在莴苣中,结果发现锌营养可以部分缓解盐碱对莴苣根生长引起的损害。刘音[15]发现氨基酸螯合肥在促进芹菜和小白菜的生长发育、增加产量、改善品质方面具有显著作用。张西兴[16]等人以谷氨酸和硫酸锌为原料制备出的螯合锌肥料,螯合率可以达80%以上,在定性条件下再次证明了螯合的稳定性。邢颖[17]等人利用乙二胺四乙酸与锌盐进行螯合制备出乙二胺四乙酸锌铵,作为一种补充锌元素的螯合肥料。Zhang[18]等人研究醇糖螯合硫酸锌,施用在富士苹果树上。研究将螯合锌肥施用可以明显降低果实膨大期蔗糖含量,增加果实成熟期蔗糖含量;显著提高了果实膨大期和成熟期的果糖含量和葡萄糖;使幼果期和膨大期山梨醇含量显著降低。
锌对植物生长有着不可忽视的作用,本文主要利用革屑制备多肽-Zn螯合物作为植物生长的肥料,既实现废弃革屑的回收利用,又解决了废弃革屑的污染问题,实现了其资源化利用,合成的多肽-Zn螯合物有机肥料可用于农业。
1 材料与方法
1.1 试剂与仪器
革屑:河北辛集东明皮革厂;邻苯二甲醛:上海源叶生物科技有限公司,分析纯;其他化学试剂均为分析纯。
JH-752型紫外可见分光光度计:上海菁华科技仪器有限责任公司;SPD-50型自动定氮仪:上海晟声自动化分析仪器有限公司;Nicolet 80 FTIR型傅里叶红外光谱仪:美国;旋转蒸发仪:上海亚荣生化仪器厂;SYP-D型恒温水浴锅:上海亚荣生化仪器厂;DHG 101-00B型恒温恒湿箱:上海博迅实业有限公司医疗设备厂;TYPE SPT12型消解仪:上海仪真分析仪器有限公司;TG16-WS型台式高速离心机:湖南赫西仪器装备有限公司;SHZ-D(III)型循环水式真空泵:巩义市予华仪器有限责任有限公司;JJ224BC型电子天平:常熟市双杰测试仪器厂;Viscotek TDA305max多检测器凝胶渗透色谱:英国Malvern仪器有限公司;AA-6880型石墨炉原子吸收光谱仪,岛津企业管理有限公司。
1.2 实验方法
1.2.1 不同分子量多肽的制备
称取50 g革屑于500 mL的三口烧瓶中。液比为5∶1,NaOH用量分别为8%、15%、20%。反应温度分别为 8℃、100℃、80℃(内温),反应时间 6 h、8 h、10 h,反应结束后,对水解液进行离心、抽滤处理得到三种不同分子量多肽,并利用GPC测定其分子量。
1.2.2 多肽螯合Z n的制备
本探究中,利用碱水解多肽与Zn(CH3COO)2进行螯合反应,实验流程如图1。
对所得到的水解液进行浓缩,使其固含量在30%左右。在所得到的浓缩液中加入Zn(CH3COO)2,在一定温度、pH和时间下将多肽-Zn螯合。用有机溶剂无水乙醇对螯合液进行沉淀处理,并进行多次冲洗以除尽Zn离子。将所得沉淀进行烘干处理,并研磨成粉末。
1.2.3 螯合率测定方法
将上述多肽-Zn螯合物用标定后的EDTA进行滴定,测定螯合锌离子含量,进而求取螯合率。采用标准浓度为0.02 mol/L EDTA溶液进行滴定,按如下公式计算螯合率:
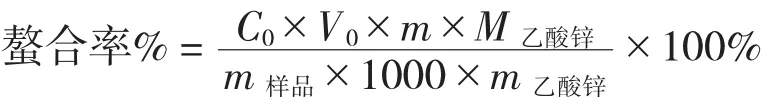
式中:C0——EDTA浓度(mol/L);
V0——消耗EDTA的体积(mL);
M乙酸锌——Zn(CH3COO)2的摩尔质量;
m——获得螯合物总质量(g);
m样品——用于滴定的样品质量;
m乙酸锌——加入的无水Zn(CH3COO)2的质量(g)。
这种方法的前提是水解液中除了多肽和多肽-Zn螯合物外,几乎没有可溶性固体物质。
a.绘制标准曲线
取一定量铬标液准确配制浓度梯度为0、0.004、0.008、0.012、0.016、0.020 mg/L 的标准工作液。分别将各浓度的标准工作液放入石墨炉原子吸收光谱仪(AAS)的样品管内,测定其吸光度,并绘制标准曲线[19]。
b.样品的制备及测定
准确称取绝干螯合锌0.1 g(精确到0.0001 g),置于干燥洁净的硬质消化管中,向其中准确加入5mL浓硫酸,轻轻摇匀,管口放置弯颈小漏斗。将硬质消化管放入石墨消解炉中,保持消解炉温度为250℃,加热10min后取下,冷却片刻后向其中逐滴加入2mL H2O2,将其摇匀后放回消解炉中继续保持250℃加热10 min,取下消化管稍冷后再次滴加2 mL H2O2,重复此操作3~4次,待消化管中样品颜色变清亮后,继续加热10 min,使管内过量的H2O2分解除去。取出消化管,待管内液体冷却后完全转移至100 mL容量瓶内,用超纯水定容,然后取1 mL溶液分两次稀释10000倍,配制成待测液。将待测液放入原子吸收分光光度计的样品管内,测定其吸光度,计算铬浓度[20,21]。
1.2.5 G P C法测定多肽水解液分子量
1.2.5.1 溶剂和样品准备
溶剂选择超纯水。溶剂处理:采用溶剂过滤系统(真空过滤)对色谱纯溶剂进行过滤和脱气处理;样品配制:取一定量样品,用超纯水溶解,搅拌过夜。样品过滤:样品溶解之后,采用一次微孔滤膜(孔径0.22μm)对样品溶液进行过滤,保存滤液待用。
综上所述,在对PHC患者进行AFP、CA125、TK1联合诊断后灵敏度与准确率明显高于单独诊断,三者能够起到互补作用,因此联合诊断具有较高的临床价值,有利于早期发现PHC,为临床治疗PHC奠定一定基础。
1.2.5.2 分子量测定
色谱条件:色谱柱AGuard+1 x A6000M;流动相0.1 mol/L NaNO3溶液,pH 6.0;流速 0.7 mL/min;柱温35℃;进样量100μL。将所述的多肽水解液用流动相配成质量浓度为1.0 mg/mL的标准样品液,进样量为100μL,测定其分子量。
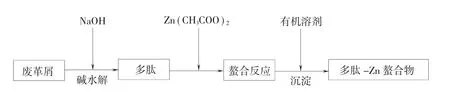
图1 多肽-Zn螯合工艺流程图Fig.1 Polypeptide-Zn chelation process flow chart
2 多肽-Z n螯合实验设计
2.1 pH值的影响
在上述所得三种不同分子量的浓缩液中加入Zn(CH3COO)2,反应温度为60℃,反应时间在60 min,多肽 -Zn质量比为 5∶1,pH 分别为 5.0、6.0、7.0、8.0、9.0、10.0,在此条件下进行多肽-Zn螯合反应。用无水乙醇对螯合液进行沉淀,并进行多次冲洗以除尽游离的锌离子。将所得沉淀进行烘干处理,并研磨成粉末。
2.2 多肽-Zn比的影响
根据以上实验确定最佳pH,在最佳pH条件下,在上述所得三种不同分子量浓缩液中加入Zn(CH3COO)2,反应温度为60℃,反应时间在60 mim,多肽 -Zn 比分别为 3∶1、4∶1、5∶1、6∶1、7∶1、8∶1,在此条件下进行多肽-Zn螯合反应。用无水乙醇对螯合液进行沉淀,并进行多次冲洗以除尽游离的锌离子。将所得沉淀进行烘干处理,并研磨成粉末。
2.3 反应温度的影响
根据以上实验确定最佳多肽-Zn比,在最佳pH与多肽-Zn比条件下,在上述所得三种不同分子量浓缩液中加入Zn(CH3COO)2,反应时间在60 mim,反应温度分别为 30℃、40℃、50℃、60℃、70℃、80℃,在此条件下进行肽Zn螯合反应。用无水乙醇对螯合液进行沉淀,并进行多次冲洗以除尽游离的锌离子。将所得沉淀进行烘干处理,并研磨成粉末。
2.4 反应时间的影响
根据以上实验确定最佳反应温度,在最佳pH、多肽-Zn比与反应温度条件下,在上述所得三种不同分子量浓缩液中加入Zn(CH3COO)2,反应时间分别在 30 min、60 min、90 min、120 min、150 min,在此条件下进行多肽-Zn螯合反应。用无水乙醇对螯合液进行沉淀,并进行多次冲洗以除尽游离的锌离子。将所得沉淀进行烘干处理,并研磨成粉末。
2.5 无水乙醇用量实验设计
因为多肽-Zn-螯合物是一种水溶性的螯合物,我们选择用无水乙醇对其进行沉淀。其中无水乙醇的用量会影响螯合物的得率。无水乙醇的量过少的话,水就会稀释无水乙醇,会有一部分多肽-Zn被水和无水乙醇的混合相溶解,这样就会使多肽-Zn螯合物的得率降低。若无水乙醇过量的话,就会造成无水乙醇的浪费,故要找到合适无水乙醇用量。将上述任一条件下的多肽-Zn螯合液分成10组,每组20 mL,无水乙醇与螯合物的比例分别为2∶1、3∶1、4∶1、5∶1、6∶1、7∶1、8∶1、9∶1、10∶1、11∶1,无水乙醇的用量分别对应为 40、60、80、100、120、140、160、180、200、220 mL。计算每组下的多肽-Zn螯合物的得率。
2.6 多肽-Zn红外光谱表征
将复合多肽水解液烘干、研磨成粉末,与溴化钾混合压片进行傅里叶红外光谱(FTIR)测试,利用PerkinElmer傅里叶红外光谱仪进行测试,扫描范围是 500 cm-1~ 4000 cm-1,分辨率为 0.5 cm-1,扫描次数为32次。
3 实验结果及讨论
3.1 铬含量标准曲线
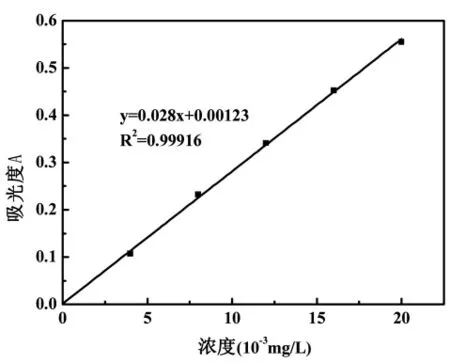
图2 铬含量与吸光度关系曲线Fig.2 Chromium content and absorbance curve
由图2可以看出,铬含量与吸光度呈较好的线性关系,铬含量标准曲线的线性回归方程为y=0.028x+0.00123,相关系数 R2=0.99916。
结果显示螯合锌中的铬含量为
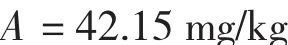
3.2 水解液分子量测定结果
根据水解度的实验结果,本实验采用三种不同NaOH用量,即8%、15%、20%条件进行革屑水解实验,为下一步螯合实验积累原料。本实验采用GPC准确测定三种不同条件下NaOH水解革屑得到的多肽分子量,结果如表1所示。
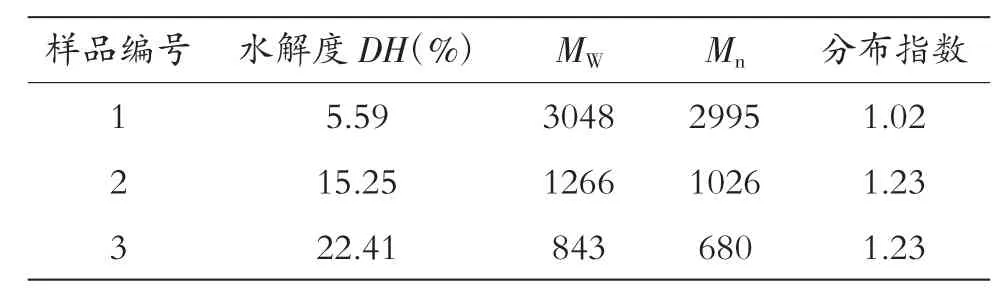
表1 革屑水解液分子量分析Tab.1 The analysis of the molecular weight of leather hydrolyzed crumbs
从表1中可以看出,随着NaOH用量的不断增加,分子量呈减小趋势。分子量分布较小,说明每种条件下所获得的多肽分子量相差较小。三种水解条件下分子量相差较大,有利于螯合实验的探究。
3.3 螯合物的评价结果
3.3.1 无水乙醇用量对螯合物得率的影响
由图3可以看出,无水乙醇的用量较少时多肽-Zn螯合物的得率比较低,随着无水乙醇用量的增多,乙醇沉淀螯合物的得率也在上升。当无水乙醇的用量达到一定,即无水乙醇和螯合液的体积比为8∶1时,再增加无水乙醇的用量螯合物的得率不会再上升。此时既能使螯合物的产率达到最大,也不会造成资源的浪费。
3.3.2 p H对螯合反应的影响
反应条件为:反应温度60℃,反应时间60 min,多肽-Zn比5∶1。pH对螯合反应的影响如图4所示。
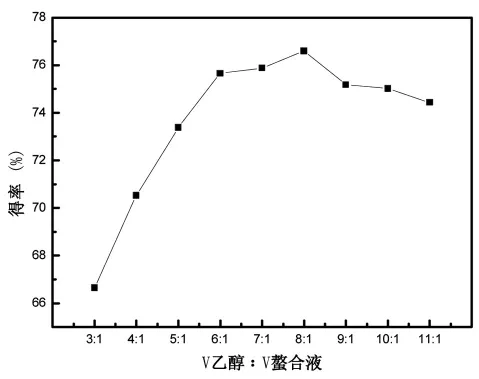
图3 无水乙醇的用量对得率的影响Fig.3 Effect of the amount of anhydrous ethanol on the yield
由图4可以看出,反应体系pH对螯合反应的影响较大。在本反应体系中,当pH值为从5到8时,螯合反应的螯合率随着pH值的增加而增加;多肽1与多肽2在pH值为8时,多肽3在pH值为7时螯合率达到最大值;当pH值大于8之后,螯合反应的螯合率随着pH值的增加反而迅速减小,并且多肽的分子量越小,螯合率就越大,这是由于小分子量的多肽能在溶液中暴露出更多的—NH2与—COOH,增加了与Zn2+接触的机会,从而使螯合率增加。
在本反应体系中,反应体系碱性太弱,反应体系中H+浓度增加,游离氨基会呈现质子化状态,阻碍与Zn2+结合,不利于螯合反应的顺利进行;若反应碱性太强,体系中的Zn2+容易与OH-反应生成Zn(OH)2沉淀,消耗掉体系中的Zn2+,使Zn2+与—NH2与—COOH结合机会降低,从而使反应的螯合率降低的同时也会使产品纯度降低。因此应利用盐酸对螯合体系进行中和,以保证反应体系pH值始终维持在适宜的中等碱性范围内,不同分子量多肽与锌进行反应时,反应的螯合率在pH为7或8时达到最佳值,分子量从大到小螯合率依次为65.04%、67.36%、72.49%,根据反应的多肽分子量的不同,反应pH应选择7或8。
3.3.3 肽-Z n比对螯合反应的影响
反应条件为:pH为7或者8,反应温度60℃,反应时间60 min。肽-Zn比对螯合反应的影响如图5所示。
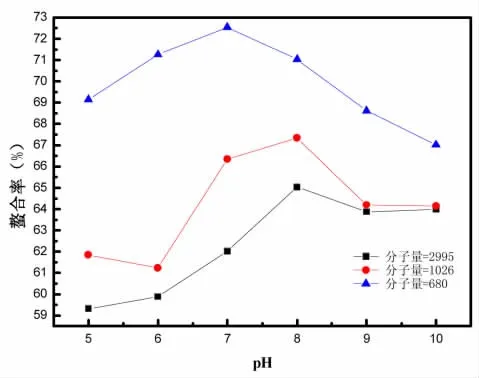
图4 pH对螯合反应的影响Fig.4 Effect of pH on the chelation reaction
由图5可以分析出,反应的螯合率随着乙酸锌用量的减少而增加,当减少到一定的量时,有减小的趋势。当多肽与Zn(CH3COO)2的质量比值为3∶1时,不同分子量的多肽表现出反应的螯合率较低,说明此时的Zn离子过量,大量的Zn离子未参与螯合;当提高二者比值,Zn的螯合率快速上升,多肽1与多肽2的多肽在肽锌比达到7∶1时,多肽3的多肽在肽锌比达到6∶1时,螯合率达到最大值,反应的螯合率达到最大值,此时再增大肽锌比,螯合率不再上升,说明此时多肽的添加量已经饱和,继续添加对螯合率影响不大,而且可以明显地看到,多肽的分子量越小,螯合率就越高,这是由于小分子量的多肽能在溶液中暴露出更多的—NH2与—COOH,增加了与Zn2+接触的机会,从而使螯合率增加,分子量从大到小螯合率依次为66.83%、75.33%、82.56%,根据反应的多肽分子量的不同,反应肽锌比应选择6∶1或者7∶1。
3.3.4 温度对螯合反应的影响
反应条件为:pH为7或者8,多肽-Zn的质量比为6∶1或者7∶1,反应时间60 min。温度对螯合反应的影响如图6所示。
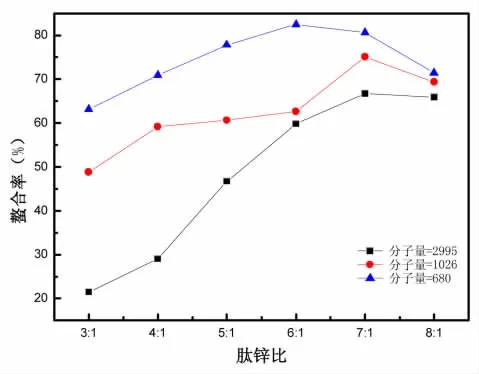
图5 多肽-Zn比对螯合反应的影响Fig.5 Effect of polypeptide Zn ratio on chelation
由图6可以看出,在30~60℃螯合反应的螯合率随温度的增加而增加,当温度达到60℃时多肽1螯合率达到最大值,50℃时多肽2与多肽3螯合率均达到最大值。温度可以影响螯合反应的反应速率与平衡常数,螯合反应在低温时,反应速度较慢,螯合率较低,当温度升高时,加快螯合反应的速度,螯合率提高。这是因为适当的提高反应温度有利于增加多肽与Zn离子碰撞的次数,使螯合反应顺利进行。然而,温度过高时,多肽易发生羰氨反应[22],减少了Zn离子的螯合位点,而且氨基酸或小肽与金属离子的螯合为放热反应[23],过高的温度反而不利于螯合。适宜的温度范围是50~70℃。从化学反应平衡常数来考虑,温度过高,逆反应速率大于正反应速率,化学平衡向逆方向移动,因此得率与螯合率会下降。同时温度升高会加快Zn离子的副反应,导致产率降低,因此螯合温度不宜过高或过低,而且可以明显地看到,多肽的分子量越小,螯合率就越高,这是由于小分子量的多肽能在溶液中暴露出更多的—NH2与—COOH,增加了与Zn2+接触的机会,从而使螯合率增加,分子量从大到小螯合率依次为57.93%、74.35%、76.23%,根据反应的多肽分子量的不同,反应温度应选择50℃或者60℃。
3.3.5 反应时间对螯合反应的影响
反应条件为:pH为7或者8,多肽-Zn的质量比为6∶1或者7∶1,反应温度50℃或者60℃。反应时间对螯合反应的影响如图7所示。
由图7可得,反应时间对螯合反应的螯合率影响较大,在一定范围内反应的螯合率随反应时间的增加而增加,当螯合率达到最大值时,再增加反应的时间,反应螯合率趋于平衡。反应时间在60 min的时候,螯合率达到最大值。而且可以明显地看到,多肽的分子量越小,螯合率就越高,这是由于小分子量的多肽能在溶液中暴露出更多的—NH2与—COOH,增加了与Zn2+接触的机会,从而使螯合率增加,分子量从大到小螯合率依次为60.02%、69.23%、72.21%,反应时间应选择60 min。
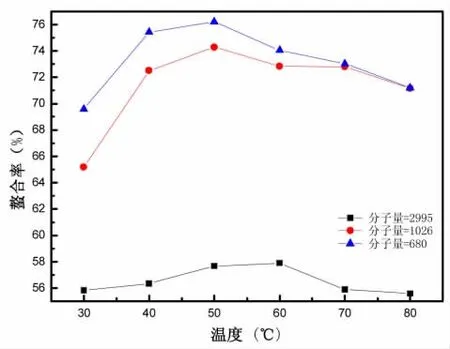
图6 温度对螯合反应的影响Fig.6 Effect of temperature on the chelation reaction
3.4 多肽和多肽-Z n螯合物红外光谱表征分析
采用傅里叶红外光谱仪对不同NaOH用量水解废革屑多肽及多肽-Zn螯合物进行表征分析,分析结果如图8、图9、图10所示。
当金属离子与包括O、N和S在内的配体原子结合时,由于配位键的振动,红外光谱中的吸收峰典型地改变。因此,可以表明Zn与肽的有机基团的相互作用。三种分子量多肽和多肽-Zn螯合物的FTIR光谱显示在图8、图9与图10中。图8中,在3428.20 cm-1处的高频吸收指的是多肽中N—H的伸缩振动,并且螯合反应导致更低的波数3403.51 cm-1,图9中,在3342.64 cm-1处的高频吸收指的是多肽中N—H的伸缩振动,并且螯合反应导致更低的波数3335.90 cm-1,图10中,在3342.19 cm-1处的高频吸收指的是多肽中N—H的伸缩振动,并且螯合反应导致更低的波数3301.68 cm-1,这表明多肽中的N—H的电子云密度由于诱导效应或偶极场效应而变得更强[24,25]。氨基显示增加的N—H拉伸频率,这意味着N—H参与螯合物形成。酰胺I带的红外吸收主要表示由羧酸离子的伸缩振动[26]引起的C=O吸收,图8从1649.06 cm-1移到较高的波数螯合反应后为1651.83 cm-1。在1547.85 cm-1处的带对应于COO—转移到1550.77 cm-1,图9从1657.08 cm-1移到较低的波数螯合反应后为1654.88 cm-1。在1543.04 cm-1处的带对应于COO—转移到1550.94 cm-1,图10从1658.88 cm-1移到较低的波数螯合反应后为1654.93 cm-1。在1543.01 cm-1处的带对应于COO—转移到1544.96 cm-1,这表明—COOH可能结合Zn并转化为—COO—Zn。这种类型的螯合是固有的,因为羰基氧具有非键合的自由电子对来螯合Zn离子[27]。由于N—H键的弯曲振动和C—N键的拉伸,图8在1400.22 cm-1处的弱吸收带(代表酰胺II带)在加入锌之后转移到更深的谷峰(1405.47 cm-1)。图9在1403.92 cm-1处的弱吸收带(代表酰胺II带)在加入锌之后转移到更深的谷峰(1402.28 cm-1)。图10在1404.17 cm-1处的弱吸收带(代表酰胺II带)在加入锌之后峰强度增加(1402.27 cm-1)。指纹区域的1240.28 cm-1的峰在1139.93 cm-1处转移至较低频率以形成C—O—Zn,同时峰强度增强。
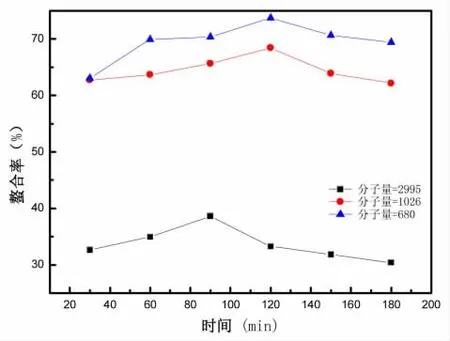
图7 反应时间对螯合反应的影响Fig.7 Effect of reaction time on the chelation reaction
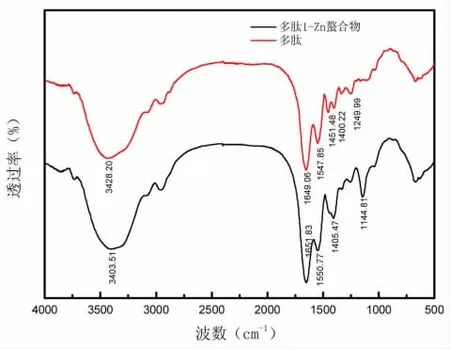
图8 多肽1与多肽1-Zn红外光谱图Fig.8 polypeptide 1 and polypeptide 1-Zn FTIR spectrum
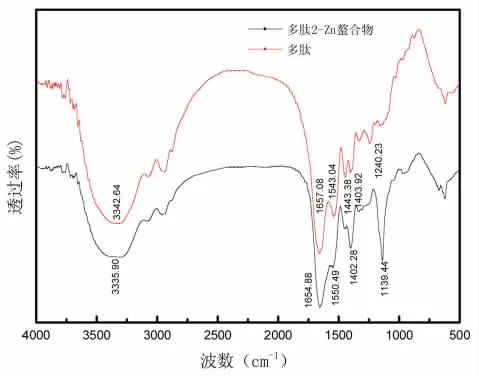
图9 多肽2及多肽2-Zn红外光谱图Fig.9 polypeptide 2 and polypeptide 2-Zn FTIR spectrum
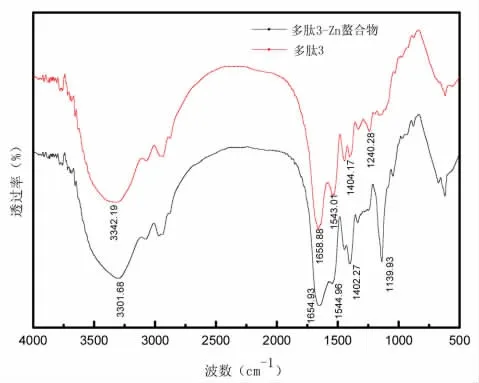
图10 多肽3及多肽3-Zn红外光谱图Fig.10 polypeptide 3 and polypeptide 3-Zn FTIR spectrum
总体而言,峰强度和波数不同的光谱证实了多肽-锌螯合物是一种新型化合物,与自由多肽不同。Zn主要通过羧基氧和氨基氮原子与肽结合。
4 结论
本论文使用NaOH对铬革屑进行碱水解,然后将水解液进行浓缩处理,对浓缩液和Zn(CH3COO)2在不同条件下进行螯合。根据条件的不同,设计单因素实验,得到如下结论。
无水乙醇和螯合液的体积比为8∶1时,再增加无水乙醇的用量螯合物的得率不会再有所上升。此时既能使螯合物的产率达到最大,也不会造成无水乙醇的浪费。对于三种不同分子量水解多肽最佳的螯合反应条件有所差异,多肽1分子量为2995,反应pH为8,多肽与Zn(CH3COO)2质量比为7∶1,反应温度60℃,反应时间60 min,螯合率最高为66.83%。多肽2分子量为1026,反应pH为8,多肽与Zn(CH3COO)2质量比为7∶1,反应温度60℃,反应时间60 min,螯合率最高为75.33%。多肽3分子量为680,反应pH为7,多肽与Zn(CH3COO)2质量比为6∶1,反应温度60℃,反应时间60 min,螯合率最高为82.56%。利用红外对肽锌螯合物进行表征,结果可以证明多肽与锌进行了螯合反应,形成比较稳定的肽锌螯合物。
对于多肽与Zn的螯合,不仅可以促进生物体对Zn的生物利用度,作为农业有机肥料成本较低,而且更好地使得皮革固体废弃物回收利用,减少皮革废弃物对环境的污染,促进制革行业的发展。实验条件及其结果对于其他微量元素与多肽的螯合物制备具有一定参考价值。

