伪士的宁对人结肠癌HT-29细胞凋亡的影响及其机制研究
冯振宇 孟霜 常剑敏 周晓荣 史敏 赵建平


中图分类号R285.5
文献标志码A
文章编号1001-0408(2020)02-0179-05
DOI 10.6039/j.issn.1001-0408.2020.02.10
摘要 目的:探讨伪士的宁对人结肠癌HT-29细胞凋亡的影响及其机制。方法:取人结肠癌HT-29细胞,随机分为空白组和低、中、高剂量伪士的宁组(125、250、500 μmol/L),加入不合药培养基或含相应浓度伪士的宁的培养基培养48h。采用流式细胞仪检测细胞凋亡情况和线粒体跨膜电位;采用Western blotting法检测细胞中P53、Caspase-3、Caspase-9、兔源DNA修复酶(c-PARP)、Bcl-2的蛋白表达水平。结果:与空白组比较,低、中、高剂量伪士的宁组细胞凋亡率显著升高,线粒体跨膜电位均显著降低(P<0.01),且均呈现浓度依赖趋势。中、高剂量伪士的宁组细胞中P53、Caspase-3、Caspase-9、c-PARP蛋白表达水平较空白组均显著升高,低、中、高剂量伪士的宁组细胞中Bcl-2蛋白表达水平则显著降低(P<0.05或P
关键词 伪士的宁;结肠癌;HT-29细胞;凋亡;线粒体跨膜电位;机制;P53;Caspase-3;Caspase-9;兔源DNA修复酶;Bcl-2
结肠癌是一种常见的临床恶性肿瘤,目前我国结肠癌发病率和病死率越来越高,在全部恶性肿瘤中位居第5位,且确诊时大多数已发展至中晚期,严重威胁患者的身体健康和正常生活[1]。中医药辅助治疗结肠癌有助于提高患者在治療过程中的免疫力,减少放化疗带来的不良反应,降低复发率,改善预后[2]。马钱子具有抑菌、镇痛、抗肿瘤和抗炎的功效[3]。近年来,马钱子活性成分的抗肿瘤作用已成为研究的热点,相关研究表明,马钱子碱在肝癌、乳腺癌、血液系统肿瘤、基底样鳞状细胞癌、S180肉瘤等方面均表现出一定的抑制作用[4]。本课题组前期对马钱子进行了系统的提取、分离、纯化研究,获得马钱子碱、士的宁、伪士的宁等单体生物碱成分;进一步就上述单体生物碱类成分对结肠癌细胞的抑制作用进行了研究,结果发现伪士的宁对HT-29细胞的抑制作用较强(拟另文发表)。伪士的宁分子式为C21H22N203,分子量为350(结构式见图1),其在人类结肠癌治疗中的应用尚未见报道。因此,本研究考察了伪士的宁对HT-29细胞的线粒体跨膜电位、细胞凋亡、相关凋亡蛋白等的影响,并初步探讨其抗结肠癌的可能作用机制,旨在为该单体化合物临床用于结肠癌的治疗提供实验基础。
l 材料
1.1 仪器
Cyto FLEX型流式细胞仪(美国Beckman公司);MC0-15AC型CO2恒温培养箱(台湾Sanyo公司);IX51型倒置显微镜(日本Olympus公司);DYC2-24DN型垂直电泳仪、DYC2-40型电转仪(北京六一仪器厂);5702R型低速离心机(德国Eppendorf公司);微量移液器(美国Thermo Fisher公司)。
1.2 药品与试剂
伪士的宁对照品(本课题组自制:参照前期研究工艺,取马钱子药材,经加热回流提取,硅胶柱色谱、薄层色谱、半制备高效液相色谱等分离纯化,即得;纯度:95.0%);0.25%胰蛋白酶(批号:15050065)、胎牛血清(FBS,批号:10099-141)、Mc Coys 5A培养基(简称“5A培养基”,批号:16600-082)均购自美国Gibco公司;青霉素一链霉素双抗(批号:PB180120)、pH 7.4磷酸盐缓冲液(PBS,批号:PB180327)均购自武汉普诺赛生命科技有限公司;细胞凋亡检测试剂盒(批号:KGA108)、线粒体膜电位检测试剂盒(批号:KGA602)均购自南京凯基生物科技发展有限公司;蛋白Marker(加拿大Fermentas公司,批号:26619-1);兔源DNA修复酶(PARP)多克隆抗体(美国Affinity公司,批号:AF7023);兔源P53多克隆抗体(批号:10442-1-AP)、鼠抗人β-actin单克隆抗体(批号:BM0627)、辣根过氧化物酶(HRP)标记羊抗小鼠二抗(批号:BA1051)、HRP标记羊抗兔二抗(批号:BA1054)均购自武汉博士德生物工程有限公司;兔抗人Caspase-3单克隆抗体(批号:ab184787)、兔抗人Cas-pase-9单克隆抗体(批号:ab202068)、兔源Bcl-2多克隆抗体(批号:ab59348)均购自英国Abcam公司;ECL化学发光底物试液(美国Thermo Scientific Pierce公司,批号:NCI5079);X光胶片(日本柯达公司,批号:XBT-1);显影定影试剂盒(天津市汉中摄影材料厂);其余试剂均为分析纯或实验室常用规格,水为去离子水。
1.3 细胞
人结肠癌HT-29细胞(批号:CL-0118)购自武汉普诺赛生命科技有限公司。
2 方法
2.1 细胞培养
将HT-29细胞置于含10% FBS+I%青霉素一链霉素双抗混合溶液[4-5]的5A培养基(即完全培养基)中,在37℃、5% C02、饱和湿度的培养箱中培养,待细胞处于对数生长期时用于后续试验。
2.2 伪士的宁对HT-29细胞凋亡的影响考察
取处于对数生长期、生长状态良好的HT-29细胞,以2.5x105个/孔接种于6孔板中,在37℃、5% C02培养箱中培养过夜。将细胞分为空白组和伪士的宁低、中、高剂量组(125、250、500 μmol/L;剂量根据本课题组前期研究结果制定),分别加入不含药的5A培养基或含有相应浓度药物的5A培养基后,在37℃、5%C02、饱和湿度条件下培养48 h。取出细胞,用0.25%胰蛋白酶消化细胞并收集细胞,以1 000 r/min离心5min;除去上清液,加入适量PBS重悬、润洗2次后,以1 000 r/min离心5min;除去上清液,将细胞重悬于PBS 100 μL中,缓慢加入预冷的80%乙醇700 μL,再加入Binding Buffer 500 μL重悬细胞;加入AnnexinV-FITC试剂5μL混匀后再加入PI试剂5μL,轻轻振摇混匀,室温避光反应15 min使染色;采用流式细胞仪检测分析细胞凋亡情况。
2.3 伪士的宁对HT-29细胞线粒体跨膜电位的影响考察
按“2.2”项下方法取HT-29细胞接种、培养、分组、加入相应药物并培养48 h后,收集细胞,以1 000 r/min离心5 min,除去上清液,用PBS洗涤细胞3次;以0.25%胰蛋白酶消化并收集细胞,以1 000 r/min离心5 min;弃去上清液,加入适量PBS重悬、润洗3次,收集不多于1X106个/mL的细胞,以JC-1工作液(取10 xlncubation Buffer,以灭菌水稀释成1xlncubation Buffer,预热至37℃;吸取线粒体膜电位检测试剂盒中的JC-1试剂1μL,加入1×Incubation Buffer 1 000 μL稀释,即得)1 000 μL混悬,在37℃、5%C02的培养箱中培养20 min;室温下以1 200r/min离心5 min,收集细胞,用1xlncubation Buffer润洗2次,再以lOxlncubation Buffer 200 μL重悬细胞后,用流式细胞仪检测分析其跨膜电位变化。
2.4 伪士的宁对细胞中Caspase-3、P53、Caspase-9、c-PARP、Bc1-2蛋白表达的影响考察
采用Westem blotting法测定细胞中各目标蛋白的表达水平。取“2.2”项下HT-29细胞接种、培养、分组、加入相应药物并培养48 h后,弃去培养液,以PBS洗涤3次;弃去PBS液,培养皿冰浴,每皿细胞加入含PMSF的裂解液进行裂解后,提取蛋白。取蛋白40 μg,在60V电压下电泳,待Marker出现红色条带时,将电压升至120V继续电泳;然后电转移至PVDF膜上,用含5%脱脂奶粉的TBST缓冲液在室温条件下摇床封闭2h,加入β-actin(1:1 000)、P53(1:2 000)、Caspase-3(1:2 000)、PARP(1:1 000)、Caspase-9(1:2 000)、Bcl-2(1:800)等相应一抗,于4℃下孵育过夜;以TBST缓冲液洗涤6次,加入HPR标记二抗(1:50 000),于37℃下摇床孵育2h:以TBST缓冲液洗涤6次,ECL显色曝光,晾干胶片,扫描。以β-actin为参比,采用BandScan 5.O软件分析目标蛋白条带的相对灰度值,用以表示蛋白表达水平。
2.5 统计学方法
采用SPSS 19.O统计软件分析处理试验数據。计量资料以x±s表示,组间比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
3 结果
3.1 伪士的宁对HT-29细胞凋亡的影响
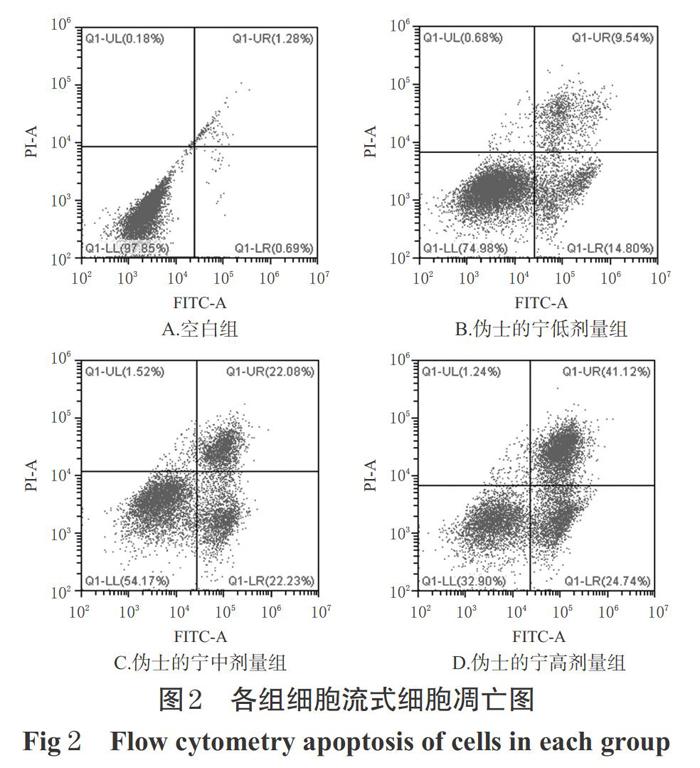
流式细胞凋亡检测结果显示,与空白组比较,伪士的宁低、中、高剂量组细胞的早期凋亡率、晚期凋亡率和总凋亡率均显著升高(P<0.01),且随着伪士的宁浓度的升高,细胞总凋亡率也随之升高,表明伪士的宁对HT-29细胞的促凋亡作用呈浓度依赖趋势。各组细胞流式细胞凋亡图见图1(图中,右下象限为早期凋亡细胞群,右上象限为晚期凋亡细胞群);凋亡率测定结果见表1。
3.2 伪士的宁对HT-29细胞线粒体跨膜电位的影响
线粒体跨膜电位检测结果显示,与空白组比较,伪士的宁低、中、高剂量组细胞的线粒体跨膜电位显著降低(P<0.01),且随着伪士的宁浓度的升高,细胞线粒体跨膜电位随之降低,表明伪士的宁对HT-29细胞跨膜电位的降低作用呈浓度依赖趋势。各组细胞流式细胞跨膜电位图见图3(图中,红色荧光表示线粒体跨膜电位较高,呈聚集状态;绿色荧光代表线粒体跨膜电位较低,呈离散状态);线粒体跨膜电位检测结果见表2。
3.3 伪士的宁对HT-29细胞相关蛋白表达的影响
Western blotting法检测结果显示,与空白组比较,伪士的宁中、高剂量组细胞中P53、Caspase-3、Caspase-9、c-PARP的蛋白表达水平均显著升高(P<0.05或P<0.01);伪士的宁低、中、高剂量组细胞中Bcl-2蛋白表达水平均显著降低(P<0.05或P<0.01),结果见图4、表3。
4 讨论
马钱子为马钱科植物马钱的干燥成熟种子,具有通络止痛、散结消肿的功效,常用于治疗跌打损伤、骨折肿痛、风湿顽痹、麻木瘫痪、痈疽疮毒、咽喉肿痛等嘲。近年来,关于马钱子活性成分抗肿瘤作用的研究取得了一定成果[7]。前期研究证实,伪士的宁作为马钱子中提取获得的生物碱单体化合物,对结肠癌具有一定的抑制作用,且毒副作用较小。因此,本研究通过考察伪士的宁作用于HT-29细胞后对其凋亡、线粒体跨膜电位及相关凋亡蛋白表达水平等的影响,对该化合物抗结肠癌的可能作用机制进行了初步的探讨。
正常情况下,细胞线粒体外膜为高通透性,而内膜通透性相对较低,线粒体内膜上存在的质子泵可将基质中的质子泵入膜外,从而使得线粒体膜内外形成跨膜电位[8]。线粒体跨膜电位的降低是细胞凋亡早期的不可逆事件[7]。当线粒体膜内外的电势差减少时,线粒体膜电位降低,可引起线粒体膜内外发生一系列生化改变。在各种促细胞凋亡信号作用下,线粒体通透性转变孔不可逆地过度开放,导致线粒体跨膜电位崩解、呼吸链解耦联、线粒体基质渗透压升高、内膜肿胀,并释放出膜间促凋亡蛋白,最终导致细胞凋亡[9]。因此,线粒体跨膜电位的改变预示细胞可能出现凋亡,可为细胞凋亡的机制研究提供一定的理论基础。
本研究结果显示,与正常对照组比较,不同剂量伪士的宁作用于HT-29细胞48h后,能显著升高细胞凋亡率(P<0.01),表明伪士的宁具有明显的促HT-29细胞凋亡的作用,且这一作用呈浓度依赖趋势;同时,不同剂量的伪士的宁均能显著降低HT-29细胞的线粒体跨膜电位(P<0.01),并使电位由聚集态向离散态变化的趋势增大,且这一作用呈浓度依赖趋势。
Bcl-2家族由抗凋亡蛋白(Bcl-2、Bcl-xL等)和促凋亡蛋白(Bax、Bak等)组成,共同构成一个相互作用的控制细胞凋亡的网络,是细胞凋亡内源性线粒体途径的重要调节因子[10]。Bcl-2是细胞凋亡的负调节因子。Cas-pase家族蛋白分为启动子(包括Caspase-2、Caspase-8、Caspase-9)和效应器(包括Caspase-3、Caspase-6、Cas-pase-7),启动子的作用是在各种刺激下(如药物、生长因子等)发生自我激活并识别和活化下游的Caspase蛋白,实施蛋白通过作用于特异性底物使细胞发生凋亡,Cas-pase活化可导致细胞凋亡进入不可逆阶段[11]。Cas-pase-3是Bcl-2的下游调控蛋白;PARP是Caspase-3的切割底物,也是Caspase-3激活的标志。Caspase-3被激活后构象发生改变形成剪切体cleaved-Caspase-3,cleaved-Caspase-3进一步剪切PARP,使总PARP减少、cleaved-PARP增加,导致PARP失去正常功能,最终使得核小体间DNA降解、细胞发生凋亡[10]。P53是Bcl-2的上游调控基因,P53通过调节Caspase-3蛋白酶上调Bcl-2的基因表达,从而影响相关凋亡功能[12]。本研究结果显示,中、高剂量伪士的宁作用于HT-29细胞后,Cas-pase-3、Caspase-9、P53、c-PARP(PARP的活化形式)的蛋白表达水平均显著升高,低、中、高剂量伪士的宁作用后使细胞中Bcl-2蛋白表达均显著下调,表明其能够通过调控P53、Caspase-3、PARP、Caspase-9、Bcl-2蛋白的表达诱导HT-29细胞发生凋亡。
综上所述,伪士的宁可能通过上调P53蛋白、下调Bcl-2蛋白的表达,改变线粒体膜电位,然后激活Cas-pase-3、c-PARP、Caspase-9的表达,进而激活内源性线粒体通路,发挥促进结肠癌HT-29细胞凋亡的作用。但该化合物对结肠癌细胞的具体促凋亡途径还有待于进一
参考文献
[1]卢天宇,大肠癌最新研究进展及中医治疗演变[D].北京:北京中医药大学,2008.
[2]林燕,马蕾,布力布·吉力斯汉,等,中医药辅助治疗结肠癌的应用研究进展[J].中国药师,2018, 21(9):1637- 1640.
[3] 王晓崴,龚千锋,马钱子的炮制沿革、药理作用及安全性的研究进展[J].江西中医药,2013,44(3):70-72.
[4] LAI KC, HUANG AC, HSU SC, et al.Benzyl isothiocy-anate (BITC) inhibits migration and invasion of humancolon cancer HT29 cells by inhibiting matrix metallopro-teinase-2/-9 and urokinase plasminogen (uPA) throughPKC and MAPK signaling pathway[J].,Agric FoodChem,2010,58(5):2935-2942.
[5] CHOI PM, TCHOU-WONG KM, WEINSTEIN IB. Over-expression of protein kinase C in HT29 colon cancer cells
causes growth inhibition and tumor suppression[J].Mo/Cell Biol, 1990,10(9):4650-4657.
[6]國家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:50-51.
[7]赵立民,刘玉国,牛作兴,马钱子碱抗肿瘤作用的研究进展[J].中华肿瘤防治杂志,2013,20 (11):877-880.
[8]刘晓婷,王延让,张明,线粒体介导细胞凋亡的研究进展[J]环境与健康杂志,2013,30(2):182-183.
[9]陈慧莉,李建华,王树庆,线粒体跨膜电位和细胞凋亡相关性的研究[J].医学综述,2007,13(14):1041-1043.
[10]马陈皋,大黄素对人胃癌细胞株SGC-7901凋亡的影响与初步机制[J].世界华人消化杂志,2016, 24 (16):2463- 2469.
[11]
CHIPUK JE, BOUCHIER-HAYES L,GREEN DR. Mito-chondrial outer menbrane permeabilization during apopto-sis: the innocent bystander scenario[J]. Cell Death Differ,2006,13(8):1396-1402.
[12]
PRATHEESHKUMAR P,KUTTAN G.Oleanolie acid in-duces apoplosis by modulating P53, Bax, Bcl-2 and cas-pase-3 gene expression and regulates the activation oftranscription factors and cytokine profile in B16F[J].,En-viron Pathol Toxicol Oncol, 2011,30(1):21-31.
(收稿日期:2019-06-25修回日期:2019-12-03)
(编辑:段思怡)
△基金项目:国家国际科技合作专项项目(No.2014DFA33150)
*副主任医师,硕士生导师,硕士。研究方向:经方治疗疑难病。电话:0351-2150899.
E-mail: sxfzy@163.com
#通信作者:主任药师,博士生导师,硕士。研究方向:中药药理学。电话:0351-2150899.
E-mail: mengzhaoshuang@126.com

