纳米δ-FeOOH催化臭氧氧化降解水中萘普生
王耀葳,黄远星,杨 涯,梁曼丽,胡守训,杨俊豪
(上海理工大学环境与建筑学院,上海 200093)
药品和个人护理用品(pharmaceutical and personal care products,PPCPs)是继杀虫剂,内分泌干扰物之后发现在水体中普遍存在的痕量有机物,其对水环境影响已经引起了广泛的关注[1-2]。萘普生是一类非甾体类抗炎药物,常用作镇痛剂使用,属于典型的PPCPs[3]。研究表明,在地表水、土壤中甚至在生物样本中都检测出从ng/L到μg/L级别的萘普生[3]。尽管天然水中检测出的萘普生浓度较低,但持续摄入痕量的萘普生可能会增加心脏病发作或中风的风险[4]。因此,水体中不断积累的萘普生引起了研究人员的关注。目前,去除萘普生的方法主要有:活性污泥法[5]、Fenton法[6]、光催化法[7]、臭氧法[8]等。臭氧氧化具有氧化能力强、快速高效、无二次污染、有一定的杀菌消毒作用等特征被广泛应用于水处理领域。但是,臭氧也存在利用率低,在水中溶解度低等缺点。因此,研究催化臭氧,提高其对有机污染物的矿化能力一直是人们研究的热点。
本文采用双氧水快速氧化氢氧化亚铁的方法合成δ-FeOOH纳米催化剂,将其作为非均相催化臭氧法中的固体催化剂,利用XRD、TEM、BET对其进行表征。考察了催化剂投加量、臭氧浓度、污染物初始浓度对水中萘普生降解效果的影响,并研究了催化机理,为实际含萘普生废水的处理提供理论基础。
1 试验部分
1.1 材料、试剂和仪器
萘普生(NPX,>99.0%)购自阿拉丁生化科技股份有限公司。其他化学试剂均为分析纯,购自国药集团化学试剂有限公司。所用溶液均用去离子水制备。
准确称量0.200 g萘普生溶于0.4% NaOH中,加入去离子水定容至1 L作为萘普生储备液。使用时用稀H2SO4和NaOH调节溶液pH值。
KX-S10型臭氧发生器(上海康孝环保设备有限公司),Muliti N/C 3100型总有机碳/总氮(TOC/TN)测定仪(德国耶拿公司),UV2600型紫外分光光度计(日本岛津公司),D8 Advance 型X射线衍射仪(德国布鲁克公司),ASAP2460型全自动快速比表面积及介孔/微孔分析仪(美国麦克公司),Tecnai G2 F20 S-TWIN型透射电子显微镜(美国FEI公司)。
1.2 试验方法
1.2.1 催化剂的制备
根据报道的方法[9],准确称量5.964 g的FeCl2·4H2O配成300 mL,0.1 mol/L Fe2+溶液。将配好的溶液在磁力搅拌下用5 mol/L NaOH调节溶液的pH值,由最初的3.0调节至8.0,在此过程中逐渐形成氢氧化亚铁(绿色沉淀)。随后快速加入40 mL 30% H2O2,氢氧化亚铁迅速被氧化并且在几秒内呈红褐色沉淀。由于质子的释放,pH值降至2~2.5。为了改善絮凝效果,在搅拌作用下滴加5 mol/L NaOH调节溶液pH值为8.0。离心洗涤至中性后烘干制得δ-FeOOH催化剂。
1.2.2 催化臭氧试验
试验装置如图1所示。在室温下,向玻璃反应容器中投加500 mL萘普生溶液和1.0 g的催化剂,打开磁力搅拌器使溶液和催化剂混合均匀。随后打开臭氧发生器,产生的臭氧气体经反应容器底部的曝气盘石进入,气体流量保持在2 L/min,通过调节不同气体流量以达到所需的臭氧浓度。水中臭氧浓度用紫外分光光度计在258 nm波长下测定[10]。整个反应过程为15 min,按时间间隔从取样口取样,所取水样经0.45 μm聚四氟乙烯滤膜过滤,并向水样中通入氩气吹脱水中残余臭氧后测定水样的TOC。以TOC为指标来评价萘普生的降解效果。所有试验均进行3次平行试验,并给出平均值。
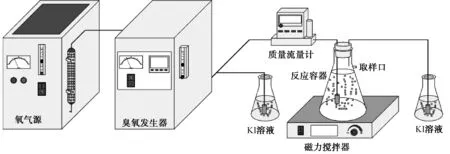
图1 试验反应装置简化图Fig.1 Simplified Pattern of Experimental Reaction Devices
1.3 分析方法
催化剂的晶体结构使用布鲁克D8 Advance X射线衍射仪分析,CuKα靶,波长λ=1.540 6 Å,扫描速度3°/min,扫描角度为5°~80°,操作电流为40 mV,操作电压为40 mV。合成催化剂是粉末样品,对干燥后的样品压片进行扫描测试。催化剂的形貌和尺寸通过透射电子显微镜表征,仪器为FEI Tecnai G2 F20 S-TWIN,工作电压为200 kV。催化剂的N2吸附脱附等温线通过麦克ASAP246全自动快速比表面积及介孔/微孔分析仪器测定。其比表面积由Barrett-Emmett-Teller (BET)理论计算得到,孔径分布基于Barret-Joyner-Halender (BJH)理论计算得到。
2 结果与讨论
2.1 催化剂的表征分析
XRD衍射图如图2所示,在35.2°、40.7°、53.9°、63.2°出现了特征峰,分别对应(100)、(002)、(102)、(110)晶面,与标准卡片相吻合,并且无其他杂峰,说明制备的催化剂纯度较高。
图3是催化剂的透射电子显微镜照片。图3(a)表明催化剂是六角片层结构,且片层厚度约为4 nm。在图3(b)中观察到约0.251 nm晶面间距的合成催化剂的N2吸附脱附等温线和孔径分布曲线如图4所示。图4(a)显示δ-FeOOH具有H3型滞后环的Ⅳ型等温线,这是典型的介孔材料特征。所得δ-FeOOH的BET比表面积和孔体积分别为191.73 m2/g和0.67 cm3/g。孔径分布曲线如图4(b)所示,平均孔径为13.07 nm。
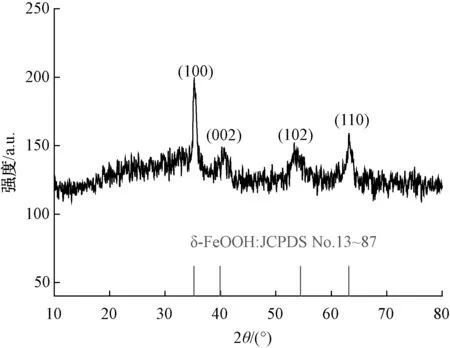
图2 δ-FeOOH的XRD衍射图Fig.2 XRD Pattern of δ-FeOOH
晶格条纹,对应δ-FeOOH(100)晶面。结合XRD图谱,这些结果可以证明所制备的催化剂为纳米δ-FeOOH。

图3 δ-FeOOH的透射电子显微镜照片Fig.3 TEM Images of δ-FeOOH

图4 δ-FeOOH的N2吸附脱附等温线(a)和孔径分布曲线(b)Fig.4 N2 Adsorption-Desorption Isotherms (a) and Pore Size Distribution Profiles of δ-FeOOH (b)
2.2 催化剂投加量对萘普生降解效果的影响
在室温、萘普生初始浓度为20 mg/L、臭氧投加量为7.4 mg/L、溶液初始pH值为7.0的条件下,通过改变催化剂投加量来评价δ-FeOOH催化臭氧降解萘普生的效果。
如图5(a)所示,在未投加催化剂的情况下,单独臭氧氧化萘普生15 min时TOC的去除率仅为26.1%。当投加了0.3 g/L的δ-FeOOH催化剂后,反应15 min时TOC的去除率达到了43.2%,比单独臭氧氧化萘普生时提高了17.1%。当催化剂的投加量为1.0 g/L和2.0 g/L时,反应时间为15 min时,TOC的去除率分别为58.9%和64.5%。此外,不同催化剂投加量的降解曲线可以通过一级动力学模型很好地拟合。如图5(b)所示,单独臭氧氧化萘普生的反应速率常数为0.027 3 min-1。当催化剂的投加量为0.3、1.0、2.0 g/L时,其反应速率常数分别为0.052 1、0.091 1、0.105 2 min-1,且大约分别是单独臭氧氧化时的1.9、3.3倍和3.9倍,表明反应速度增快。
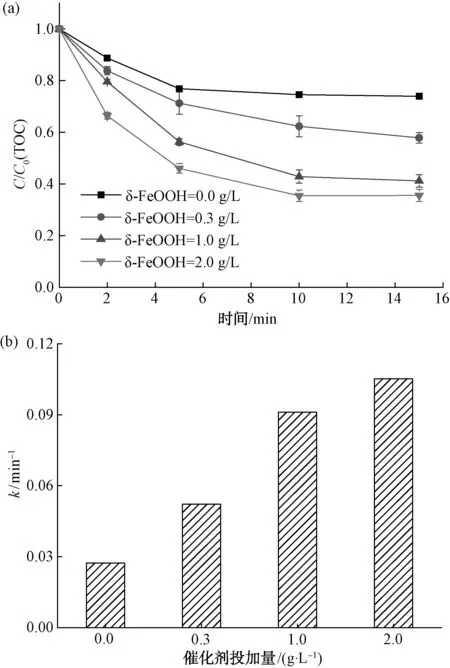
图5 催化剂投加量对萘普生降解效果的影响(a)及一级反应速率常数(b)Fig.5 Effects of Catalyst Dosage on NPX Removal (a) and First-Order Reaction Rate Constant(b)
结果表明,δ-FeOOH催化剂的使用明显提高了萘普生的去除率。在催化臭氧氧化过程中,臭氧在催化剂表面可以产生具有强氧化性的活性自由基,导致了萘普生更完全的降解。催化剂投加量的增多有效提高了萘普生的去除率,Zhang等[11]研究表明,FeOOH的表面羟基是促进臭氧分解产生·OH的重要活性位点。由于催化剂浓度的增加,能够向臭氧提供更多的接触活性位点,所产生的·OH浓度也随之增加,进一步提高了萘普生的去除率。然而当催化剂的浓度为2.0 g/L时,对萘普生的去除率增加趋势已经变缓。相比催化剂浓度为1.0 g/L时,TOC的去除率仅提高了5.6%。Huang等[12]研究表明,过量的催化剂抑制了·OH与有机化合物之间的碰撞,且过量的·OH还会与臭氧发生反应导致其减少。因此,在一定程度内增加催化剂投加量是显著提高萘普生去除率的有效方法。
2.3 臭氧投加量对萘普生降解效果的影响
在室温、萘普生初始浓度为20 mg/L、催化剂投加量为2.0 g/L、溶液初始pH值为7.0的条件下,水中不同臭氧浓度对萘普生的降解效果及一级动力学反应速率常数如图6所示。
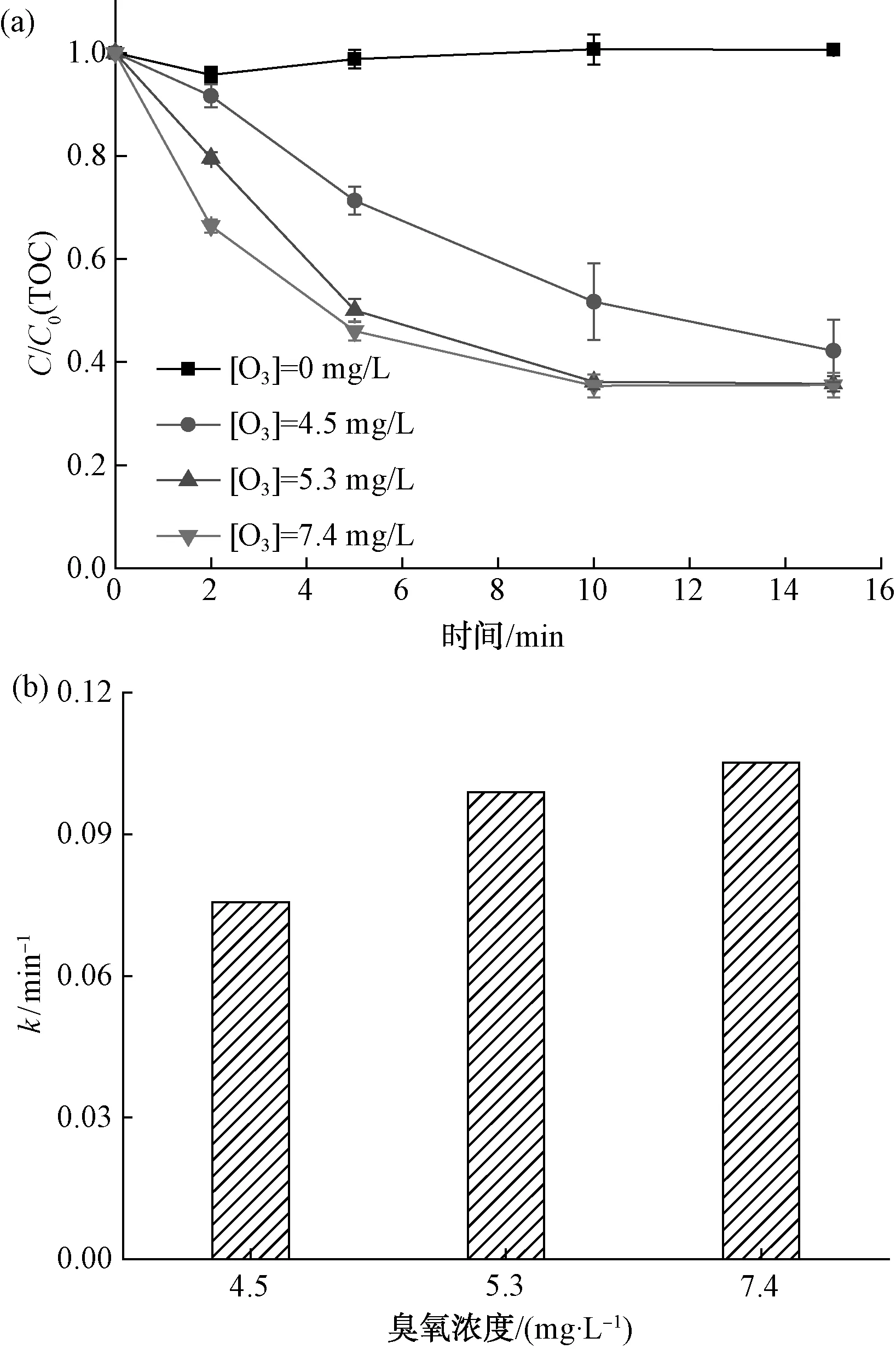
图6 臭氧浓度对萘普生降解效果的影响(a)及一级反应速率常数(b)Fig.6 Effect of Ozone Concentration on NPX Removal(a) and First-Order Reaction Rate Constant(b)
由图6(a)结果可知,在未投加臭氧的情况下,单独δ-FeOOH对萘普生几乎没有降解作用,这是δ-FeOOH催化剂对萘普生的吸附能力差导致。当臭氧浓度为4.5 mg/L时,TOC的去除率为57.8%;当臭氧浓度为5.3 mg/L时,TOC的去除率为64.5%,比臭氧浓度为4.5 mg/L时提高了6.7%;当臭氧浓度为7.4 mg/L时,TOC的去除率不再增加。由图6(b)中不同臭氧浓度降解曲线的一级反应速率常数可知,当臭氧浓度从4.5 mg/L增加到7.4 mg/L时,降解萘普生的反应速率常数从0.075 6 min-1增加到0.105 2 min-1,即反应速度加快。Sui等[13]研究表明,臭氧分子的特殊共振结构可作为反应的偶极点,经过一系列的反应,臭氧可以分解为·OH。在δ-FeOOH催化臭氧氧化体系中,随着水中臭氧浓度的增大,越来越多的臭氧分子在δ-FeOOH的催化作用下反应生成·OH,增大了萘普生分子和·OH的接触概率,加强了表面反应活性,从而促进了萘普生的降解。但是,催化剂表面的催化活性位点是一定的,过高的臭氧浓度并不会提高催化活性位点的利用率,且过量臭氧分子还会与体系中存在的·OH相互反应湮灭[14]。这就导致了继续增大臭氧浓度,TOC去除率增加量减少。
2.4 萘普生初始浓度对萘普生降解效果的影响
在室温、催化剂投加量为2.0 g/L、臭氧投加量为7.4 mg/L、溶液初始pH值为7.0的条件下,不同萘普生初始浓度对萘普生的降解效果及一级动力学反应速率常数如图7所示。
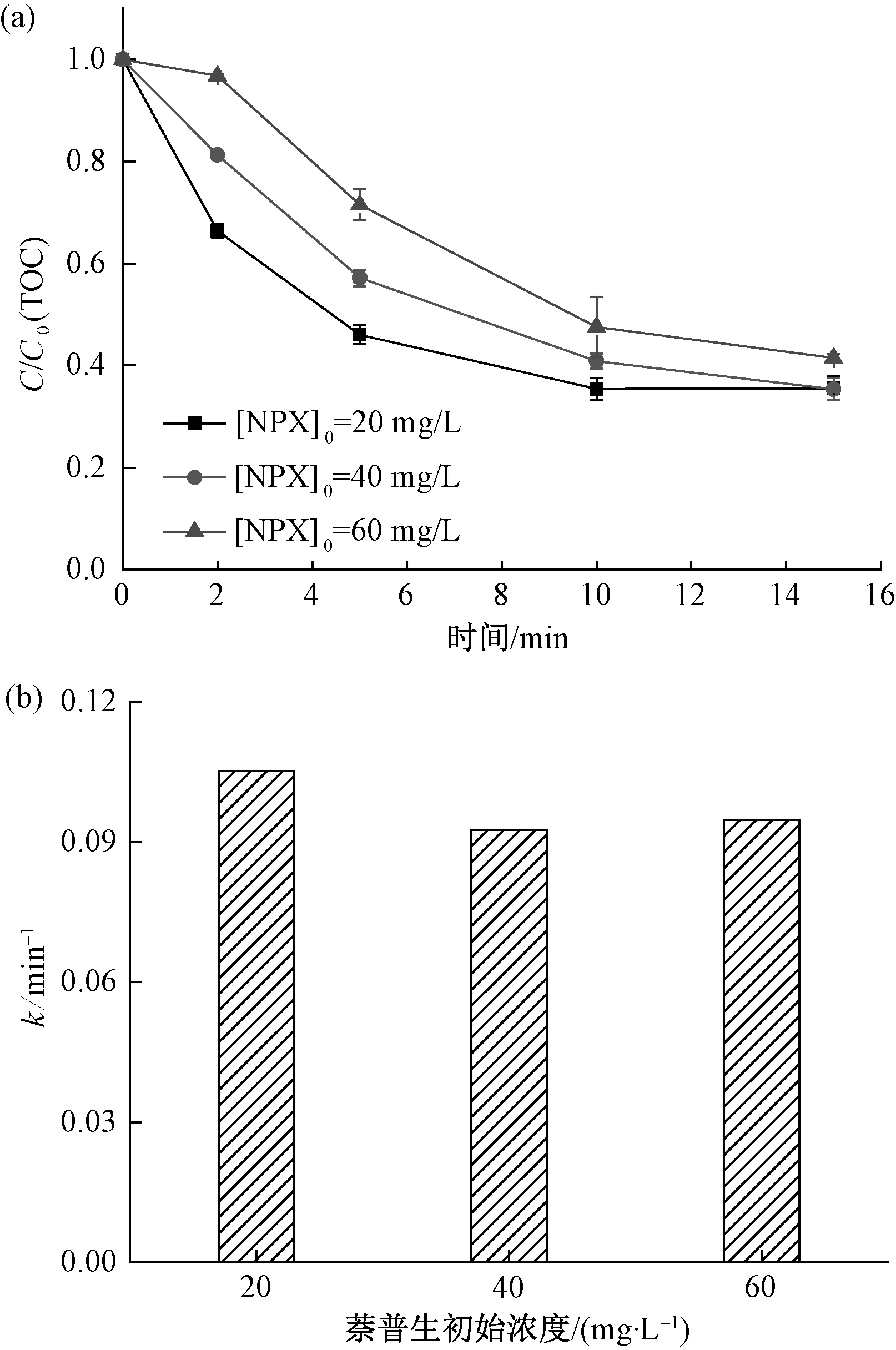
图7 萘普生初始浓度对其降解效果的影响(a)及一级反应速率常数(b)Fig.7 Influence of Initial Concentration on NPX Removal(a) and First-Order Reaction Rate Constant(b)
由图7(a)可知:随着萘普生初始浓度从20 mg/L增加到60 mg/L,反应15 min时,TOC去除率从64.5%降至58.5%,仅降低了6%;但是,当反应进行到5 min时,TOC的去除率分别为53.9%,28.5%,降低了25.4%。此外,由图7(b)中不同萘普生初始浓度降解曲线的一级反应速率常数可知,当萘普生初始浓度为20、40、60 mg/L时,k分别为0.105 2、0.092 6、0.094 7 min-1。由此可知,随着萘普生浓度的增大,其降解曲线对应的一级反应速率常数基本相同,即k与萘普生的初始浓度无关。一级反应动力学方程如式(1)。
-dC/dt=kC
(1)
其中:C——污染物的初始浓度,mg/L;
t——时间,min;
k——表观反应速率常数,min-1。
由此可知,污染物的浓度与k无关,说明萘普生的降解曲线符合一级反应动力学方程。徐超等[8]研究表明,在臭氧氧化萘普生的过程中,萘普生的降解率随着初始污染物浓度升高而降低。但降解的绝对量随之增大。这主要是由于在反应过程中,萘普生会被氧化成多种中间产物,这些中间产物会增大臭氧的消耗,但臭氧的投加量没有增加,从而降低了萘普生的降解率。此外,Ma等[15]研究表明,在催化臭氧的过程中,初始污染物和中间产物的增多会过度吸附在催化剂表面,占据了表面活性位点,这不利于羟基自由基的生成,导致了较低的去除率。
2.5 催化机理
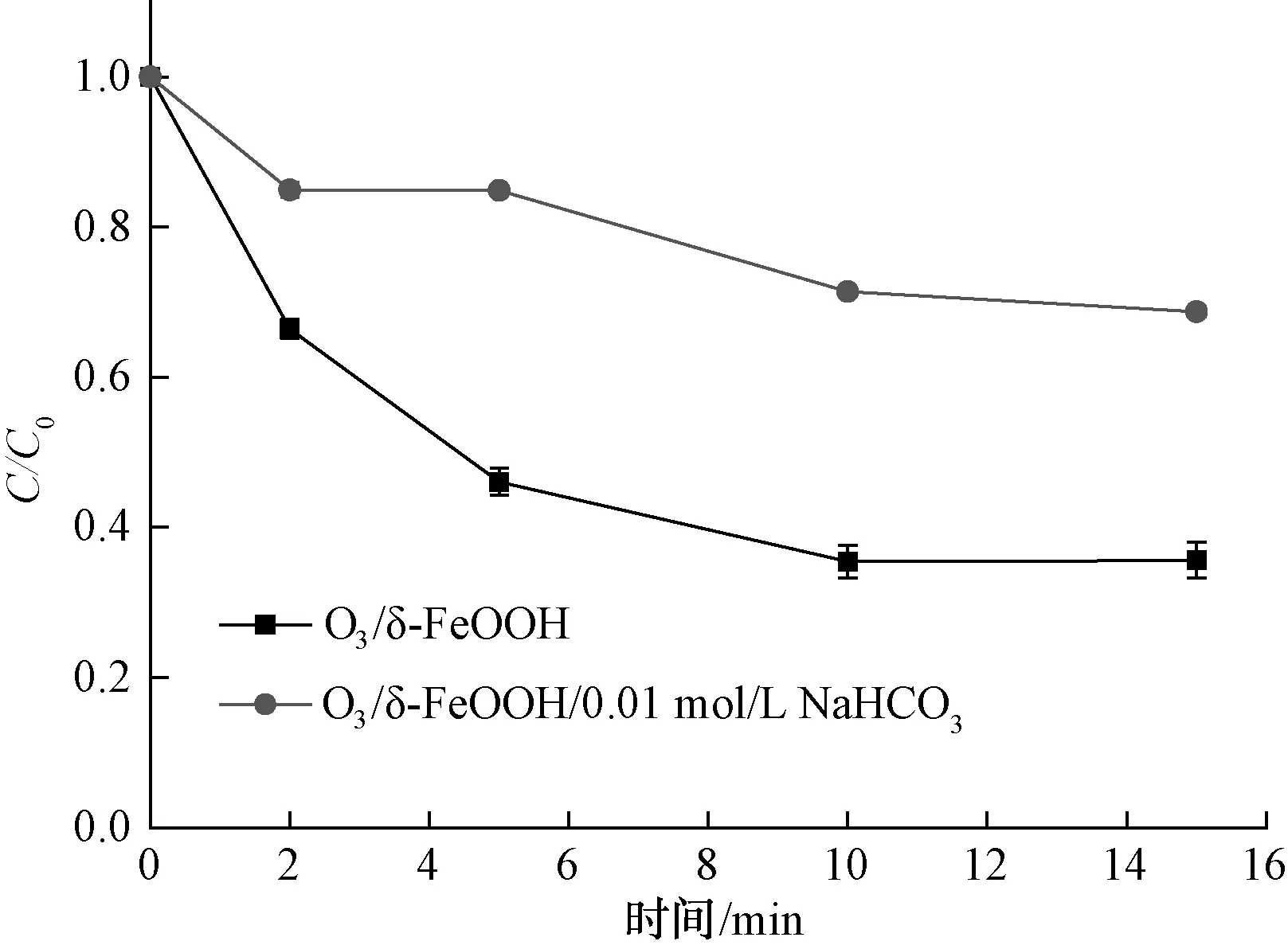
图8 碳酸氢钠对萘普生降解效果的影响Fig.8 Effect of NaHCO3 on NPX Removal
2.6 δ-FeOOH催化剂的稳定性
为了研究δ-FeOOH催化剂的稳定性,在室温、萘普生初始浓度为20 mg/L、催化剂投加量为2.0 g/L、臭氧投加量为7.4 mg/L、溶液初始pH值为7.0的条件下反应15 min,测定萘普生的去除率。每次反应后,通过离心收集催化剂并使用去离子水洗涤数次,在60 ℃下干燥后备用。如图9所示,萘普生的首次去除率为63%。经过5次利用后萘普生的去除率保持在57%,没有造成去除率的明显下降。结果表明,δ-FeOOH催化剂具有良好的稳定性。因此,δ-FeOOH是一种较好的催化臭氧氧化的非均相催化剂。
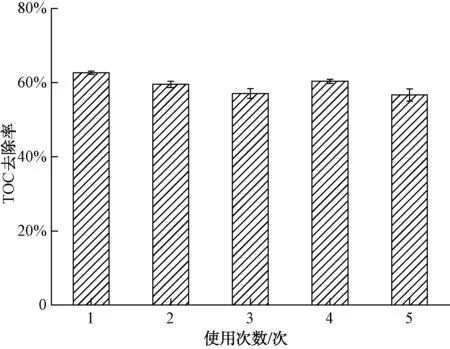
图9 催化剂循环使用次数对萘普生降解效果的影响Fig.9 Effect of Catalyst Recycling Number of Times on NPX Removal
3 结论
(1)采用简便的方法合成了高比表面积的δ-FeOOH纳米催化剂,该催化剂的形貌是厚度约为4 nm的六角层状结构,并且具有介孔特征,BET比表面积为191.73 m2/g。
(2)在萘普生初始浓度为20 mg/L、催化剂投加量为2.0 g/L、pH值为7.0、臭氧浓度为7.4 mg/L条件下反应15 min时,TOC的去除率为64.5%,与单独臭氧相比提高了38.4%,且δ-FeOOH对萘普生的吸附作用微弱,对TOC的去除可忽略不计。
(3)探究催化剂投加量、臭氧浓度、污染物初始浓度对萘普生降解效果影响的过程发现,在一定程度上增加催化剂和臭氧浓度可以提高萘普生的去除率。当存在过量的催化剂和臭氧浓度时,萘普生的去除率提高并不明显,且随着污染物初始浓度的增加会降解萘普生的去除率。

