乙醇酸在水中溶解度的测定与关联
陈 亮
(中国石油化工股份有限公司上海石油化工研究院,绿色化工与工业催化国家重点实验室,上海 201208)
乙醇酸又名羟基乙酸,是一种重要的化工产品和有机合成中间体,用途非常广泛[1]。工业上一般采用氯乙酸水解法[2]、氰化法[3]、甲醛羰基化法[4]、催化歧化法[5]和合成气法[6]生产乙醇酸。我国企业主要采用氯乙酸水解法和氰化法生产乙醇酸,氯乙酸水解法的不足是原料氯乙酸具有强烈的腐蚀性,产品中有大量氯离子;氰化法的不足是原料氰氢酸和中间产物羟基乙腈都具有很强的毒性,而且使用硫酸作为水解催化剂,产品中含有大量的硫酸根离子。中国石化上海石油化工研究院成功开发了合成气法制备乙醇酸技术,并且在扬子石化完成了中试,为乙醇酸生产开辟了一条新的绿色生产路线,有望能取代现有的生产工艺。乙醇酸产品主要有70%乙醇酸水溶液和99%乙醇酸晶体两种规格,其中,70%乙醇酸水溶液主要用于化学清洗[7],而99%乙醇酸晶体主要用于合成生物降解材料和日用护肤品等高端领域[8],产品附加值也更高。99%乙醇酸晶体一般以70%乙醇酸水溶液(游离酸浓度64%)为原料,通过冷却结晶得到[9]。由于乙醇酸在水中的溶解度较高,降温至-7.9 ℃时结晶回收率仅34.8%,因此,为了提高晶体产量,一般需要在更低温度下结晶、或者对结晶母液进行浓缩后重结晶。溶解度数据是结晶分离技术开发的基础数据,文献报道的乙醇酸溶解度数据的温度(浓度)范围(-7.9~8.3 ℃)较窄[10],低温结晶(结晶温度<-8 ℃)和母液浓缩后重结晶(结晶温度>9 ℃)所需的溶解度数据目前尚未有系统的研究报道。
本文采用静态平衡法测定了257.6~313.51 K乙醇酸在水中的溶解度数据,并用Van’t Hoff方程、Apelblat方程、λh方程、Wilson方程和NRTL方程对实验数据进行关联,关联得到的溶解度模型可用于乙醇酸结晶工艺的设计计算。
1 实验部分
1.1 试剂与仪器
乙醇酸晶体,梯希爱(上海)化成工业发展有限公司,在实验室进行多次重结晶,重结晶的乙醇酸晶体经液相色谱分析无杂质峰,经酸碱滴定分析其纯度>99.9%;去离子水,自制;氢氧化钠,分析纯,国药集团化学试剂有限公司;盐酸,分析纯,国药集团化学试剂有限公司。
MSA225S分析天平,德国Sartorius公司;T70酸碱滴定仪,瑞士Mettler-Toledo公司;E2695高效液相色谱,美国Waters公司;RH Digital White磁力搅拌器,德国IKA公司;Unistat 405W加热制冷循环一体机(自带PT100热电阻),德国Huber公司;200 mL平底玻璃夹套结晶器,自制。
1.2 方 法
乙醇酸溶解度的测定采用平衡法,实验步骤如下:向结晶器中加入一定量的去离子水和过量的乙醇酸晶体,插入PT100热电阻;将结晶器放置在磁力搅拌器上,打开磁力搅拌,调节转速,确保结晶器中晶体悬浮;打开加热制冷循环一体机,与PT100热电阻连接,打开控制软件实时记录结晶器内部和夹套温度;打开加热制冷循环一体机的外循环,向结晶器夹套通入换热介质(硅油),开始控制结晶器内部的温度,将结晶器内部温度控制在某一温度下,恒温6 h以上,确保乙醇酸在水中达到固液平衡;停止搅拌,静置,确保固液两相充分分离,为防止细晶的干扰,在10 mL注射器针筒上先安装0.45 μm孔径的针头过滤器再安装针头,然后插入结晶器中吸取少量上层的清液,采用酸碱滴定法分析乙醇酸浓度,进而计算出乙醇酸的溶解度。
1.3 溶解度模型
1.3.1 Van’t Hoff方程
根据固液平衡理论可得到溶解度的普遍化形式[11],进一步可以简化成Van’t Hoff方程[12]:
(1)
式中,x1为溶质的浓度,摩尔分数;ΔHm为溶质的熔化焓,J/mol;R为气体常数,J/(mol·K);Tm为溶质的熔点,K。
由于ΔHm、R、Tm都可视为是恒定值,因此,上式可以写成简化的Van’t Hoff方程:
(2)
式中,A,B为模型参数,可由实验数据回归得到。
1.3.2 Apelblat方程
Apelblat等假定溶液的焓变为温度的线性函数,基于Clausius-Clapeyron方程推导出溶解度的经验方程[13]为:
lnx1=A+B/T+ClnT
(3)
式中,A,B,C为模型参数,可由实验数据回归得到。
1.3.3λh方程
λh方程是由Buchowski等首先提出的专门预测固体溶解度的方程,其表达式[14]为:
(4)
式中,λ和h为模型参数,可由实验数据回归得到。
1.3.4 活度系数模型
活度系数模型只能求出组分的活度系数,溶解度的计算还需要固液平衡方程:
(5)
式中,γ1为溶质的活度系数。
对于二元体系,Wilson方程[15]可表示为:
(6)
(7)
(8)
式中,gij-gji为二元交互参数,J/mol,可由实验数据回归得到;γ1和γ2分别为溶质和溶剂的活度系数;V1和V2分别为溶质和溶剂在该状态下为纯液态时的摩尔体积,m3/mol。
对于二元体系,NRTL方程[16]可表示为:
(9)
(10)
(11)
(12)
G12=exp(-α12τ12)
(13)
G21=exp(-α21τ21)
(14)
式中,gji-gii为二元交互参数,J/mol,可由实验数据回归得到;γ1和γ2分别为溶质和溶剂的活度系数;αij为非随机性参数,其值一般在0.2到0.47之间。
2 结果与讨论
2.1 溶解度测定
采用平衡法测定了乙醇酸在水中的溶解度。乙醇酸水溶液是低共熔体系,存在结晶低共熔点,约为-19 ℃,结晶过程的操作温度一般要高于低共熔点,因此溶解度测定的温度下限设为-15 ℃。同时,乙醇酸水溶液中还存在总酸和游离酸的平衡,即乙醇酸在水中容易分子间脱水聚合形成二聚体或多聚体,而且高温下更容易聚合,因此对结晶母液进行浓缩时温度不能太高,浓缩后的母液浓度也不能太高,否则游离酸的损失增加,不利于提高回收率,因而溶解度测定的温度上限设为40 ℃,此时游离酸浓度为78%,总酸浓度约为92%,完全满足后续重结晶对原料浓度的要求。
图1为测定的乙醇酸在水中的溶解度。从图1可以看出,实验数据与文献值以及结晶母液的浓度均吻合较好,并且乙醇酸在水中的溶解度随温度的升高而显著增加,适合采用冷却结晶的方法进行分离提纯。
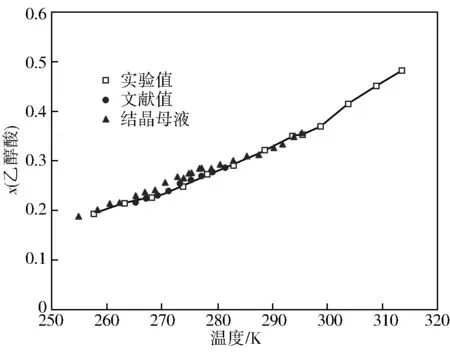
图1 乙醇酸在水中的溶解度

表1 乙醇酸在水中的溶解度及关联结果

表2 乙醇酸在水中的溶解度及关联结果(活度系数模型)
2.2 不同模型拟合
分别用Van’t Hoff方程、Apelblat方程、λh方程、Wilson方程和NRTL方程对实验数据进行关联,关联得到的模型参数、溶解度计算值、相对误差、平均相对误差、相关系数同时列于表1和表2中。其中,T为温度,xexp为实验测定的溶解度(摩尔分数),xcal为模型计算得到的溶解度(摩尔分数)。
相对误差(RD)为:
(15)
平均相对误差(ARD)为:
(16)
由表1和表2可见,上述5种模型对乙醇酸在水中的溶解度的关联效果均较好,相关系数(R2)均在0.99以上,平均相对误差(ARD)均小于2.64%,其中,λh方程关联的效果最好,平均相对误差(ARD)约1.06%。
3 结 论
a.采用平衡法测定了257.6~313.51 K乙醇酸在水中的溶解度,乙醇酸在水中的溶解度随着温度的升高而显著增加。
b.分别采用Van’t Hoff方程、Apelblat方程、λh方程、Wilson方程和NRTL方程对乙醇酸在水中的溶解度进行了关联,获得了相关模型参数。5种溶解度模型的关联效果均较好,相关系数(R2)均在0.99以上,平均相对误差(ARD)均小于2.64%,其中,λh方程关联的效果最好,平均相对误差(ARD)约1.06%。

