凝血指标在小细胞肺癌中的临床和预后价值:一项回顾性研究
聂 建 陈公琰
肺癌是目前全世界范围内发病率和死亡率最高的恶性肿瘤。根据组织学分型,肺癌分为小细胞肺癌(Small cell lung cancer,SCLC)和非小细胞肺癌(Non-small cell lung cancer,NSCLC),其中SCLC占所有肺癌的15%~20%,是肺癌中恶性程度最高的亚型[1-2]。尽管SCLC患者对化疗药物非常敏感,但极易产生耐药和复发,约80%的未治愈的局限期患者(Limited-stage disease,LD)和100%的广泛期(Extensive-stage disease,ED)患者的治疗结果仍然很差[3]。因此,需要有效的预测标记来评估患者的预后并帮助做出最佳的治疗选择。目前关于凝血指标与肺癌的研究主要集中在NSCLC,关于SCLC化疗与凝血指标的关系研究较少。本研究回顾性调查了210例SCLC患者,分析其临床特征、凝血指标和外周血象,探讨化疗对凝血指标的影响,并评估凝血指标对SCLC患者的预后意义。
1 资料与方法
1.1 一般资料
收集2013年10月—2016年12月在哈尔滨医科大学附属肿瘤医院诊断的210例SCLC患者资料,其中男133例,女77例,年龄32~79岁,平均年龄57.3岁。116例(55.2%)患者有吸烟史,94例(44.8%)患者没有吸烟史。表现状态(PS)在0~1分的患者128例(61.0%),2~4分的患者82例(39.0%)。117例(55.7%)患者为LD,93例(44.3%)ED。在210例患者中,146例患者接受依托泊苷和顺铂(69.5%),其中52.9%的患者对化疗和或放疗和或手术有反应(CR+PR)。病例纳入标准:所有患者均经组织病理学或细胞学检查确诊为SCLC;均为无法手术的初治化疗患者;均不合并有血栓性疾病或出血性疾病;治疗前均未行过抗凝治疗。所有患者均签署知情同意书。
1.2 分组标准和方法
分别采集SCLC患者化疗前及第2个周期化疗结束后3周空腹静脉血2 mL,枸橼酸钠抗凝,以3 000 r/min离心10 min,收集血浆置于-80℃冰箱保存待检。采用全自动血凝分析仪对血浆凝血酶原时间(PT)、部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、凝血酶时间(TT)及D-二聚体(D-D)检测;采用全自动血细胞分析仪进行血小板(PLT)检测。
根据正常标准:PLT:(100~300)×109/L,PT:10~15 s,APTT:24~32.8 s,FIB:2.00~4 g/L,TT:11~21 s,D-D:0~0.55 mg/L,将化疗前PLT、D-D、FIB中任意一项指标大于正常上限或PT、APTT、TT三者中任意一项低于正常下限定义为高凝组,其余为正常组[4]。其中,将PLT、FIB和D-D又分为正常(ULN),高(>ULN且≤2×ULN)和更高组(>2×ULN)。使用东部肿瘤协作组(ECOG)评分标准评估PS。根据实体瘤疗效评价标准(RECIST)评价疗效。根据美国退伍军人医院肺癌研究组(VALG)制定的分期标准进行SCLC分期,分为LD和ED。
1.3 随访情况
所有患者自确诊之日起开始随访,随访形式采用电话询问。随访截止时间为2019年5月1日,最短随访时间为5个月,最长为65个月,中位随访时间为12个月。将随访期间死于其他原因的患者、失访者、或研究截止时仍生存者,均记为截尾值。总生存时间(Overall survival,OS)为确诊日期至死亡日期或随访截止日期,以月为计算单位。
1.4 统计学方法
采用SPSS 21.0软件对数据进行分析,计量资料用均数±标准差表示,本研究计量资料进行重复测量方差分析检验不符合球形分布假设,两组均数比较采用多变量方差分析,计数资料使用χ2检验,应用Kaplan-Meier法和Log-rank检验进行单因素生存分析,采用Cox风险回归模型进行多因素预后分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征
根据凝血状态将患者分为高凝组136例和正常组74例。两组患者在年龄、性别、吸烟史和临床分期等临床特征方面无统计学差异(P>0.05)(表1)。
2.2 高凝组和正常组化疗前后凝血指标的比较
经化疗后,高凝组PLT、FIB和D-D值均有所下降,其中FIB值明显低于化疗前水平(P<0.05),而PT、APTT和TT化疗前后差异无统计学意义(P>0.05);正常组化疗后PLT、PT、APTT、FIB、TT和D-D值与化疗前相比差异无统计学意义(P>0.05)(表2)。
2.3 临床各因素对SCLC患者OS的影响
性别、FIB、PS和临床分期是影响患者预后的风险因素(表3)。女性患者比男性患者中位OS长(14.0个月vs. 11.5个月,P=0.041),PS评分0~1的患者的中位OS明显长于PS评分大于1的患者(17.3个月vs. 6.4个月,P<0.001),ED-SCLC患者的中位OS比LD-SCLC患者短(6.8个月vs. 19.4个月,P<0.001),FIB异常升高的患者,中位OS低于正常患者(6.4个月vs. 11.5个月vs. 12.4个月,P=0.009)。虽然PLT和D-D异常升高的患者与正常患者的生存曲线比较差异无统计学意义,但是PLT和D-D异常升高患者的中位OS都低于正常患者(8.1个月vs. 11.6个月vs. 12.8个月,P=0.206;8.4个月vs. 10.2个月vs. 13.5个月,P=0.132)(图1)。
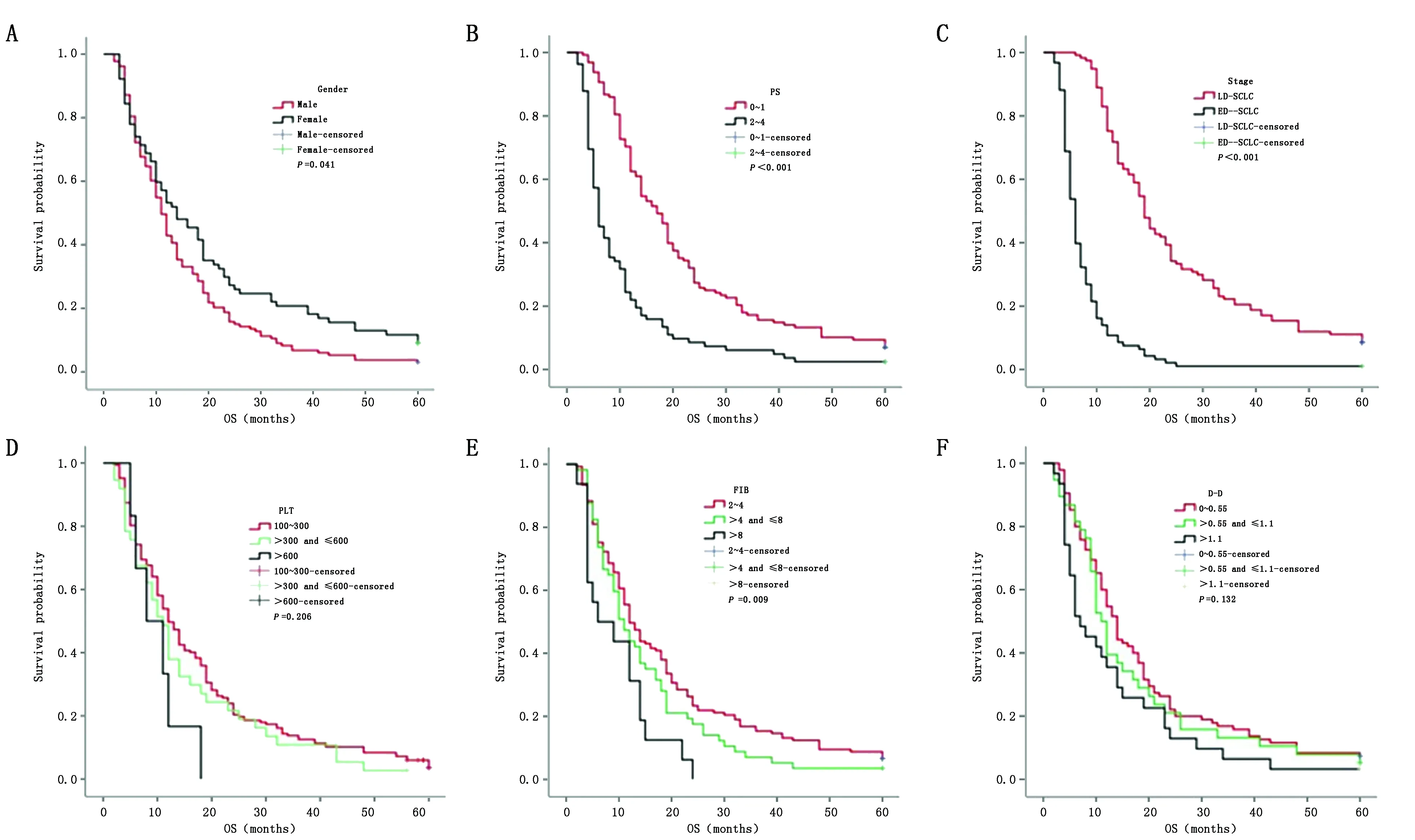
图1 不同性别、表现状态、分期、PLT、FIB和D-D的SCLC患者OS曲线Figure 1 OS curve of SCLC patients by gender,PS,stage,PLT,FIB and D-D

表2 小细胞肺癌高凝组和正常组患者化疗前后变化Table 2 Changes in the hypercoagulable and normal groups before and after chemotherapy of SCLC patients
2.4 SCLC患者OS影响因素的多因素分析
将单因素分析P<0.1的因素(性别、PS、临床分期、PT、FIB和D-D)纳入Cox多因素回归分析,结果显示,PS、临床分期、PT和FIB是SCLC患者OS的独立预后影响(表4)。
3 讨论
大量研究证明在肿瘤患者中普遍存在不同程度的凝血功能异常,肺癌也不例外[5-6]。在肺癌患者中发现包括PLT、FIB、D-D在内的凝血指标常常升高[7-8],其可能的原因为[9-11]:(1)患者机体蛋白代谢、体液代谢出现异常,部分组织器官坏死,血液动力学发生改变,导致血细胞数量的改变和血液运行的异常;(2)肿瘤细胞可破坏血管内皮细胞,导致凝血因子直接激活凝血途径和凝血酶形成或纤溶酶原激活物直接激活纤维蛋白溶解系统;(3)自身原因,包括吸烟、肥胖、高血压、糖尿病等伴随疾病。血液高凝不仅会促进肿瘤细胞的转移与浸润,甚至会形成血栓,影响肺癌患者经治疗后的预后情况,危及患者的生命。
血小板由骨髓巨核细胞产生,对机体的止血功能极为重要。有研究指出,血小板可促进肿瘤的生长和新生血管的形成,对肿瘤的转移及癌栓的形成起到重要作用,是多种肿瘤的独立预后因素[12-13]。本研究结果显示,高凝组和正常组经化疗后PLT均有下降,但考虑临床血小板影响因素较多,如化疗后的骨髓抑制、骨髓转移等方面,故仍需进一步分析研究。此外,我们发现PLT升高组的生存时间比正常组短,这与大多数研究结果一致,但本研究的多因素分析显示PLT不是影响SCLC患者预后的独立因素。
纤溶系统亢进也是血液高凝状态的反映,FIB和D-D是反映体内存在纤溶亢进及高凝状态的特异性指标。FIB是由肝脏产生,是重要的具有凝血功能的蛋白质。肿瘤患者中常常发现FIB值升高,其原因是肿瘤细胞进入血液后与血管内皮细胞及血小板相互作用,通过释放生物活性物质促使血小板激活释放FIB,从而导致FIB升高[14]。D-D是交联纤维蛋白的特异性降解产物,是体内继发性纤维蛋白溶解和高凝状态的特异性标志物[15]。相关研究表明,FIB和D-D与肿瘤的进展、转移和复发密切相关,是肿瘤患者的独立预后因素,FIB和D-D升高的患者预后不良[16-17]。本研究对两组患者化疗前后FIB和D-D的变化进行了统计学分析,结果显示SCLC患者化疗后高凝组FIB和D-D值均有所下降,其中FIB值明显低于化疗前水平,而正常组患者化疗后FIB和D-D值与化疗前相比差异无统计学意义,说明有效的化疗可以改善SCLC患者的高凝状态,但对凝血功能正常的患者无明显影响。然而国外资料显示接受化疗的肿瘤患者的血栓发生率明显提高[18-20],关于肺癌患者接受化疗后血栓发生率是否提高,国内外报道结果各不相同,这可能与病例的入列选择、样本量大小等因素有关,提示该问题仍然需要进一步深入研究。此外,本研究还证实FIB是SCLC患者的独立预后因素,与SCLC患者的生存期呈负相关,但未发现D-D是SCLC患者的独立预后因素。
PT反映外源性凝血系统的凝血因子水平,APTT反映内源性凝血系统的含量,TT是内外源性凝血系统的共同途径。PT、APTT和TT缩短表明体内凝血物质增加。一些研究指出,恶性肿瘤中APTT,PT和TT的阳性率可达10%以上[21-22]。本研究显示血清PT是SCLC患者生存时间的独立预后因素。
综上所述,化疗可以改善SCLC患者的高凝状态,但对凝血功能正常的患者无明显影响;凝血指标异常升高的SCLC患者较凝血指标正常的患者生存期短,预后较差。由于本研究受时间和病例选择等条件限制,样本量较小,结论仍有待进一步多中心、大样本研究证实。但结果提示我们,严密监测SCLC患者化疗前后凝血、纤溶指标和血小板参数的变化,有助于我们早期发现并及时纠正血液的高凝状态,对肿瘤的发生发展及预后都有指导性意义。

