SOX11 抑制食管癌细胞增殖和迁移的机制研究
赵楠楠 秦 文 韩永焕 鲁 静 李亚敏 徐亚君
食管癌(Esophageal cancer,EC)是最常见的消化道恶性肿瘤。在癌症死亡谱排名中,食管癌排名第四;最新数据分析显示,其发病率为17/10万[1-3]。食管癌的确切机制尚不清楚,与化学刺激、炎症、创伤、遗传和生活习惯密切相关。近年来,基因组学的深入研究为食管癌的发生机制和诊疗指明了新的方向和研究思路。
SOX(SRY-related HMG-box)基因家族成员首次通过同源HMG域的决定因子SRY鉴定[4],其蛋白产物调控多种生物学行为进程,如早期胚胎发育、心脏发育和造血[5]、肾和肺发育[6-7]、神经发育[8]等。SOX11是 SOX家族C组成员,研究表明SOX11能促进淋巴瘤套细胞瘤的肿瘤进程[9-10],同时调控黑色素瘤和乳腺癌的发生发展[11-12]。另有文献显示,SOX11在小细胞肺癌、白血病和Burkett ′s淋巴瘤肿瘤组织中差异性表达,发挥抑癌或促癌作用[13-15],这些研究提示SOX11在肿瘤的差异性作用可能与组织特异性和肿瘤微环境相关。但SOX11在食管癌中的表达和功能尚不清楚。本研究通过考察SOX11在食管癌中的表达、功能和机制,以期揭示其对食管癌发生发展的意义。
1 资料与方法
1.1 细胞系和临床组织样本
食管癌细胞(EC109、KYSE150、 KYSE410 和 KYSE510)和食管上皮细胞 HEEC购自中科院细胞生物库。细胞用含10% 胎牛血清的DMEM培养液于37℃,5% CO2细胞孵育箱中培养。收集2012年1月—2017年1月赤峰学院附属医院诊治的56例食管癌患者的临床样本,食管癌组织和癌旁组织(指距病灶2 cm的切缘阴性的非肿瘤组织[16])以及正常食管上皮组织15例(正常食管组织来源于体检筛查患者)。本研究获得赤峰学院附属医院伦理委员会批准,同时获得了所有患者知情同意并签字,组织标本病理诊断由赤峰学院附属医院病理科高年制医师诊断和提供。食管癌的诊断依据2018中国食管癌诊治指南[16]。本研究食管癌患者年龄36~71岁,中位年龄52.3岁;其中男性29例,女性27例;本研究正常食管患者年龄44~62岁,中位年龄49.6岁;其中男性9例,女性6例。年龄和性别没有统计学差异(P>0.05)。所有肿瘤患者均为原发性食管癌,手术切除前均未接受化疗、放疗或其他治疗,无其他合并肿瘤;排除标准:临床资料不全者、合并严重糖尿病心脏病的疾病和转移性肿瘤等。
1.2 细胞和组织RNA提取
细胞和临床样本中的RNA提取步骤同文献报道[17]。提取后RNA在Landdrop仪器中测得浓度后-80℃保存;RNA逆转录试剂盒将其逆转为cDNA,实验方法及步骤参考样品实验说明书及参考文献。将逆转录后的cDNA放于-20℃冰箱中保存。
1.3 SOX11过表达载体构建和细胞转染
取对数生长状态下的食管癌细胞EC109,消化、离心并种于六孔板中,37℃细胞孵育箱中继续培养,待细胞融合度至80%~90%时进行细胞转染;转染载体Lipofectamine-2000,分别转染 pcDNA3.1(+)-Flag-SOX11 质粒(实验组)和对照质粒 pcDNA3.1(+)-Flag-Vector(对照组),每孔4 μg质粒。转染后细胞在孵育箱中继续培养48 h后,收集实验组和对照组细胞进行相应的细胞功能实验。
1.4 qRT-PCR
qRT-PCR检测SOX11 mRNA 在食管癌细胞系和临床组织标本中的相对表达:实验步骤同试剂盒使用说明书和文献所述[18]。实时检测 PCR 扩增,选择 GAPDH 作为内参基因,每组样品重复三次,在扩增的指数期对起始模板进行定量,扩增指数越高,相对表达越高。采用2-ΔΔCt法计算 SOX11 的 mRNA 相对表达水平。所有的实验重复三次。本研究中引物序列如下:SOX11-F:5′-CGTGCTGGTACCGCCACCATGGACTAC-3′,SOX11-R:5′-ACGATGATATGGTGCAGCAGGCCGAGA-3′;GAPDH-F:5′-CAATGACCCCTTCATTGACC-3′,GAPDH-R:5′-GACAAGCTTCCCGTTCTCAG-3′。
1.5 免疫组织化学
组织切片包埋及脱蜡、脱缸、微波热抗原修复、37℃室温下过氧化氢封闭、孵一抗(SOX11)并于4℃摇床过夜;第二天孵育二抗(室温下2 h)、DAB显色、染核、封片镜检等。病理评分标准[19]:两位病理医师采用双盲法阅片。按染色深浅进行评分:无阳性染色为0分,浅黄色为1分,深黄色为2分,棕黄色为3分;阳性细胞百分比评分:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。最后二者相乘,0~4分为低表达,4~12分为高表达。
1.6 CCK-8检测细胞增殖活性
细胞转染48 h后实验组和对照组细胞消化离心后计数:分别取实验组和对照组细胞 3 000个/100 μL DMEM 培养液加入96孔板中继续培养约24 h,每孔接种100 μL的细胞悬液。检测前2 h在各孔中分别加入10 μL CCK-8试剂,培养0、24、48和72 h时分别检测实验组和对照组细胞增殖活性,通过酶联免疫检测仪在波长490 nm 处检测各孔的OD值,并绘制细胞生长曲线。所有的实验独立重复三次。
1.7 Transwell 实验检测细胞迁移能力
收集实验组和对照组细胞,消化离心重悬后倒置显微镜下计数:取4×103细胞/孔分别种于 Transell 小室上室和下室,96孔板中加入800 μL DMEN培养液,放入细胞孵育箱中继续培养,24 h后取出小室,固定,亚甲蓝染色,倒置显微镜下计数并评价细胞迁移能力。所有的实验独立重复三次。
1.8 Western blot
从上述细胞和临床组织样本中提取蛋白进行Western blot检测,蛋白提取方法同文献报道[18]。取40 μg/孔蛋白进行凝胶电泳,常温下将电泳分离后的蛋白转膜于PVDF膜上,5%脱脂牛奶的TBST室温下封闭2~3 h,加入一抗并于4℃冰箱封闭过夜。24 h后取出一抗室温TBST液洗膜0.5 h后,二抗封闭液室温下孵育2 h,洗膜显色,Amersham成像仪曝光,并用 Quantity One 软件分析蛋白灰度值,以目的蛋白条带灰度值与内参GAPDH之比来表示相对表达差异。
1.9 数据统计方法
运用SPSS 17.0统计软件进行统计分析,各实验均独立重复3 次,计量资料以均数±标准差表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。癌与癌旁组织配对分析采用配对χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 SOX11在食管癌组织中的表达
与癌旁组织相比,在食管癌组织中SOX11 mRNA表达下调,差异具有统计学意义(P<0.001)(图1A)。与正常食管上皮组织相比,SOX11 mRNA表达在食管癌组织中表达下调,差异具有统计学意义(P<0.001)(图1B)。同时免疫组织化学分析结果显示,SOX11蛋白在食管癌组织中表达下调;通过 IPP9.0 软件进一步分析 SOX11 蛋白表达光密度,与癌旁组织相比(0.361±0.038),SOX11在食管癌中(0.115±0.041)光密度降低(t=15.372,P<0.001)(图1C,D)。

图1 SOX11 在食管癌组织中的表达Figure 1 Expression of SOX11 at levels of mRNA and protein in esophageal cancer and adjacent tissuesNote:A.The mRNA expression of SOX11 was down-regulated in esophageal cancer and Normal tissue,P<0.001;B.The mRNA expression of SOX11 was down-regulated in esophageal cancer and adjacent tissues,P<0.001;C-D.The expression of SOX11 protein was down-regulated esophageal cancer and adjacent tissues.*** P<0.001,when compared with the adjacent tissues.
2.2 SOX11 蛋白表达与食管癌临床病理特征的关系
本研究中临床患者中SOX11的蛋白表达下调与肿瘤分级(P=0.014)、T分期(P=0.036)、淋巴结转移(P=0.014)均有关。与患者性别、年龄、组织分化及预后生存均无关(P>0.05);进一步提示SOX11作为重要的肿瘤相关基因参与食管癌的进程(表1)。
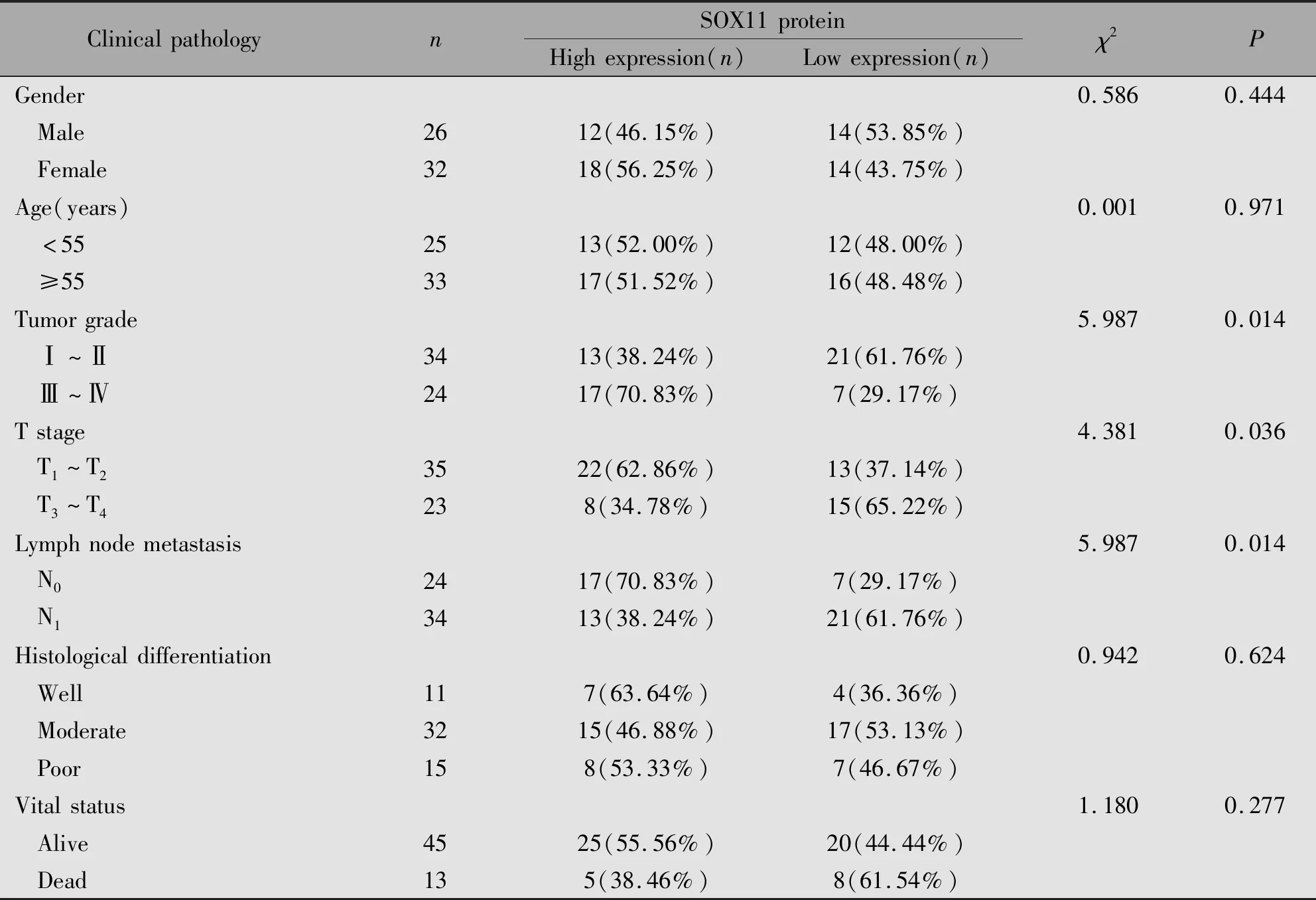
表1 SOX11 蛋白表达与食管癌临床病理特征的关系Table 1 The relationship between the expression of SOX11 protein and clinicopathological features of esophageal cancer
2.3 SOX11 基因表达对肿瘤细胞增殖和迁移能力的影响
与食管上皮细胞 HEEC 相比,SOX11 mRNA 在EC109、KYSE150、 KYSE410 和 KYSE510 中表达下调,在 EC109 细胞中表达最低(P<0.001)(图2A)。因此本研究选择表达最低的食管癌细胞EC109作为研究对象。通过基因转染技术使 SOX11 表达下调的EC109 细胞恢复表达(P<0.001)(图2B)。CCK-8实验显示,过表达SOX11基因48 h后,细胞增殖明显受到抑制(P<0.001)(图2C)。细胞迁移实验显示,过表达 SOX11 基因后,细胞迁移水平受到抑制(P<0.001)(图2D,E)。
2.4 SOX11 对 Wnt/β-catenin 信号通路的影响
研究显示SOX 家族能通过 HMG域与 Wnt 因子相结合,参与调控 Wnt信号通路。为进一步验证 SOX11 对 Wnt/β-catenin 信号通路的影响及作用机制,通过qRT-PCR法和Western blot检测过表达 SOX11对active-β-catenin 及下游靶基因的影响。本结果显示,过表达 SOX11 蛋白后,active-β-catenin 及下游靶基因 c-Myc 的表达明显受到抑制(P<0.001);同时上皮-间质转化相关分子相基因表达水平明显受到抑制,过表达 SOX11 后 Vimentin、N-cadherin 的蛋白和 mRNA表达水平降低(P<0.001),E-cadherin的蛋白和 mRNA表达水平升高(P<0.001)(图3)。
3 讨论
食管癌是临床常见的恶性肿瘤,对患者健康危害严重,由于其致病的复杂性,很难在疾病的早期发现和诊断。通常多数确诊患者在肿瘤中晚期失去最佳治疗期的时机。食管癌的发病是一个多阶段、多步骤的过程,由多种致病因素引起,常伴有细胞损害和细胞内平衡紊乱。至今,食管癌的致病机制和研究进展仍不完全清楚,需要进一步研究。

图2 SOX11 对细胞增殖和迁移的影响Figure 2 Effects of SOX11 on proliferation and migration of esophageal cancer cellsNote:A.The mRNA expression of SOX11 was down-regulated in esophageal cancer cells when compared to HEEC cells,***P<0.001;B.The over-expressed SOX11 in EC109 cells,***P<0.001;C.The proliferation ability in over-expressed SOX11 EC109 cells,***P<0.001;D-E.The invasion capacity in over-expressed SOX11 EC109 cells,***P<0.001(200×).

图3 免疫蛋白质印迹法检测SOX11对WNT/β-catenin信号通路的影响Figure 3 SOX11 disrupted the WNT/β-catenin signaling pathwayNote:A.The expression of total β-catenin,active β-catenin and its downstream genes was examined in EC109 cells by Western blot;B.Quantitative analysis of protein bands,*** P<0.001;C.The mRNA expression of β-catenin and its downstream genes were examined in EC109 cells by RT-qPCR,*** P<0.001.
SOX11是一种核转录因子,属于SOX家族中C族成员,位于染色体2p25.2区,包含编码441个氨基酸组成的蛋白质[20]。在大多数分化成熟组织中,SOX11的表达相对较低;而SOX11在胚胎发育中,如神经发育以及四肢、面部和肾脏的发育起重要的作用[21]。在脑发育后期,SOX11在一些分化的脑神经元中高表达,在脑发育中发挥着重要的作用[22]。近年来研究发现SOX11促进间充质干细胞及愈伤组织的骨化,促进骨折愈合[23]。SOX11也被发现参与上皮-间质转化(EMT)、细胞周期转录调控、肿瘤微环境等生物学行为;同时作为重要的分子肿瘤标记物预测肿瘤预后[11,24-25]。但SOX11在食管癌中作用机制尚未见报道和研究。
本研究检测了 SOX11 在食管癌组织中的相对表达。结果显示,与配对癌旁组织相比,SOX11 mRNA和蛋白在食管癌组织中表达下调。与正常组织相比,SOX11 mRNA在食管癌组织中表达下调,提示SOX11可能作为潜在的抑癌基因参与食管癌的进程。进一步分析SOX11表达与相关临床病理特征关系,结果提示食管癌中 SOX11 蛋白表达与肿瘤分级、T分期以及淋巴结转移均相关;而与患者性别、年龄、组织分化及预后均无关。为证实SOX11是否为功能性的抑癌基因参与食管癌的进程,本研究发现恢复表达 SOX11 能抑制食管癌细胞EC109细胞增殖和迁移,为明确 SOX11 抑制食管癌细胞增殖和转移的分子机制,半定量PCR和免疫蛋白印迹实验发现,过表达 SOX11 后的EC109细胞,active-β-catenin及下游的转移因子c-Myc的表达下调;同时上皮-间质转化相关分子表达水平明显受到抑制。与前期实验和文献报道相一致[11-15]。
综上所述,本研究SOX11基因在食管癌组织和细胞系中表达下调,过表达 SOX11 后能通过抑制Wnt/β-catenin信号通路调控食管癌的进展。但SOX11基因能否作为食管癌诊断、治疗和判断预后的分子靶点,尚需要进一步临床验证。

