LncRNA NBAT1通过调控miR-3664-5p/Caspase 9分子轴对人乳腺癌细胞增殖的影响
赵云霞 牛 波
近年来乳腺癌的发病率呈逐年上升趋势,发病率排在女性恶性肿瘤的首位[1-2]。其最主要的治疗手段依然是外科手术和化疗[3]。但是,肿瘤细胞耐药的出现严重影响了乳腺癌治疗效果[4]。因此,探究乳腺癌发生发展的分子机制,寻找新的生物治疗靶点依然是目前亟待解决的重大课题[5]。
长链非编码RNAs(Long non-coding RNAs,lncRNAs)是指转录长度大于200个核苷酸并且不翻译成蛋白质的功能性RNA分子。lncRNA与人类健康和疾病密切相关[6-8]。大量研究表明lncRNA在肿瘤发生发展中发挥重要功能,lncRNA与乳腺癌发生、发展密切相关[9-10]。目前已鉴定出HOTAIR、FBXL19-AS1、H19等乳腺癌相关lncRNA[11-12]。成神经细胞瘤相关转录本1(Neuroblastoma associated transcript 1,NBAT1)是一种肿瘤抑制基因,其表达缺失与成神经细胞瘤增殖能力密切相关[13]。近期发现,NBAT1也在骨肉瘤、脑胶质瘤、肺癌细胞的发生发展中发挥着重要的作用[14-16]。但是,关于lncRNA NBAT1在乳腺肿瘤中的作用机制尚不十分清楚,本研究将重点探讨其在乳腺癌发生发展中的作用。
1 材料与方法
1.1 主要试剂
人正常乳腺上皮细胞系MCF-10A,人乳腺癌细胞系MDA-MB-231、MDA-MB-453、MCF-7购自中国科学院细胞库;mimics miR-3664-5p和ASO-miR-3664-5p及其对照购自上海吉玛制药技术有限公司;过表达质粒载体(pcDNA3-NBAT1)和对照质粒载体(pcDNA3-NC)购自天津赛尔生物技术有限公司;MCF-10A专用DMEM/F12培养基购自武汉普诺赛生命科技有限公司;DMEM培养基、胎牛血清均购自美国Gibco公司;RT及PCR引物均由金唯智公司合成,miR-3664-5p的RT引物序列为5′-GTCGTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGACACTCATG-3′;U6的RT引物序列为5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAAAA TATGGAAC-3′;NBAT1上游序列为5′-CTCCACCCATTTGTAAGC-3′,下游序列为5′-AATACCCATGAGTCCATAC-3′;GAPDH的上游序列为5′-TGACTTCAACAGCGACACCCA-3′,下游序列为5′-CACCCTGTTGCTGTAGCCAAA-3′;miR-3664-5p的上游序列为5′-TGCGGAACTCTGTCTTCACTCATG-3′,U6上游序列为5′-TGCGGGTGCTCGCTTCGGCAGC-3′,miR-3664-5p和U6的下游均为5′-CCAGTGCAGGGTCCGAGGT-3′。
1.2 细胞培养及其转染
细胞系MCF-10A置于含5%马血清,10 μg/mL胰岛素,20 ng/mL表皮生长因子,100 ng/mL霍乱毒素,0.5 μg/mL氢化可的松的DMEM/F12专用培养基中,人乳腺癌细胞系MDA-MB-231、MDA-MB-453、MCF-7均置于含10%FBS的DMEM培养基中,37℃、5%CO2恒温培养箱中常规培养。选择对数生长期、生长状态良好,表达lncRNA NBAT1最低的MCF-7细胞用于后续转染实验。当MCF-7细胞融合至70%~80%时,pc-NC组和pc-NBAT1组分别转染pcDNA3-NC载体和pcDNA3-NBAT1载体, pc-NC+mimics NC组、pc-NBAT1+mimics NC组及pc-NBAT1+mimics miR-3664-5p组分别转染pcDNA3-NC+mimics NC、pcDNA3-NBAT1+mimics NC及pcDNA3-NBAT1+mimics miR-3664-5p,转染均按照脂质体Lipo8000TM说明书进行。
1.3 RNA提取,逆转录及实时荧光定量PCR
收集MCF-10A、MDA-MB-231、MDA-MB-453、MCF-7常规培养细胞,及MCF-7细胞pc-NC组和pc-NBAT1组转染后48 h细胞,采用Trizol法提取细胞总RNA,经NanoDrop分析仪检测,OD260/OD280为1.8~2.0。根据逆转录试剂盒说明书将总RNA逆转录为cDNA。NBAT1的定量检测以GAPDH为内参,miR-3664-5p的定量检测以U6为内参,均采用2-ΔΔCt法计算目的基因相对表达量。
1.4 Western blot法检测Caspase 9蛋白表达
收集MCF-7细胞pc-NC组、pc-NBAT1组转染后48 h细胞,用RIPA裂解细胞,提取细胞中的总蛋白,采用BCA法测定蛋白浓度。取各组蛋白样品30 μg进行SDS-PAGE电泳,用PVDF转膜,加入Caspase 9以及GAPDH一抗(1∶1 000)孵育过夜,加入HRP标记的二抗室温孵育2 h,TBST洗涤后,在ECL发光液下显影,用Bio-rad凝胶成像系统曝光并对图像进行分析。
1.5 双荧光素酶报告验证
采用美国Promega公司的pmirGLO双荧光素酶报告基因检测系统,分别化学合成lncRNA NBAT1、Caspase 9的3′UTR区与miR-3664-5p的结合位点序列片段,并插入 pmirGLO luciferase表达载体中,获得野生型载体pmirGLO/NBAT1和pmirGLO/Caspase 9-UTR,同样的方法合成突变序列,获得突变型载体pmirGLO/NBAT1-m和pmirGLO/Caspase 9-mUTR,将pmirGLO/NBAT1和pmirGLO/Caspase 9-UTR野生型载体、pmirGLO/NBAT1-m和pmirGLO/Caspase 9-mUTR突变型载体、mimics miR-3664-5p模拟物或者反义核酸ASO-miR-3664-5p及阴性对照组分别与Lipo8000TM 脂质体混合后转染293T细胞,转染48 h后,收集细胞。按照双荧光素酶报告基因试剂盒说明书,并以海肾荧光值作为内参。计算萤火虫荧光值与海肾荧光值的比值,评估报告基因在细胞中的相对活力。
1.6 CCK-8检测细胞增殖能力
MCF-7细胞接种至96孔板中,每孔细胞数为5×103个。pc-NC组、pc-NBAT1组或pc-NC+mimics NC组、pc-NBAT1+mimics NC组及pc-NBAT1+mimics miR-3664-5p组转染24 h、48 h、72 h、96 h、118 h后,每孔中同时加入90 μL新鲜的含10%胎牛血清的培养液和10 μL的CCK-8溶液,然后置于37℃、5%CO2的培养箱中反应4 h。用免疫酶标仪测定各孔在450 nm 处的吸光度OD值,以各组平均值反映细胞增殖能力。
1.7 平板克隆分析
pc-NC组、pc-NBAT1组或pc-NC+mimics NC组、pc-NBAT1+mimics NC组及pc-NBAT1+mimics miR-3664-5p组转染24 h后,200个细胞/孔接种于12孔板,置于37℃、5%CO2的培养箱中培养,每隔2天换液1次。15天后,弃去培养基,甲醇固定20 min后,每孔加入400 μL的1%结晶紫染色液,室温染色10 min,水漂洗5 min,观察实验结果。
1.8 统计分析
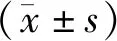
2 结果与分析
2.1 lncRNA NBAT1的表达量
通过在线软件Starbase分析TCGA数据库发现lncRNA NBAT1在1 104例乳腺癌组织中的表达量显著低于其在113例正常乳腺组织中的表达量(P<0.001)(图1A)。lncRNA NBAT1在正常对照细胞株MCF-10A细胞中表达量最高,在MDA-MB-231和MDA-MB-453细胞中其表达量比MCF-10A低(P<0.001),在MCF-7细胞中其表达量最低(P<0.001)(图1B)。
2.2 生物信息学预测lncRNA NBAT1、miR-3664-5p、Caspase 9三者的关系及双荧光素酶报告系统验证
运用Targetscan数据库进行了生物信息学分析,预测miR-3664-5p和lncRNA NBAT1及Caspase 9的结合位点(图2A、2B)。并使用pmirGLO双荧光素酶报告系统进行了进一步验证,检测结果显示,mimics miR-3664-5p能够抑制荧光素酶表达(P<0.001),ASO-miR-3664-5p能够促进荧光素酶表达(P<0.001),但是当miR-3664-5p结合位点突变后,抑制和促进作用均消失(图2C、2D),进一步证明lncRNA NBAT1可以吸附miR-3664-5p,同时Caspase 9是miR-3664-5p的靶基因。
2.3 过表达lncRNA NBAT1对MCF-7中miR-3664-5和Caspase 9表达的影响
lncRNA NBAT1过表达载体pcDNA3-NBAT1和对照载体pcDNA3-NC分别转染乳腺癌细胞株MCF-7,qPCR方法检测pc-NBAT1组lncRNA NBAT1的表达较pc-NC组增高(P<0.001);qPCR检测pc-NBAT1组miR-3664-5的表达较pc-NC组降低(P<0.001);Western blot检测pc-NBAT1组Caspase 9蛋白的表达较pc-NC组增高(P<0.001)(图3)。
2.4 CCK-8和克隆形成检测细胞的增殖能力
CCK-8和克隆形成检测过表达lncRNA NBAT1后细胞的增殖能力降低;如果同时将lncRNA NBAT1过表达载体和mimics miR-3664-5p转染MCF-7细胞,观察发现miR-3664-5p过表达能够缓解过表达lncRNA NBAT1对细胞增殖的抑制效应(图4)。
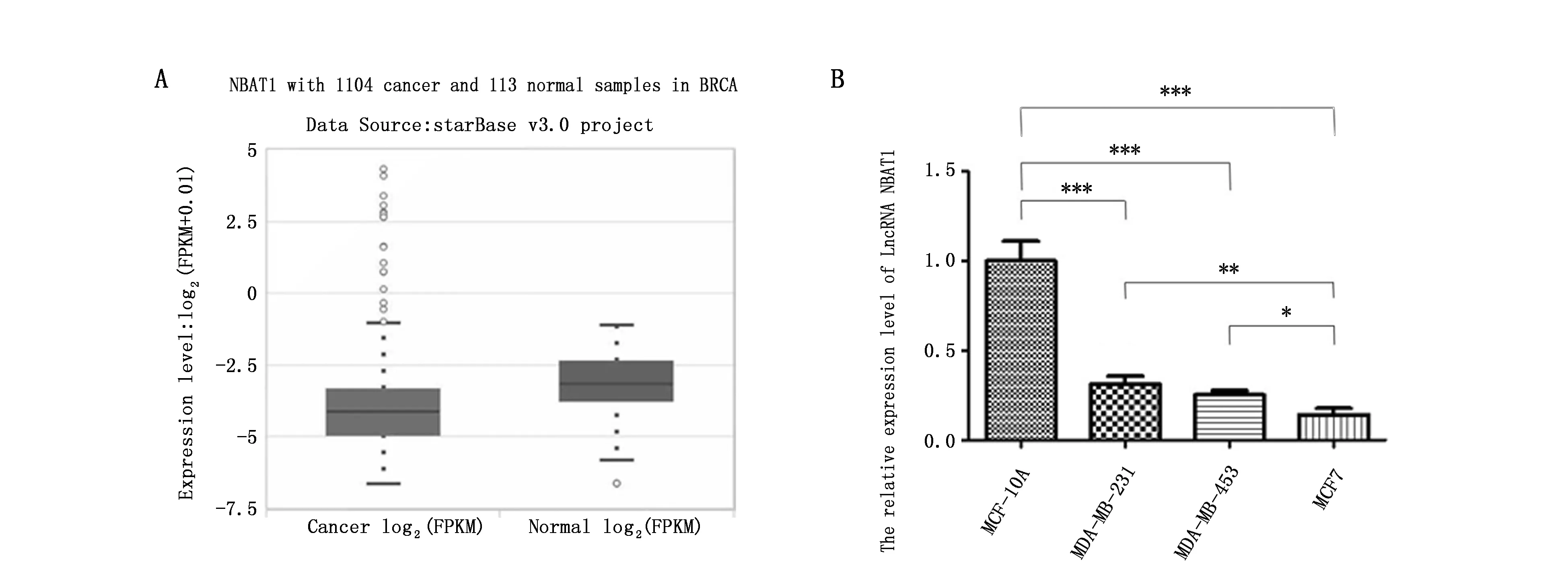
图1 lncRNA NBAT1在组织和细胞系中的相对表达量Figure 1 The expression of lncRNA NBAT1 in breast tissues and breast cell linesNote:A.The expression of lncRNA NBAT1 in breast cancer and normal tissues;B.The expression of lncRNA NBAT1 in breast cancer cell lines and normal cell line.*P<0.05,**P<0.01,***P<0.001,when compared with the MCF-10A group(n=3).
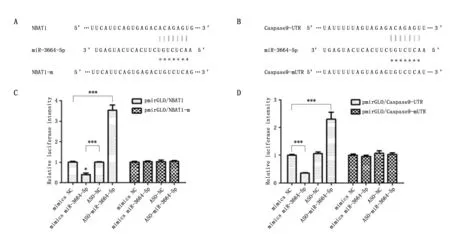
图2 lncRNA NBAT1、miR-3664-5p、Caspase 9三者的靶定关系的预测及验证Figure 2 The predicted binding sites of miR-3664-5p in lncRNA NBAT1 and Caspase 9 by the dual-luciferase reporter systemNote:A.The predicted binding sites of miR-3664-5p in lncRNA NBAT1 and lncRNA NBAT1 mutant sequences;B.The predicted binding sites of miR-3664-5p in Caspase 9-UTR and Caspase 9-mUTR sequences;C.Dual-luciferase reporter analysis for the miR-3664-5p binding to lncRNA NBAT1;D.Dual-luciferase reporter analysis to confirm that the Caspase 9 was a target-gene of miR-3664-5p.***P<0.001,when compared with the mimics NC group(n=3).

图3 MCF-7细胞过表达NBAT1后对miR-3664-5和caspase9表达的影响Figure 3 The effect of lncRNA NBAT1 on the expression of miR-3664-5 and Caspase 9Note:A.qPCR analysis for the relative expression of lncRNA NBAT1 in MCF-7 cells transfected with pcDNA3-NBAT1 and pcDNA3-NC plasmids;B.qPCR analysis for the relative expression of miR-3664-5p in MCF-7 cells transfected with pcDNA3-NBAT1 and pcDNA3-NC plasmids;C.Western blot analysis for the relative protein expression of Caspase 9 in MCF-7 cells transfected with pcDNA3-NBAT1 and pcDNA3-NC plasmids.***P<0.001,when compared with the pc-NC group(n=3).
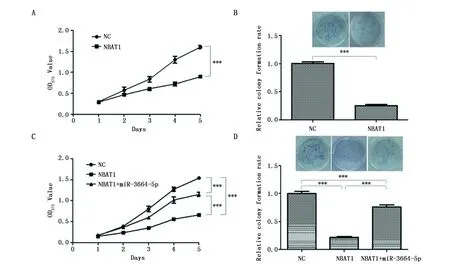
图4 CCK8和克隆形成实验检测lncRNA NBAT1对MCF-7细胞的增殖能力影响Figure 4 The effects of lncRNA NBAT1 on proliferation of MCF-7 cells by CCK-8 and colony formating assaysNote:A.The effect of lncRNA NBAT1 on proliferation of MCF-7 cells by CCK8 assay;B.The effect of lncRNA NBAT1 on proliferation of MCF-7 cells by colony formating assay;C.CCK-8 assay for the rescue effect of miR-3664-5p on the proliferation of MCF-7 with lncRNA NBAT1 overexpression;D.Colony formation assay for the rescue effect of miR-3664-5p on the proliferation of MCF-7 with lncRNA NBAT1′s overexpression.***P<0.001,when compared with the pc-NC group(n=3).
3 讨论
lncRNA是一类长度大于200个核苷酸的内源性非编码单链RNA,lncRNA可以通过染色质重塑、转录调控以及转录后调控等方式参与机体的表观遗传调控。lncRNA参与了细胞增殖分化、神经发育、免疫稳态、肿瘤发生等生命过程[6]。lncRNA在乳腺癌的研究有许多进展,lncRNA FBXL19-AS1在乳腺癌中高表达,通过抑制has-miR-718,促进乳腺癌细胞的增殖和侵袭[11]。lncRNA-PANDAR在乳腺癌组织及细胞系中高表达,可以抑制p16的表达,促进乳腺癌细胞的增殖[17]。lncRNA NBAT1在乳腺癌中的作用并不清楚,研究其在乳腺癌发生、发展中的作用,将有助于更加全面地了解乳腺癌发生发展的机制。
在本研究中,通过对TCGA数据库中lncRNA NBAT1的表达分析比较,发现lncRNA NBAT1低表达于乳腺癌组织当中。lncRNA NBAT1可能在乳腺癌的发生发展过程具有一定的调控作用。为进一步探讨lncRNA NBAT1在乳腺癌细胞中的生物学功能,本研究应用重组质粒在乳腺癌MCF-7细胞中特异性过表达lncRNA NBAT1,通过CCK-8和克隆形成实验进一步证实,过表达lncRNA NBAT1对MCF-7细胞增殖能力有明显抑制作用。lncRNA的作用机制较为复杂,其中一种重要机制即是作为分子海绵与microRNA结合进而抑制其对下游相应靶mRNA的沉默效应。通过Targetscan在线生物信息学网站的检索表明,miR-3664-5p可能是lncRNA NBAT1的结合分子之一。综上可推测,lncRNA NBAT1的抗乳腺癌细胞增殖作用可能是通过吸附miR-3664-5p的来实现的。为证实这一假说,本研究通过过表达MCF-7细胞内lncRNA NBAT1,采用RT-qPCR检测发现,过表达lncRNA NBAT1可明显抑制MCF-7细胞内miR-3664-5p的表达水平。Targetscan在线预测网站分析表明Caspase 9基因是miR-3664-5p的下游抑制靶点。Caspase 9是内源性凋亡通路中关键蛋白酶,处在凋亡相关基因Caspase顶端[18]。Caspase 9可以激活细胞凋亡途径中的最关键酶Caspase 3,从而促进细胞的凋亡。因此,它的活化对于整个内源性凋亡通路的激活尤为重要。通过进一步研究发现,在过表达lncRNA NBAT1后MCF-7细胞内Caspase 9的表达水平也有所提高,细胞增殖受到明显抑制。至此,本研究初步表明lncRNA NBAT1的作用机制是通过吸附miR-3664-5p发挥作用,进而释放对Caspase 9的抑制作用而实现的。同时通过双荧光素酶报告系统进一步验证miR-3664-5p和Caspase 9的靶向关系。
综上所述,lncRNA NBAT1在乳腺癌组织中表达降低,主要通过减少miR-3664-5p的吸附,进而抑制Caspase 9的表达而促进了乳腺癌细胞的增殖。lncRNA NBAT1作为与乳腺癌密切相关的新分子,有可能成为乳腺癌治疗的潜在靶点。

