CD200与CD4+CD25+CD127lowTreg在强直性脊柱炎中的意义①
宋 琛 孙亚洲 李 强 宋旭恒 冯 龙 王志银 张晨光
(新乡医学院第一附属医院血液学实验室,卫辉 453100)
强直性脊柱炎(ankylosing spondylitis,AS)是一种慢性的自身免疫性疾病,主要影响脊柱、骶髂关节及踝关节等,可产生多种并发症状[1]。AS的发病与遗传、自身免疫、感染、外源性损伤等因素较为密切。国内外已有研究发现[2],在疾病进展过程中,AS患者T淋巴细胞亚群数量和活性出现失衡,调节性T细胞(regulatory T-cell,Treg)主要通过抑制T淋巴细胞的增殖来调节机体的免疫抑制功能,介导机体自身免疫损伤的发生。Ox-2膜糖蛋白,也称CD200,是由CD200基因编码的糖蛋白,具有免疫抑制功能,近年来逐渐被发现且应用于临床及基础研究。相关研究表明,CD200参与了多种风湿性疾病的发病机制,并被用来作为风湿性疾病的独立预测因子[3,4]。CD200在肿瘤免疫治疗方面的研究也逐渐深入,并取得了一定的进展[5,6]。目前有关CD200在AS中的应用及其影响机体免疫应答的认识还十分有限。IL-6主要由内皮细胞、单核细胞产生,参与机体的炎症反应和免疫应答[7]。血清淀粉样蛋白A(serum amyloid A protein,SAA)作为一项指示炎症的检测指标,在AS炎症处于急性期时,SAA可迅速升高[8]。因此,探讨CD200与Treg以及IL-6、SAA等炎症指标在AS中的意义具有一定的临床价值。
1 资料与方法
1.1资料
1.1.1一般资料 选择2018年2月至2019年2月在新乡医学院第一附属医院诊治的74例AS患者为观察组,其中男50例,女24例,年龄(33.28±11.91)岁。入选的所有患者均根据2010年中华医学会风湿病学分会制定的《强直性脊柱炎诊断及治疗指南》[9]的诊断标准进行筛查,并且在样本收集前的三个月内没有使用免疫抑制疗法。根据2009年国际脊柱关节炎协会(ASAS)指定的AS疾病活动度(ASDAS)对患者进行评分,超过或等于1.3分为活动性的AS患者,低于1.3分为稳定性的AS患者[10],其中活动组50例,稳定组24例。不包括入院前半年内接受糖皮质激素治疗的患者;排除合并急性感染及肿瘤患者;排除合并风湿病及其他自身免疫病患者;排除严重的肝肾功能障碍;排除妊娠妇女。选取50例健康志愿者,作为对照组,男30例,女20例,年龄(32.00±11.80)岁。两组研究对象的性别、年龄等差异无统计学意义。
1.1.2标本处理 无菌采集两组外周血5 ml,一管2 ml,EDTA-K2抗凝,4℃保存,流式检测;另一管3 ml,枸橼酸钠促凝,分离血清(3 000 r/min,10 min),保存于-80℃,检测血清CD200、IL-6、SAA的含量。
1.1.3主要试剂和仪器 CD3-ECD、CD3-PE、CD4-PC7、CD4-FITC、CD8-FITC、CD19-ECD、CD25-ECD、CD127-PC5.5及同型对照IgG1-FITC、IgG2a-PE、IgG1-ECD、IgG1-PC5.5、IgG1-PC7均为Beckman产品,CD200-PE为BD产品,人CD200为武汉博士德产品,IL-6试剂盒和上转发光免疫分析仪(型号:UPT-3A-1800)购自北京热景生物公司,血清淀粉样蛋白A试剂盒购自重庆中元生物公司,酶标仪购自美国美谷分子公司(型号:SpectraMax Plus384),流式细胞仪(型号:DxFLEX)、全自动生化仪(型号:AU5800)购自Beckman Coulter。
1.2方法
1.2.1流式细胞术(Flow cytometry,FCM)检测外周血Treg的比例和淋巴亚群中CD200的表达率 取3支12 mm×75 mm流式样品管,标记为1~3,1号为同型对照管,加入IgG1-FITC/IgG2a-PE/IgG1-ECD/IgG1-PC5.5/IgG1-PC7,2、3号为实验管,加入抗体CD8-FITC/CD200PE/CD3-ECD/CD19-PC5.5/CD4-PC7、CD4-FITC/CD3-PE/CD25-ECD/CD127-PC5.5各10 μl,每管加入100 μl抗凝血,在涡旋振荡仪上混匀后,室温避光反应20 min,加入500 μl溶血素,混匀,室温避光反应10 min,1 100 r/min离心10 min后去上清,加入500 μl PBS溶液,混匀,1 100 r/min离心10 min,弃上清,重复洗涤2次,加入500 μl PBS溶液,涡旋振荡后用FCM检测。
1.2.2ELISA检测血清中CD200浓度 按照试剂说明书进行标准品的稀释,进行以下步骤:设空白孔、标准孔、待测样品孔,分别加入样品稀释液、标准品及待测样品,在室温下孵育90 min,弃去液体;每孔加入生物素化抗体,在室温下孵育60 min,洗板3次;每孔加酶结合物,在室温下孵育30 min,洗板3次;每孔加入显色液,在室温下孵育30 min;将终止溶液加入各孔中,用酶标仪在450 nm波长下,测量其光密度(OD值)。
1.2.3上转发光法检测血清中IL-6含量 在检测卡上注明编号,取样本100 μl,加入150 μl样本稀释液,涡旋震荡;取稀释好的样品100 μl,加入加样孔,室温孵育15 min;在分析仪上校参后测量。
1.2.4乳胶增强免疫比浊法检测血清中SAA含量 采用贝克曼全自动生化仪AU5800检测SAA含量。

2 结果
2.1AS活动组患者中存在淋巴细胞亚群紊乱 活动组CD4+T细胞、CD19+B细胞均高于对照组(P<0.05),CD8+T细胞百分率低于对照组(P<0.05),活动组与对照组比较,CD3+T细胞百分率无统计学意义(P>0.05);稳定组淋巴细胞亚群各组分与对照组均无统计学意义(P>0.05)。见图1、表1。
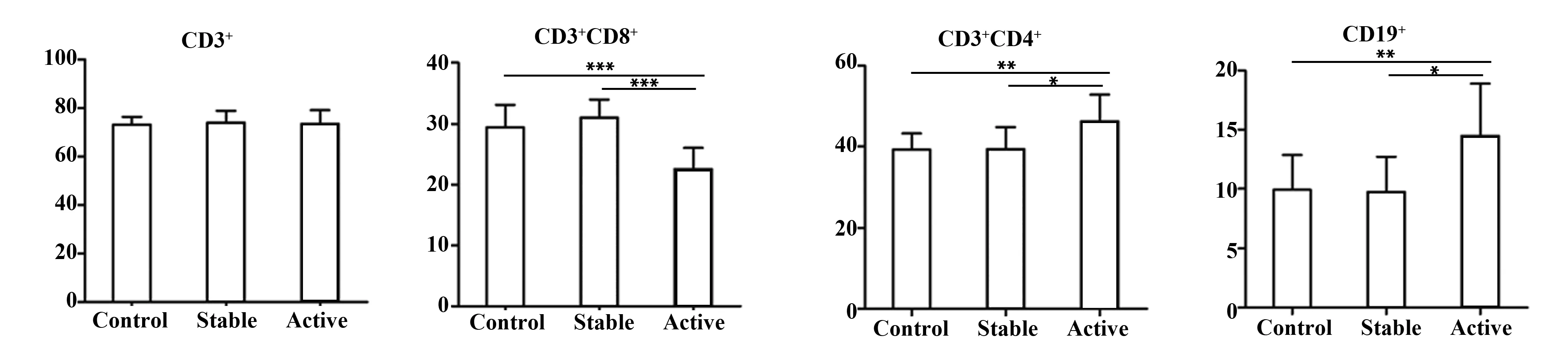
图1 各组淋巴细胞亚群的表达率Fig.1 Expression rate of lymphocyte subsets in each groupNote:*.P<0.05,**.P<0.01,***.P<0.001.

GroupsnCD3+T cellCD3+CD4+T cellCD3+CD8+T cellCD19+B cellControl5073.25±3.1339.23±3.9929.45±3.699.91±2.95Stable2474.00±4.8639.36±5.3931.04±2.969.73±2.98Active5072.39±5.6646.22±6.591)22.58±3.512)14.48±4.411)
Note:1)P<0.01,2)P<0.001,with control.
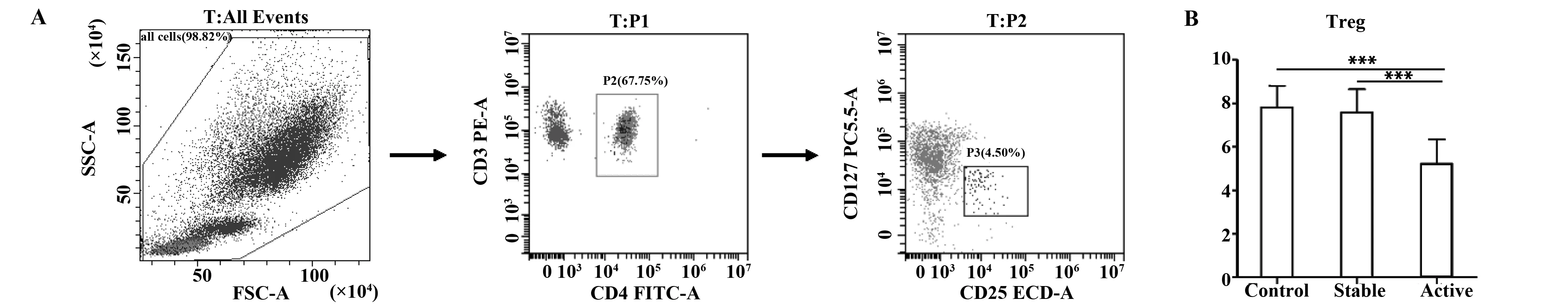
图2 流式细胞术检测CD4+CD25+CD127lowTreg细胞Fig.2 Flow cytometry for detection of CD4+CD25+CD127lowTregNote:A.Flow cytometry pictures;B.The percentage of Tregs in each group.***.P<0.001.
2.2活动组CD4+CD25+CD127lowTreg的百分率显著减低 根据FSC(细胞体积大小)和SSC(细胞内容物)对外周血淋巴细胞圈门,分析CD4+CD25+CD127low占CD3+CD4+T细胞的比例,即为Treg的百分率,见图2A。结果显示,活动组Treg的比例明显低于对照组(P<0.001),而稳定组Treg的百分率与对照组相比无统计学差异(P>0.05)。见图2B、表2。
表2 CD4+CD25+CD127lowTreg细胞增殖情况(%)
Tab.2 Proliferation of CD4+CD25+CD127lowTregs(%)

GroupsnCD4+CD25+CD127lowTregsPControl507.82±1.00-Stable247.58±1.070.360Active505.24±1.11<0.001
图3 淋巴细胞亚群中CD200表达率的流式图Fig.3 Flow pattern of CD200 expression in lymphocyte subsets
图4 各组淋巴细胞亚群中CD200的表达Fig.4 Expression of CD200 in lymphocyte subsets of each groupNote:A.Represents the expression of CD200 in CD3+T cells;B.Represents the expression of CD200 in CD4+T cells;C.Represents the expression of CD200 in CD8+T cells;D.Represents the expression of CD200 in CD19+B cells.**.P<0.01,***.P<0.001.
2.3CD200在T淋巴细胞上的表达下调 与对照组相比,活动组CD3+、CD4+、CD8+T细胞中CD200的表达率显著减低(P<0.001),CD19+B细胞中CD200的表达率无差异;稳定组CD3+、CD4+T细胞上CD200的表达率减低(P<0.01),CD8+T细胞、CD19+B细胞中CD200的表达率无差异。见图3、4、表3。
2.4血清中CD200、IL-6、SAA的含量(pg/ml) 活动组血清CD200的浓度低于对照组(P<0.01),IL-6、SAA的浓度高于对照组(P<0.01、P<0.001);稳定组血清CD200的浓度低于对照组(P<0.05),IL-6的浓度高于对照组(P<0.05),SAA的浓度与对照组没有差异。见表4。
2.5AS活动组CD3+T淋巴细胞中CD200的表达率以及Treg细胞与IL-6、SAA的相关性分析 活动组CD3+T细胞上CD200表达率与Treg正相关(r=0.345,P<0.05),与IL-6负相关(r=-0.352,P<0.05),与SAA不相关;活动组Treg的百分率与IL-6负相关(r=-0.592,P<0.01),与SAA不相关。见表5。
2.6CD200、Treg、IL-6及SAA的诊断效能分析 CD200、Treg、IL-6及SAA的曲线下面积(AUC)分别为0.921、0.751、0.883、0.734。比较CD200与Treg、IL-6、SAA在预测AS炎症活动时的诊断效能得出,CD200的诊断价值优于Treg、SAA(Z值分别为3.596、3.446,P<0.001),但与IL-6比较,差异无统计学意义(Z=1.046,P>0.05),但在预测AS疾病炎症活动时,CD200的敏感度较高,其诊断界值为6.30%时,敏感度为88.5%,特异度为90.9%。见图5、表6。
表3 淋巴细胞亚群中CD200的表达率(%)
Tab.3 Expression rate of CD200 in lymphocyte subsets(%)

GroupsnCD200+/CD3+CD200+/CD4+CD200+/CD8+CD200+/CD19+Control507.29±1.229.49±1.362.46±0.4763.39±6.37Stable245.35±1.301)7.01±1.871)2.32±0.6959.68±5.61Active502.68±0.872)3.89±1.402)1.07±0.572)59.42±5.88
Note:Compared with control,1)P<0.01,2)P<0.001.
表4 各组血清中CD200、IL-6、SAA的浓度(pg/ml)
Tab.4 Concentrations of CD200,IL-6 and SAA in serum of each group(pg/ml)

GroupsnCD200IL-6SAAControl5088.86±26.414.04±1.695.32±2.52Stable2471.23±23.751)5.84±1.061)5.05±2.32Active5068.00±25.172)12.14±2.912)87.83±83.783)
Note:Compared with control,1)P<0.05,2)P<0.01,3)P<0.001.
表5 AS活动组CD3+T淋巴细胞中CD200的表达率和Treg与IL-6、SAA的相关性
Tab.5 Correlation between expression of CD200 in CD3+T cells and Treg and IL-6,SAA in active group
Inflammatory factorCD200rPTregrPIL-6-0.3521)0.028-0.5922)0.000SAA-0.1090.509-0.1120.497
Note:1)P<0.05,2)P<0.001.
表6 ROC曲线分析数据
Tab.6 Analysis data of ROC curves
ItemAUC95%CIStandard errorCut offSensitivity(%)Specificity(%)CD2000.9210.861-0.9810.0266.30%88.590.9Treg0.7510.636-0.8660.0496.87%67.989.9IL-60.8830.792-0.9730.0366.44 pg/ml69.290.9SAA0.7340.606-0.8620.0526.05 pg/ml80.854.5
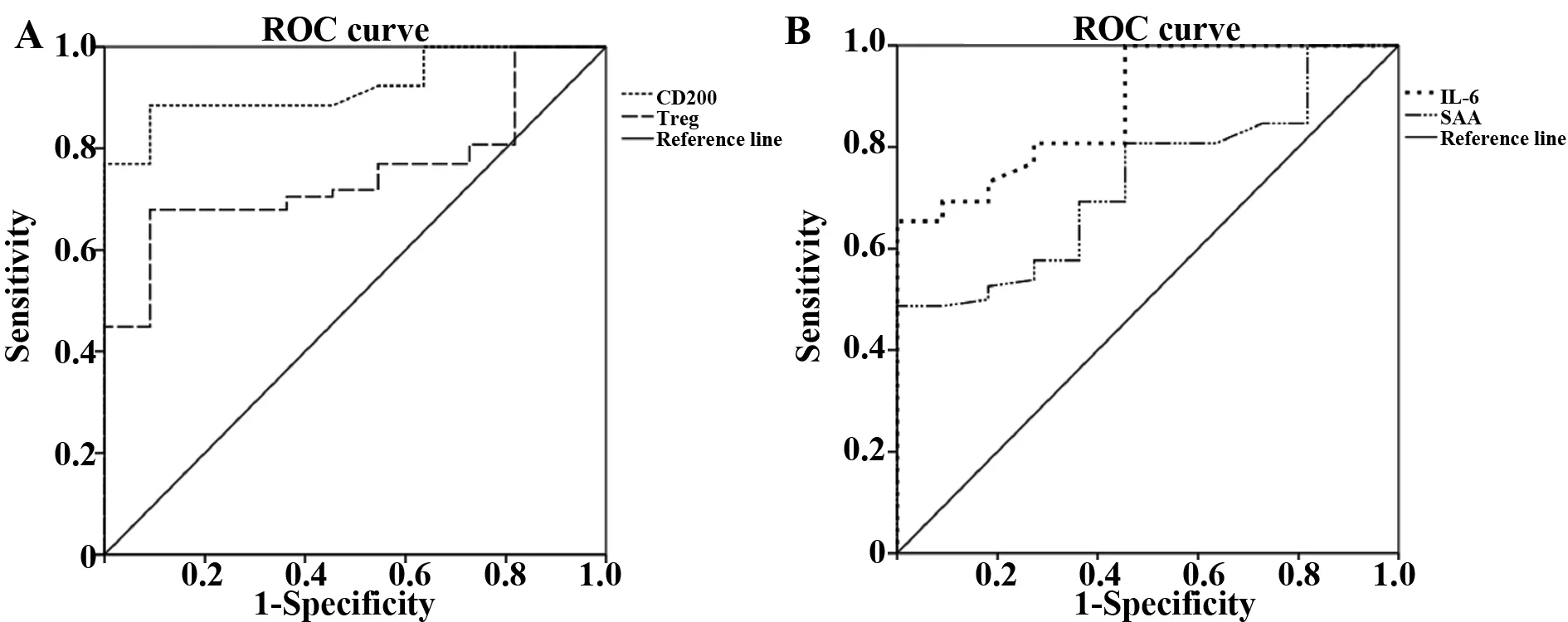
图5 ROC曲线分析图Fig.5 Analysis chart of ROC curves
3 讨论
作为一种慢性自身免疫性炎性疾病,AS主要发生在16~40岁的男性中,其发病较为隐匿,随着病情的发展,患者逐渐由最初的腰背及外周关节的疼痛,进展为腰椎活动受限,甚至脊柱的畸形及强直[11]。
尽管AS的发病机制尚不完全清楚,但是AS患者机体的免疫功能受到影响较为明显,免疫系统的调节与拮抗作用在AS疾病中起重要作用。我们对体内抗原特异性Treg反应的理解大部分是由于T细胞受体(TCR)转基因Treg的生成。这使得在活体内跟踪具有特定特异性的Treg,有助于分析遇到同源抗原如何影响Treg的稳态和功能[12]。Treg被TCR介导的信号通路激活后,会抑制T淋巴细胞增殖和特异性免疫调节,同时分泌抑制性细胞因子,抑制效应细胞的功能[13]。Treg细胞的表面标志为CD4+CD25+Foxp3+,由于Foxp3表达于细胞内,运用FCM技术检测时需要破膜,较易引起抗体效价的减弱及细胞碎片的产生。研究发现Foxp3的高表达与CD127的低表达之间相关性良好。由于操作比较简单,因此选择CD127来检测Treg细胞[14]。研究发现Treg细胞与各种炎症疾病、风湿性疾病和肿瘤的发病机理密切相关[15]。针对Treg细胞比例和恢复Treg细胞功能治疗风湿性疾病的研究已深入开展,并取得了进展[16,17],如SLE患者注射小剂量rhIL-2后,机体Treg细胞的比例出现了不同程度的升高;间充质干细胞经过瘦素预处理,可破坏Treg的上调作用,使SLE患者异常升高的瘦素减低,患者Treg活性及数量得以恢复[18,19]。
CD200是免疫球蛋白超家族的成员,也是在B细胞、活化的T细胞和滤泡树突细胞等表面表达的Ⅰ型跨膜糖蛋白[20]。CD200与其受体(CD200R)相互作用,主要用传递免疫抑制信号的方式来维持免疫稳态。CD200主要通过TCR与MHC分子复合物结合或与抗TCRmAb结合两种方式来介导共刺激信号,可以促进T细胞的增殖和活化。Coles等[21]指出,CD200与急性髓性白血病的T细胞免疫抑制有关,CD200与其受体的结合可以提升Treg的数量和活性,使机体免疫功能恢复正常。Xu等[22]发现,CD200的表达下调可以导致子痫前期胎盘滋养层中Th1细胞因子的增加与Th2细胞因子的减少。Song等[23]指出,类风湿关节炎患者单核细胞巨噬细胞CD200R表达降低与Th17/Treg失衡和疾病活动有一定的关联。
本研究在检测外周血(CD3+、CD4+、CD8+)T细胞和CD19+B淋巴细胞中CD200的表达发现,与对照组相比,活动组外周血(CD3+、CD4+、CD8+)T细胞中CD200的表达明显减少,血清CD200浓度降低,而CD200在CD19+B细胞上的表达没有显著差异。这表明CD200的异常表达在AS患者免疫紊乱中有重要作用,并且,CD200在T细胞上异常表达,而在B细胞上的表达与对照组没有差异,可能是因为CD200主要在B细胞和活化的T细胞中表达,而CD200R在T细胞上表达较多,在B细胞上表达很少,这种CD200与CD200R分布的差异,使得AS患者B淋巴细胞中CD200的表达无明显改变。AS患者活动期外周血Treg的比例减低,这说明与许多自身免疫性疾病一样,Treg百分率的减低在AS的发病过程中发挥着相关作用,这与有关报道一致[24]。IL-6、SAA等炎症指标在活动期明显升高,而在稳定期IL-6轻度升高,SAA无明显变化,指示IL-6、SAA可以反映AS疾病活动。CD3+T细胞中CD200的百分率与Treg正相关,与IL-6负相关,我们推测,AS患者CD200的表达下调,影响了Th1/Th2细胞因子的产生,干预T细胞的生成、分化,抑制Treg增殖,增加了AS疾病的易感性及感染概率,造成机体疾病活动度增加,从而参与AS患者体内免疫功能调节。AS患者IL-6的含量升高,促进初始CD4+T细胞转化为Treg的能力降低,抗原提呈能力增强,激活T细胞,减少对T细胞的抑制功能,淋巴细胞亚群出现紊乱。因此,提示AS患者CD200的异常下调可能影响T淋巴细胞的分化,同时抑制Treg细胞的生成,对AS的易感性增加。同时,研究发现,CD200的诊断价值优于Treg、SAA,但与IL-6的辅助诊断价值相当,故CD200在辅助AS的诊断及评估AS患者机体免疫功能等方面具有一定的潜力。
综上所述,AS活动期CD3+T淋巴细胞中CD200的表达水平及血清中CD200的浓度均下调,其可能影响Treg的生成及活化,并引起机体炎症的发生。研究提示AS患者CD200和Treg的表达异常可能参与AS疾病的发生及发展,两者在辅助AS疾病的诊断及免疫功能的评估等方面具有一定的参考价值。

