高脂饮食与1,2-二甲基肼对大鼠肠道的作用及抗氧化机制研究
杜艳平,区俊文,习文韬,金昭延,杨鹏程
广州中医药大学祈福医院营养科,广东 广州 510000
1,2-二甲基肼(DMH)是引起DNA中鸟嘌呤发生甲基化并诱发突变的烷化剂,是一种具有较好器官选择性的常用化学诱癌剂,可被用于诱导大鼠结肠癌。高脂饮食是常见的膳食模式,有Meta分析显示,尚无充份证据证明该膳食模式与结肠癌发生有明显的相关性[1]。但有研究发现应用DMH诱发大鼠结肠癌发生的过程中,高脂饮食可能介导炎症进展和细胞增殖,从而影响结肠癌的形成[2]。但高脂饮食与DMH在结肠癌发生早期,对肠道的作用及机制研究尚未见报道。
肠道正常的生理代谢需要完整的肠道结构,并且肠道的氧化还原系统应处于平衡状态。有研究发现,当肠道的氧化还原状态被打破,会产生大量的活性氧基团(ROS),对肠道产生损害,破坏肠道黏膜细胞和上皮间紧密连接[3]。本研究应用DMH作用于SD(Sprague-Dawley)大鼠,并同步给予高脂饮食,观察在结肠癌发生早期,DMH和高脂饮食联合对肠道的作用及肠道氧化还原状态的改变,探讨可能的作用机制,为结肠癌的预防提供依据。
1 材料与方法
1.1 实验动物及试剂 30只体质量180~200 g的健康雄性SPF级SD大鼠,购自广东省医学动物实验中心。DMH购自Sigma公司,总抗氧化能力(T-AOC)、丙二醛(MDA)、超氧化物歧化酶(SOD)、一氧化氮(NO)、总蛋白定量(考马斯亮蓝法)等检测试剂盒均购自南京建成生物工程研究所,髓过氧化物酶(MPO)试剂盒购自厦门慧嘉生物。
1.2 动物分组及处理 普通饲料喂养大鼠1周适应环境后,按体质量进行编号后按照随机分组的方法分为对照组、DMH组、DMH+高脂组,每组10只。实验室温度保持在(20±4)℃,湿度60%~70%。代谢笼饲养大鼠,自由摄食饮水,对照组和DMH组给予普通饲料,DMH+高脂组给予高脂肪饲料,饲料均购自广东省医学实验动物中心(普通饲料:能量3.85 kcal/g,其中脂肪供能比10%,碳水化合物70%,蛋白20%;高脂饲料:能量4.73 kcal/g,其中脂肪供能比45%,碳水化合物35%,蛋白20%)。对照组颈部皮下注射灭菌生理盐水,DMH组和DMH+高脂组大鼠颈部皮下注射0.4%的DMH溶液(无菌生理盐水配制,NaHCO3调节pH至6.5~7.0,剂量20 mg/kg),隔天1次。
实验第15天,腹腔静脉采血后处死所有大鼠;距回盲部5 cm分别取10 cm回肠和5 cm结肠,生理盐水冲洗干净并用滤纸吸干后称重,计算肠组织湿重(结果以mg/cm表示),-80℃保存备用。
1.3 观察指标 实验期间,观察大鼠皮毛、眼睛、营养状况、活动及粪便性状等,分别于实验前,实验第3、6、9、12、15天称量大鼠体质量。实验第15天,大鼠处死后观察腹腔及肠管变化;分别取1 cm回肠和结肠置于10%福尔马林液中固定及脱水后、常规石蜡包埋切片、HE染色,40及100倍光学显微镜下观察肠道的病理学特征。
1.4 指标测定 取回肠和结肠组织,称重后以1:9的比例加入生理盐水,制备10%的结肠匀浆,参考试剂盒说明检测T-AOC、MDA、SOD、MPO、NO等指标。
1.5 统计学方法 应用SPSS21.0软件进行数据统计学分析,计量资料符合正态分布,以均数±标准差(±s)表示,多组计量资料比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般状况比较 对照组大鼠行动自如,眼睛明亮,毛发有光泽,大便成形。DMH组和DMH+高脂组大鼠活动量少,眼睛无神,毛发光泽稍差,大便稀烂不成形;各组大鼠整个实验过程均无死亡。
实验前各组大鼠体质量比较差异均无统计学意义(P>0.05);从实验第6天开始,DMH组大鼠体质量明显低于对照组和DMH+高脂组,差异均有统计学意义(P<0.05),但正常组和DMH+高脂组之间的体质量比较差异无统计学意义(P<0.05),见图1。
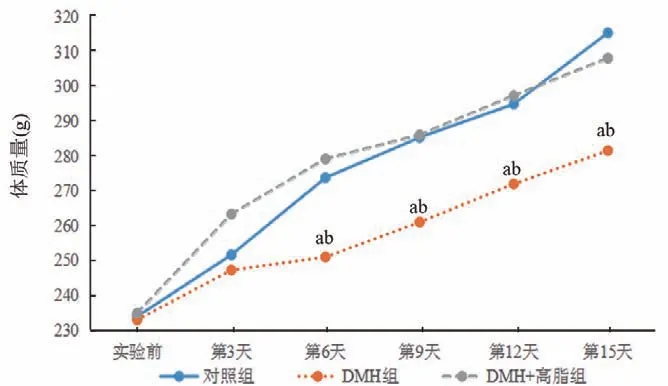
图1不同时间点各组大鼠体质量变化曲线
2.2 各组大鼠肠组织湿重比较 实验第15天,DMH组和DMH+高脂组大鼠回肠和结肠湿重明显低于对照组,差异均有统计学意义(P<0.05),但DMH组和DMH+高脂组大鼠间比较差异无统计学意义(P>0.05),见表1。
表1 各组大鼠肠组织湿重比较s,mg/cm)
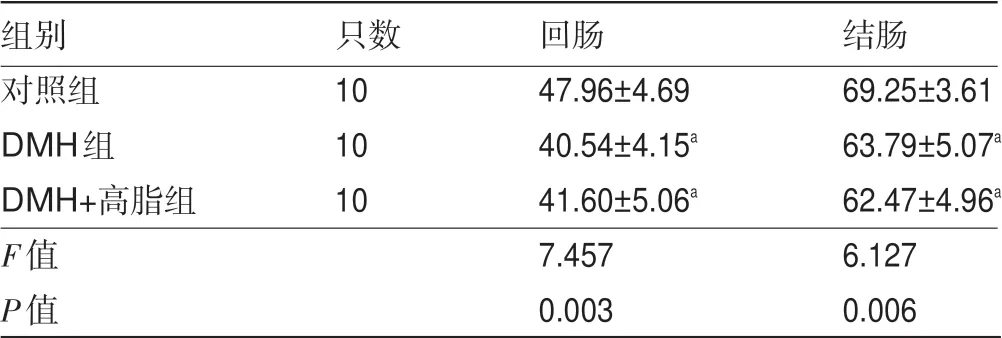
表1 各组大鼠肠组织湿重比较s,mg/cm)
注:与对照组比较,aP<0.05。
对照组DMH组DMH+高脂组F值P值images/BZ_9_207_1608_1203_1672.png10 10 10 47.96±4.69 40.54±4.15a 41.60±5.06a 7.457 0.003 69.25±3.61 63.79±5.07a 62.47±4.96a 6.127 0.006
2.3 各组大鼠肠组织的病理变化 回肠:对照组回肠黏膜未见异常改变,但DMH组、DMH+高脂组的大鼠回肠黏膜绒毛坏死脱落,肠黏膜上皮细胞坏死(图2)。结肠:对照组结肠黏膜未见异常改变,但DMH组、DMH+高脂组大鼠结肠均可见不同程度炎症细胞浸润及上皮坏死(图3)。
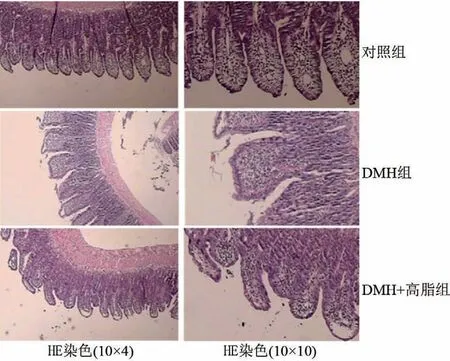
图2 各组大鼠回肠黏膜的病理变化
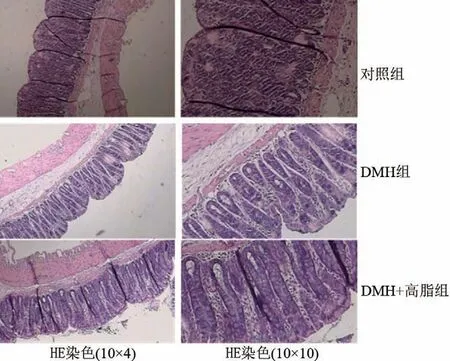
图3各组大鼠结肠黏膜的病理变化
2.4 各组大鼠回肠及结肠的匀浆脂质过氧化水平比较 给予DMH的两个组大鼠回肠匀浆的T-AOC、MDA、MPO和NO明显高于对照组,差异均具有统计学意义(P<0.05),其中DMH+高脂组的T-AOC、MDA高于DMH组,差异均具有统计学意义(P<0.05)。给予DMH的两组大鼠结肠匀浆T-AOC、MDA、MPO和NO明显高于对照组,而SOD明显低于对照组,差异均具有统计学意义(P<0.05),其中DMH+高脂组的SOD水平明显低于DMH组,差异具有统计学意义(P<0.05),见表2。
表2 各组大鼠不同指标的含量的比较

表2 各组大鼠不同指标的含量的比较
注:与对照比较,aP<0.05;与DMH组比较,bP<0.05。
?
3 讨论
物质代谢过程中,在肠道有氧的情况下不可避免产生自由基。当DMH作用于肠道时,自由基产生过多,不能及时清除,会导致自由基在肠道的聚集,当达到一定水平后,可对肠道细胞进行攻击,导致细胞膜的完整性遭到破坏,肠道细胞受损,影响吸收功能。本研究结果发现,DMH组大鼠的体质量增长缓慢,回肠和结肠湿重均低于对照组,提示DMH损伤肠道功能,从而影响营养物质的吸收。但DMH+高脂组大鼠由于摄入脂肪和总能量较高,体质量增长相对较快,从第6天开始,体质量均高于DMH组大鼠。
研究发现,应用DMH诱导大鼠结肠癌发生过程中,结肠癌的发生与肠道脂质过氧化所致的肠道上皮损伤有关[4]。而我们既往的研究也发现,DMH导致大鼠结肠组织炎症细胞浸润,氧化还原系统失衡,MDA、T-AOC水平升高[5]。本研究结果也进一步验证了这一结果,给予DMH的两个组均可见大鼠回肠和结肠损伤,回肠和结肠中T-AOC、MDA、MPO和NO均高于对照组,而结肠中SOD低于对照组,提示肠道氧化还原系统的失衡参与结肠癌早期阶段。T-AOC可测量大鼠肠道中各种抗氧化物质和抗氧化酶等构成的总抗氧化水平,肠道的脂质过氧化产物生成过多,可导致T-AOC水平下降,但本研究中,DMH却导致大鼠肠道组织中T-AOC升高,可能是由于在肠道受损早期代偿性增高,具体还有待进一步研究。
膳食模式与结肠癌的关系仍缺乏明确证据,但有动物实验发现,高脂饮食可增加结肠癌的发病风险[6]。同时,还有研究发现,长期摄入高脂饮食可导致小鼠肠组织T-AOC和SOD明显降低,而ROS和MDA明显升高,影响肠道消化酶活性,促进DMH诱导大鼠结肠癌的生长[7]。本研究也发现,与DMH组相比,DMH+高脂组大鼠的回肠MDA升高,提示高脂饮食加重了大鼠小肠所致的氧化应激状态,而小肠代偿性升高T-AOC水平以减少对肠道的损伤。
氧自由基攻击肠道及肠道黏膜,可导致脂质过氧化发生,诱发肠道损伤,引起MDA水平升高。CZYRKO等[8]发现随着肠道组织受损程度的加重,MDA浓度也随之升高,推测MDA可反映肠道自由基产生和肠道损伤情况。本研究发现,给予DMH的两个组大鼠回肠和结肠中MDA含量均升高,其中DMH+高脂组大鼠的回肠组织中MDA含量高于DMH组。提示DMH引起脂质过氧化产物增多,从而导致肠道受损,而高脂饮食则加重这一过程。
肠道拥有对抗自由基的防御系统,包括酶类抗氧化剂,其中较为重要的是SOD,能够加速超氧阴离子生成O2和H2O2,后者在最终可生成无毒性的H2O分子,SOD活性水平能够反映ROS的清除能力。本研究结果显示,给予DMH的两个组的结肠组织中含量降低,而DMH+高脂组SOD的含量低于DMH组。这提示SOD在结肠组织中起着重要的抗脂质过氧化的作用,肠道消耗过多SOD从而导致其含量下降,也进一步证实了高脂饮食可加重肠道功能损伤。
含铁溶酶体MPO在特定条件下,能够催化H2O2和Cl-进行反应转为次氯酸,强氧化性可导致肠道氧化应激和组织损伤。而NO是典型的带一未成对电子的自由基,肠组织内NO浓度过高的时候,能够产生细胞毒作用。本研究显示给予DMH的两个组大鼠回肠和结肠组织中,MPO和NO均升高,但这两个组之间的差异无统计学意义,进一步说明DMH可导致肠道自由基产生增多,对肠道造成一定损伤。
综上所述,DMH导致大鼠回肠和结肠损伤,引起肠道脂质过氧化产物生成增加,破坏肠道的抗氧化酶系统,高脂饮食可加重肠道氧化损伤,在诱发大鼠结肠癌的过程中起重要作用。

