马铃薯产量组分的基因型与环境互作及稳定性
叶夕苗 程 鑫 安聪聪 袁剑龙 余 斌 文国宏 李高峰 程李香 王玉萍 张 峰,*
马铃薯产量组分的基因型与环境互作及稳定性
叶夕苗1程 鑫1安聪聪1袁剑龙1余 斌1文国宏2李高峰2程李香1王玉萍1张 峰1,*
1甘肃农业大学 / 甘肃省干旱生境作物学国家重点实验室培育基地 / 甘肃省遗传改良与种质创新重点实验室, 甘肃兰州 730070;2甘肃省农业科学院 / 马铃薯研究所, 甘肃兰州 730070
本研究主要探究基因型和基因型与环境互作(genotype + genotypes and environment interactions, GGE)双标图在马铃薯育种中的应用。综合评价马铃薯品系产量性状在不同环境中的丰产性、稳定性和适应性, 筛选出适应不同生态环境的产量性状优良品系。同时评价各试点的区分力和代表性, 为试点的选择提供依据。2015年和2016年在甘肃安定区鲁家沟镇、安定区内官镇、渭源县五竹镇3个试点种植国际马铃薯中心引进的101份高代品系和对照青薯9号。收获后记录小区产量、小区大薯产量、小区小薯产量、单株产量、单株大薯产量、单株小薯产量、单株结薯数、单株大薯数、单株小薯数; 采用联合方差和GGE双标图对产量性状进行基因型与环境互作分析。方差分析表明, 除小区小薯产量在基因型与环境互作效应中无显著差异外, 其他产量组分在基因型效应、环境效应和互作效应中均呈现极显著差异(<0.01)。小区产量、小区大薯产量、小区小薯产量、单株产量、单株大薯产量、单株结薯数环境效应平方和占总方差平方和最大; 单株小薯产量、单株大薯数和单株小薯数的基因型与环境互作效应平方和占总方差平方和最大。GGE分析结果表明, 适应性最强的品系在鲁家沟试点是G86; 在五竹镇试点是G65; 在内官镇试点是G86。参试品系中丰产品系有G86、G116、G124; 稳产品系有G124、G125、G10; 高产稳产品系有G86、G116、G124、青薯9号。单株大薯数高的品系有G45、G86、G67, 稳定性好的品系有G67、G116、G51, 对照青薯9号的单株大薯产量不稳定。综合鉴别力和代表性的强弱, 依次为鲁家沟镇2016年、鲁家沟镇2015年、五竹镇2015年、五竹镇2016年、内官镇2015年、内官镇2016年。GGE模型能够直观地展现多年多点品系试验结果, 并客观评价参试品系的丰产性、稳定性和适应性, 同时可以对试点的代表性和区分力进行评价。以GGE模型综合评价, 高产稳产品系有G116、G124、G125、G122、青薯9号; 高产不稳定的品系有G86、G10、G121、G106、G107、G72。最理想的生态区试点是鲁家沟镇, 对品种的鉴别力最强的试点是五竹镇。
产量组分; GGE双标图; 多年多点; 试点评价
马铃薯是主要的宜粮宜菜作物。为了选育出多适和多用途类型的品种, 需要对各类种质资源和选育出的品系进行产量、抗性、品质等方面的系统评价, 并获得在不同生态区的适应性、丰产性和稳定性的基础数据, 综合评价和筛选出产量性状优良的品系[1-2]。同时评价各试点的区分力和代表性, 为引进资源和品系筛选的理想试点提供选择依据。不同的基因型在不同环境会表现出性状差异, 这些差异是由基因型、环境以及基因型与环境互作效应共同作用的结果[3]。前期的研究表明, 作物多数性状都会表现出不同环境表型差异的互作现象[4-7]。对于产量性状稳定性, 早期的研究方法是平均产量的变异系数说明基因型的稳定性, 这种方法只能说明基因型效应的差异, 不能说明环境效应以及基因型与环境互作效应。利用线性回归对品种的稳定性研究也不能体现出品种对环境的适应性特点。应用方差分析评价品种的适应性不能分析环境效应和互作效应的关系[8-11]。将互作效应分解为基因型分量和环境分量的AMMI模型, 虽然可以用双标图直观展现基因型与环境互作关系。但AMMI模型只考虑互作效应, 没有将互作效应和基因型主效相结合[12]。基因型(G)和基因型与环境互作(GE)联合效应的GGE模型综合考虑G和GE效应, 可以同时对基因型和环境评价[13]。前期GGE模型已经在水稻、小麦、玉米等作物的产量、抗性、品质的基因型、基因型和环境互作中进行了研究[14-18]。对于马铃薯这样的同源四倍体作物, 大量农艺性状由多个等位位点决定, 基因主效性不显著的作物中, 基于基因型和基因型与环境互作联合效应的研究还没有广泛开展和验证[19-21]。本研究进行2年3点试验, 拟通过GGE模型分析101份引进种质资源的高代品系产量及产量组分性状, 阐述基因型与环境互作效应对评价马铃薯块茎产量和产量组分的实际效果, 综合产量组分筛选出优良的品系, 同时评价GGE模型在区分试验点的代表性和鉴别力方面的作用。
1 材料与方法
1.1 试验材料
引自国际马铃薯中心的101份高代品系(表1), 其高代品系来源于5类不同群体, 包括Population A、B3C1、LBHT1 (晚熟、抗晚疫病、高淀粉, 适宜油炸加工、耐热)、Intermediate LT-LB (中早熟、菜用、抗晚疫病)和LTVR (耐热、抗病毒病、菜用、具低海拔高温适应性)(https://cipotato.org/catalogue),
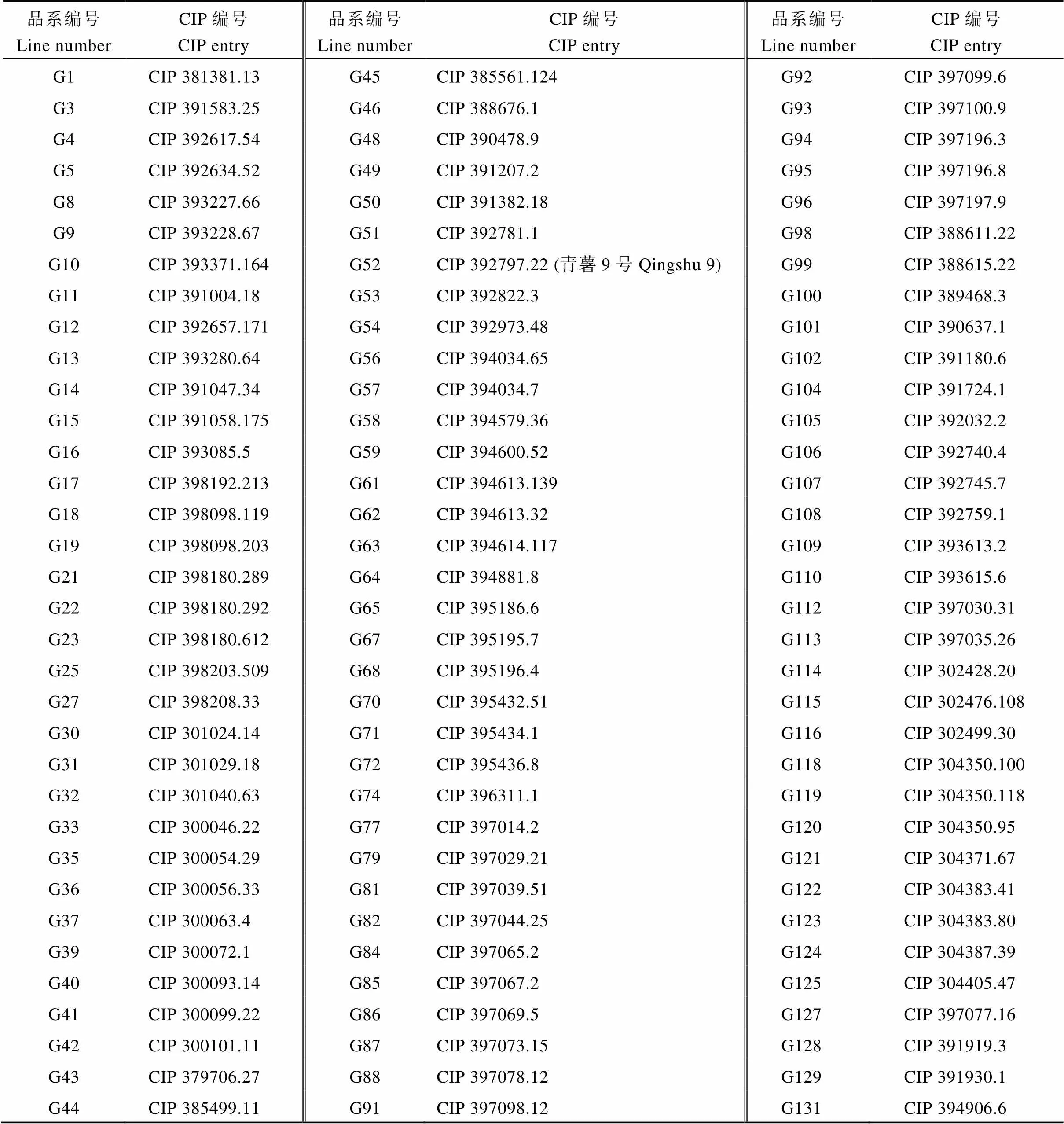
表1 102份引进国际马铃薯中心高代品系
其中G52 (CIP 392797.22)为试验对照品种青薯9号。
1.2 试验设计
2015年和2016年分别在渭源县五竹镇、安定区内官镇和安定区鲁家沟镇3个试点(表2)采用随机区组设计, 播种50 g切块种薯, 设每个品种(系) 3个小区, 单垄双行种植, 行距40 cm, 株距25 cm, 小区面积为1.1 m × 2.5 m。所有试验不施肥, 无灌溉, 苗期进行覆土固苗(10~15 cm覆土深度), 其余栽培和田间管理措施均按统一方法, 保持各地块一致。每年4月25日至30日播种, 9月15日至25日收获。收获期测定产量和产量组分。参照《马铃薯试验研究方法》[22]统计小区产量、小区大薯产量、小区小薯产量; 单株产量、单株大薯产量、单株小薯产量; 单株结薯数、单株大薯数、单株小薯数(块茎大小以75 g为界限划分)。
1.3 试验点平均降水和气温状况
2015—2016年五竹镇年平均降水量437.6 mm, 年平均气温6.4℃, 内官镇年平均降水量529 mm, 年平均气温9.9℃, 鲁家沟镇年平均降水量253 mm, 年平均气温9.1℃。3个试验点的平均降水和气温状况(表2)均高于历史平均值, 其中内官镇的年平均降水量比历史平均值增加了35%。产量组分分析中, 环境为试验地点和年份的组合。

表2 试点环境
1.4 数据分析
采用Microsoft Excel 2016和SPSS 19.0软件统计分析数据。采用GGEbiplot 8.0软件处理基因型和环境互作模型数据。
1.5 稳定性分析
GGE模型被称为环境中心化的主成分分析, 在原始数据中减去环境的平均值后将基因型在互作效应中进行奇异值分解[23]。

其中,Y是基因型在环境中的第个重复的产量或者其他性状值。是总体平均值,β是环境的均值。λ是第个主成分的奇异值,γ是基因型在第个特征向量得分,δ是环境在第个特征向量得分,ρ基因型在环境的残差,ε是总体误差。
GGE双标图是基于前2个主成分PC1和PC2, 因此公式(1)可转化如下:

其中,1是第1个主成分的奇异值,γ1是基因型在第1个特征向量得分。δ1是环境在第1个特征向量得分, 以此类推。
2 结果与分析
2.1 方差分析
高代品系产量性状及产量组分在基因型、环境和基因型×环境互作效应均极显著, 而小区小薯产量在基因型与环境互作方面差异不显著(表3)。产量性状组分中单株小薯产量、单株小薯数的互作效应平方和占总方差平方和比例分别为39.1%和35.0%, 基因型效应占比分别为18.9%、19.6%, 环境效应占比分别为2.3%和2.1%; 小区产量、小区大薯产量、小区小薯产量、单株产量、单株大薯产量和单株结薯数环境效应的平方和占比分别为34.0%、28.0%、18.2%、25.9%、24.7%和32.8%, 互作效应占比分别为33.4%、27.6%、22.8%、12.1%、22.8%、22.90%和26.7%, 基因型效应占比分别为17.2%、3.4%、8.6%、15.5%、16.0%和10.6%。单株大薯数互作效应平方和占比为33.9%, 环境效应占比19.5%, 基因型效应占比为3.7%。

表3 马铃薯产量性状方差分析

(续表3)
G: genotype; E: environment; G × E: genotype × environment.
2.2 产量性状适应性GGE双标图分析
GGE双标图的多边形图(which-won-where)根据基因型-环境的互作效应对试点分组(图1-A~F), 多边形由同一方向上距离原点最远的基因型连接而成, 所有基因型都包括在内。通过从原点到多边形各边垂线将双标图分成若干扇区, 试点落在扇区中不同区域。GGE多边形图中基因型小区产量、小区大薯产量、小区小薯产量、单株产量、单株大薯产量和单株小薯产量G+GE占比分别为74.9%、77.7%、65.4%、69.8%、70.1%和68.0% (图1-A~F)。
试点所在区域中, “角顶”基因型是产量最高的基因型。小区产量GGE双标图中, G86、G27、G43、G53、G41、G109、G1、G65连接成多边形, 8条射线将多边形分为2个扇区, 第一个扇区位于射线1和2之间, 试点内官镇和鲁家沟镇落在扇区1内, G86产量最高; 第二个扇区位于射线1和8之间, 试点五竹镇落在扇区2内, G65产量最高。无试点的扇区中, “角顶”基因型在所有试点中表现不佳。没有试点落于以基因型G43、G53、G41、G109、G1为角顶的区内, 这5个基因型在所有试点中小区产量表现不佳(图1-A)。“角顶”基因型不同, 连接成的多边形不同, 产量相关性状双标图被分成不同的扇区, 相同试点中优势基因型不同(图1-A~F)。小区大薯产量GGE双标图中, G86、G79、G53、G41、G1、G16连接成的多边形分为2个扇区, 试点内官镇和鲁家沟镇中G86产量最高, 试点五竹镇中G16产量最高(图1-B); 小区小薯产量GGE双标图中G14、G25、G70、G43、G12、G109、G10连接成的多边形分为2个扇区, 试点内官镇和鲁家沟镇中G70产量最高, 试点五竹镇中G10的产量最高(图1-C); 单株产量GGE双标图中G86、G113、青薯9号、G67、G68、G101、G22、G25、G109、G116连接成的多边形分为3个扇区, 试点鲁家沟镇中G113产量最高, 试点五竹镇中G86的产量最高, 试点内官镇2016年青薯9号产量最高(图1-D); 单株大薯产量GGE双标图中G113、G67、G68、G114、G25、G109、G116连接成的多边形分为3个扇区, 试点鲁家沟镇和内官镇2015年中G113产量最高, 试点2016年内官镇中G67产量最高, 鲁家沟镇和内官镇2015、2016年中青薯9号产量均在多边形边线上, 属于2个区域的高产品种, 试点五竹镇中G116产量最高(图1-E); 单株小薯产量GGE双标图中G11、G44、G36、G99、G54、G10、G14连接成的多边形分为3个扇区, 试点鲁家沟镇中G11产量最高, 试点内官镇中G36产量最高, 试点五竹镇中G10产量最高(图1-F)。

图1 产量性状适应性GGE分析
A: 小区产量; B: 小区大薯产量; C: 小区小薯产量; D: 单株产量; E: 单株大薯产量; F: 单株小薯产量。
A: the yield of plot; B: the plot yield of large-sized tuber; C: the plot yield of small-sized tuber; D: the yield per plant; E: the yield of large-sized tubers per plant; F: the yield of small-sized tubers per plant.
2.3 产量丰产性和稳定性GGE双标图分析
理想基因型应具有最高的产量均值和最高的稳定性。产量丰产性和稳定性GGE双标图(Mean vs. stability view)呈现的是基因型的高产性与稳定性。单向箭头从原点指向平均环境作为平均环境轴(average environment axis, AEA), 箭头所指方向代表较高的产量平均值。垂直于AEA轴的双向箭头的直线为纵轴, 作为平均环境坐标(average environment coordination, AEC), 2个箭头指向较不稳定产量平均值, 越接近于AEA轴, 基因型稳定性越好, GE效应越小(图2-A~F)。
小区产量GGE双标图中, 各试点中平均产量依次为G86、G124、G116等, G131平均产量最低; 各试点中产量稳定性依次以G124、G82、G64等最高, G65稳定性最差; 各试点中高产不稳定的基因型有G86、G94、G27等; 各试点中低产稳定的基因型有G64、G82、G39等; 各试点中高产稳定基因型有G124、G125、G122 (图2-A)。小区大薯产量GGE双标图中, 各试点中平均产量依次为G86、G125、G122等, G41平均产量最低; 各试点中产量稳定性依次为G57、G64、G58等; 各试点中高产不稳定的基因型有G86、G85、G65等; 各试点中低产稳定的基因型有G64、G44、G58等; 各试点中高产稳定的基因型有G125、G124、G121 (图2-B)。小区小薯产量GGE双标图中, 各试点中平均产量依次为G25、G116、G14等; 各试点中产量稳定性依次为G62、G120、G123等; 各试点中高产不稳定的基因型有G14、G74、G70等; 各试点中低产稳定的基因型有G17、G62、G22等; 各试点中高产稳定的基因型有G123、G124、G91 (图2-C)。青薯9号在小区产量、小区大薯产量和小区小薯产量上均呈现较高的稳定性。
单株产量GGE双标图中, 各试点中平均产量依次为G113、G86、G108等; 各试点中产量稳定性依次为G99、G102、G17等; 各试点中高产不稳定的基因型有G86、G108、G116等; 各试点中低产稳定的基因型有G12、G98、G49等; 各试点中高产稳定的基因型有G113、G45、G99 (图2-D)。单株大薯产量GGE双标图中, 各试点中平均产量依次为G113、G86、G108等; 各试点中产量稳定性依次为G51、G102、G1等; 各试点中高产不稳定的基因型有G125、G116, 青薯9号在单株大薯产量中同样呈现出高产不稳定; 各试点中低产稳定的基因型有G98、G37、G44等; 各试点中高产稳定的基因型有G45、G87、G96 (图2-E)。单株小薯产量GGE双标图中, 各试点中平均产量依次为G11、G44、G128等; 各试点中产量稳定性依次为G58、G32、G87等; 各试点中高产不稳定的基因型有G44、G51、G14等; 各试点中低产稳定的基因型有G12、67、G108等; 各试点中高产稳定的基因型有G25、G98、G85 (图2-F)。
2.4 试点鉴别力和代表性GGE双标图分析
试点评价GGE双标图中接近原点的小圆圈代表平均环境, 通过原点和平均环境的单向直线所指同心圆的中心代表理想试点。双标图中的同心圆有助于判断平均环境到AEA、AEC和双标图原点的距离。理想试点应该是有鉴别力和代表性的。理想试点是所有试点中向量最长, 且具有绝对代表性的虚拟试点。试点向量越长, 对基因型鉴别力越强; 试点与AEA的夹角越小, 对理想环境代表性越强。2个试点向量间夹角的余弦值与它们之间的遗传相关系数近似, 夹角小于90度表示正相关, 对品种排序相似, 大于90度表示负相关, 对品种排序相反, 等于90度, 两试点不相关。

图2 丰产性和稳定性GGE分析
A: 小区产量; B: 小区大薯产量; C: 小区小薯产量; D: 单株产量; E: 单株大薯产量; F: 单株小薯产量。
A: the yield of plot; B: the plot yield of large-sized tuber; C: the plot yield of small-sized tuber; D: the yield per plant; E: the yield of large-sized tubers per plant; F: the yield of small-sized tubers per plant.
在试点评价GGE双标图中, 3个试点被分为2个差异明显的品种生态区, 五竹镇属一个品种生态区, 内官镇和鲁家沟镇属另外一个相同生态区。同一试点年份间鉴别力和代表性存在差别, 3个试点2016年较2015年对基因型鉴别力更强, 而2015年环境代表性较2016年更强(图3-A~F)。试点鲁家沟镇和内官镇在2015年和2016年份对产量组分中小区产量、小区大薯产量、单株产量和单株大薯产量鉴别最接近理想试点; 五竹镇是2015年和2016年份中鉴别力最强的试点(图3-A, B, D, E)。试点鲁家沟镇2016年份对小区小薯产量最具鉴别力, 鲁家沟镇2015最具代表性。综合鉴别力和代表性, 试点排序依次为鲁家沟镇2015、鲁家沟镇2016、五竹镇2016、五竹镇2015、内官镇2015、内官镇2016 (图3-C)。单株小薯产量GGE双标图中, 试点五竹镇2016最具鉴别力, 鲁家沟镇2015最具代表性, 综合鉴别力和代表性, 试点排序依次为鲁家沟镇2016、鲁家沟镇2015、五竹镇2015、五竹镇2016、内官镇2015、内官镇2016 (图3-F)。

图3 品系综合评价、环境代表性和鉴别力
A: 小区产量; B: 小区大薯产量; C: 小区小薯产量; D: 单株产量; E: 单株大薯产量; F: 单株小薯产量。
A: the yield of plot; B: the plot yield of large-sized tuber; C: the plot yield of small-sized tuber; D: the yield per plant; E: the yield of large-sized tubers per plant; F: the yield of small-sized tubers per plant.
3 讨论
多数品种试验数据分析都是基于单一产量、品质或抗性单个性状的数据, 但实际上在育种时需要同时考虑多个性状。基于单一性状组分综合分析得出的结论比单一性状分析的结论更重要[23-24]。按照马铃薯单一产量性状分析, 仅仅能够得出品系总产量数据, 不能从总产量中获得大、小薯产量, 单株大、小薯数及结薯数数据和影响这些数据的主要原因[25-26]。
对3个试点马铃薯产量性状组分分析中发现, 小区总产量和大薯产量环境及互作效应中环境和互作效应分别占总变异61.6%和50.8%, 其中互作效应是影响小区总产量和大薯产量首要因素, 各参试品系小区产量和大薯产量数据和图形相符; 小区小薯产量中环境效应占总变异18.2%, 环境是决定小区小薯产量的首要因素。对小区总产量、小区大薯产量与小区小薯产量决定因素不同, 所以小区产量组分的GGE产量图中小区小薯产量图与前二者不相符。环境效应是决定单株产量和单株大薯产量的首要因素, 互作效应是影响单株小薯产量首要因素。品系产量组分中结薯数是衡量产量的重要数据, 但仅结薯数的数据不能完全说明结薯的整齐度和品系大薯、小薯的分布程度。单株结薯数受环境效应影响显著, 与单株大小薯产量相关的单株大薯数和单株小薯数受互作效应影响显著。因基因型、环境、基因型与环境互作对各产量组分决定程度有差异, 反映在产量适应性的双标图中, 多边形图形有相似和不同。依照GGE产量适应性对参试品系的分析, 在3个试点适应性均强的品系有G113、G106、G104和G116。青薯9号单株大薯产量同样受环境及互作效应影响显著, 呈现出大薯产量不稳定。
品种试验中除需要评价每个产量性状中的组分形成的原因, 还需要分析在多年品种试验中每个品种产量组分的稳定性[27-28]。对2年3个试点马铃薯产量组分的稳定性分析发现, 小区总产量、小区大薯产量的稳定性主要取决于环境和互作效应, 其中环境效应是首要因素, 小区小薯产量稳定性取决于互作效应。环境效应和互作效应是影响单株产量和单株大小薯产量与单株小薯产量稳定性的主要因素。本研究评估的所有产量组分中, 环境、基因型与环境互作效应决定产量组分内稳定性的差异, 基因型效应很小。依据产量性状的稳定性选择基因型时, 试验地点的效应是显著的, 可以为特定的环境选育稳定性差的高产基因型或者稳定性强的一般基因型。试点环境对于所有产量组分都有显著影响时, 就需要选育出在不同环境中性状稳定性高的基因型。按小区产量来选择, 可将所有基因型可以分为三类。第一类是具有高产稳定性基因型, 如G124、G125、G122、G10、G107、G25、青薯9号, 这类基因型可适应于不同生态环境。第二类是高产不稳定性基因型, 如G86、G94、G27、G65、G16、G79、G3, 这类基因型可适于特定的环境。第三类基因型是低产稳定性的基因型, 如G64、G82、G39、G4、G23、G22、G95, 这类基因型可用于除产量以外的品质性状选择。广适高产稳定性强的基因型在各试点都体现出基因型主效显著, 互作效应显著时表现为环境对基因型有利。广适高产稳定性差基因型在各试点的基因型主效差异显著, 不同基因型受互作效影响差异同样显著, 这类在特定生态区表现出高产稳定性的品种是主要选择对象。筛选特定生态区高产稳定性强的基因型是更有效的品种稳定性选择方法。
试点评价的目的是鉴别试点是否适合品种试验,核心试点应该对目标环境具有高度代表性, 同时对基因型的差异具有很强的鉴别力[23]。如何判断品种试验设置的试点是否是同一生态下的最佳试点是提高品种选择效率的重要工作。试点GGE双标图能够将年份和试点分开展示, 在3个试点鉴别各基因型, 所有产量组分在2个年份中鲁家沟镇和五竹镇表现一致, 环境和基因型互作效应在年份间不显著。各基因型小区小薯产量在试点内官镇的2个年份间差异显著, 原因是年份间的气候变化。产量组分最高的基因型因试点不同存在差异, 根据试点年份的组合环境划分为不同的品种生态区, 环境分组与试点气候条件相符, 3个试点中内官镇和鲁家沟镇同属典型的干旱和半干旱生态区, 而五竹镇属高寒阴湿区。同属干旱半干旱区的2个试点中鲁家沟镇对目标生态区域的代表性强于内官镇, 但在2个生态区中, 高寒阴湿区的试点五竹镇比干旱半干旱区试点鲁家沟镇和内官镇有鉴别力。
4 结论
GGE模型对产量各组分的分析可以综合评价并筛选出优良品系。本研究筛选出的高产稳定品系有G116、G124、G125、G122和青薯9号, 高产不稳定的品系有G86、G10、G121、G106、G107和G72。最理想的生态区试点是鲁家沟镇, 对品种的鉴别力最强的试点是渭源五竹镇。
[1] Zaheer K, Akhta M H. Potato production, usage, and nutrition-a review., 2014, 56: 711–721.
[2] 王玉萍, 隋景航, 梁延超, 卢潇. 甘肃省两个生态区马铃薯加工品质差异和加工品系筛选. 甘肃农业大学学报, 2016, 51(5): 39–45. Wang Y P, Sui J H, Liang Y C, Lu X. Screening for potato processing lines with tuber qulity index from two ecoregions., 2016, 51(5): 39–45 (in Chinese with English abstract).
[3] Mulema J M K, Adipala E, Olanya O M. Yield stability analysis of late blight resistant potato selections., 2016, 56: 1645–1661.
[4] Padi F K. Relationship between stress tolerance and grain yield stability in cowpea., 2004, 142: 431–443.
[5] Bednarz C W, Bridges D C, Brown S M. Analysis of cotton yield stability across population densities., 2000, 92: 128–135.
[6] Fan X M, Kang M S, Chen H M. Yield stability of maize hybrids evaluated in multi-environment trials in Yunnan, China., 2007, 99: 220–228.
[7] Mekbib F. Yield stability in common bean (L.) genotypes., 2003, 130: 147–153.
[8] Aastveit A H, Martens H. ANOVA interactions interpreted by partial least squares regression., 1986, 42: 829–844.
[9] Eberhart S A, Russel W A. Stability parameters for comparing varieties., 1966, 6: 36–40.
[10] Blouin D C, Webster E P, Bond J A. On the analysis of combined experiments., 2015, 25: 165–169.
[11] Kang M S. Simultaneous Selection for yield and stability in crop performance trials: consequences for growers., 1993, 85: 754–757.
[12] Gauch H G. Statistical analysis of yield trials by AMMI and GGE., 2006, 46: 1488–1500.
[13] Yan W K, Fetch J M, Fregeau-reid J. Genotype × location interaction patterns and testing strategies for oat in the Canadian., 2011, 51: 1903–1914.
[14] Yan W K, Kang M S, Ma B L. GGE biplot vs. AMMI analysis of genotype-by-environment data., 2007, 47: 641–653.
[15] Nzuve F, Githiri S, Mulunya D M. Analysis of genotype × environment interaction for grain yield in maize hybrids., 2013, 5: 75–85.
[16] Soto B J, Duquid S, Booker H. Genomic regions underlying agronomic traits in linseed (L.) as revealed by association mapping., 2014, 56: 75–87.
[17] Murphy S E, Lee E A, Woodrow L. Genotype × environment interaction and stability for is oflavone content in Soybean., 2009, 49: 1313–1321.
[18] Wachira F, Ngetich W, Omolo J. Genotype × environment interactions for tea yields., 2002, 127: 289–297.
[19] Burgueño J, Campos G D L, Weigel K. Genomic prediction of breeding values when modeling genotype × environment interaction using pedigree and dense molecular markers., 2012, 52: 707–712.
[20] Phuke R M, Anuradha K, Radhika K, Jabeen F, Anuradha G, Ramesh T, Hariprasanna K, Mehtre S P, Deshpande S P, Anil G, Das R R, Rathore A, Hash T, Reddy B V S, Kumar A A. Genotype × environment interaction, correlation, and GGE Biplot analysis for grain Iron and zinc concentration and other agronomic traits in RIL population of sorghum (L. Moench)., 2017, 5: 712–716.
[21] Zolfaghar S, Bahram H, Dadkhodaie A. Dissection of genotype × environment interactions for mucilage and seed yield in: application of AMMI and GGE biplot analyses., 2018, 13: e0196095.
[22] 张永成, 田丰. 马铃薯试验研究方法. 北京: 中国农业科学技术出版社, 2007. pp 90–93. Zhang Y C, Tian F. Potato Experiment Test Research Method. Beijing: China Agriculture Science and Technology Press, 2007. pp 90–93 (in Chinese).
[23] 严威凯. 农作物品种试验数据管理与分析. 北京: 中国农业科学技术出版社, 2015. pp 133–146. Yan W K. Crop Variety Trials Data Management and Analysis. Beijing: China Agriculture Science and Technology Press, 2015. pp 133–146 (in Chinese).
[24] Dia M, Weherr T C, Hasssel R, Price D S. Genotype × environment interaction and stability analysis for watermelon fruit yield in the United States., 2016, 56: 1645–1661.
[25] Wang R H, Hu D H, Zheng H Q, Yun S. Genotype × environmental interaction by AMMI and GGE biplot analysis for the provenances ofin South China., 2016, 27: 659–664.
[26] Muthoni J, Shimelis H, Melis R. Genotype × environment interaction and stability of potato tuber yield and bacterial wilt resistance in Kenya, 2015, 92: 367–378.
[27] 严威凯. 双标图分析在农作物品种多点试验中的应用. 作物学报, 2010, 36: 1805–1819. Yan W K. Optimal use of biplots in analysis of multi-location variety test data., 2010, 36: 1805–1819(in Chinese with English abstract).
[28] 严威凯, 盛庆来, 胡跃高, Hunt L A. GGE叠图法: 分析品种火环境互作模式的理想方法. 作物学报, 2001, 27: 21–28.Yan W K, Sheng Q L, Hu Y G, Hunt L A. GGE Biplot: an ideal tool for studying genotype by environment interaction of regional yield trial data., 2001, 27: 21–28 (in Chinese with English abstract).
Genotype × environment interaction and stability of yield components for potato lines
YE Xi-Miao1, CHENG Xin1, AN Cong-Cong1, YUAN Jian-Long1, YU Bin1, WEN Guo-Hong2, LI Gao-Feng2, CHENG Li-Xiang1, WANG Yu-Ping1, and ZHANG Feng1,*
1Gansu Agricultural University / Gansu Provincial Key Laboratory of Aridland Crop Science / Gansu Key Laboratory of Crop Improvement & Germplasm Enhancement, Lanzhou 730070, Gansu, China;2Gansu Acadamy of Agricultural Sciences / Potato Insititute, Lanzhou 730070, Gansu, China
This study mainly focused on the application of GGE (genotype + genotypes and environment interactions) biplot in potato breeding, to evaluate the productivity, stability and adaptability of yield traits of potato lines in different environments comprehensively, and screen out the excellent lines adapted to different mage-environments. The representativeness and discriminating ability of each test-environment were also evaluated, providing a basis for the selection of test-environment. A total of 101 advanced lines from International Potato Center (CIP) and potato variety Qingshu 9 were planted in Neiguan Town, Lujiagou Town and Wuzhu Town of Gansu province in 2015 and 2016 to measure the plot yield, plot yield of large-sized tubers, plot yield of small-sized tubers, yield per plant, large-sized tuber yield per plant, small-sized tuber yield per plant, tuber number per plant, large-sized tuber number per plant and small-sized tuber number per plant. The genotype and environment interactions were analyzed by the combined analysis of variance and GGE biplot. Except the plot yield of small-sized tubers had no significant difference in genotype and environment interactions effect, all the other yield components had significant differences (< 0.01) in genotype effect, environmental effect and genotype and environment interaction effect. The square sum of environmental effect on the plot yield, plot yield of large-sized tubers, plot yield of small-sized tubers, yield per plant, large-sized tuber yield per plant, tuber number per plant, and the square sum of genotype and environment interaction effect on the plot yield of small-sized tubers, the large-sized tuber number per plant, and the small-sized tuber number per plant were worth the largest in the square sum of total variance. The most adaptable lines in Lujiagou Town were G86, in Wuzhu Town G65, in Neiguan Town G86. The high-yield lines were G86, G116, and G124; the stable-yield lines were G124, G125, and G10; the high-yielding and stable lines were G86, G116, G124, and Qingshu 9. The lines with more large-sized tuber number per plant were G45, G86, and G67, and the lines with good stability were G67, G116, and G51. The variety Qingshu 9 did not have stable large-sized tuber yield per plant. According to the comprehensive discrimination and representativeness, the order of test-environments were Lujiagou Town in 2016, Lujiagou Town in 2015, Wuzhu Town in 2015, Wuzhu Town in 2016, Neiguan Town in 2015, and Neiguan Town in 2016. GGE model can intuitively display the results in the genotype-location-year framework, and objectively evaluate the productivity, stability and adaptability of tested lines, as well as the representativeness and discriminating ability of test-environment. According to the comprehensive evaluation of GGE model, the high-yielding and stable lines were G116, G124, G125, G122, and Qingshu 9, and the high-yielding and unstable lines were G86, G10, G121, G106, G107, and G72. The most ideal mage-environment is Lujiagou Town, and Wuzhu Town is the test-environment with the strongest discriminating ability for varieties identification.
yield component; GGE biplot; multi-years and sites; pilot evaluation
2019-06-21;
2019-09-26;
2019-10-11.
10.3724/SP.J.1006.2020.94089
张峰, E-mail: zhangf@gsau.edu.cn
E-mail: yeximiaogs@163.com
本研究由国家重点研发计划项目(2017YFD0101905), 国家自然科学基金项目(31471433), 甘肃省高等学校协同创新团队项目(2018C-17)和甘肃省科技重大专项计划项目(17ZD2NA016)资助。
This study was supported by the National Key R&D Program of China (2017YFD0101905), the National Natural Science Foundation of China (31471433), Gansu High Educational Scientific Special Project (2018C-17), and Gansu Province Science and Technology Major Special Projects (17ZD2NA016).
URL: http://kns.cnki.net/kcms/detail/11.1809.s.20191011.1215.004.html

