水稻光温敏核不育基因tms5与pms3的互作效应
王芳权 范方军 夏士健 宗寿余 郑天清 王 军 李文奇许 扬 陈智慧 蒋彦婕 陶亚军 仲维功 杨 杰,*
水稻光温敏核不育基因与的互作效应
王芳权1,2范方军1,2夏士健1宗寿余1郑天清3王 军1,2李文奇1,2许 扬1,2陈智慧1,2蒋彦婕1,2陶亚军1,2仲维功1,2杨 杰1,2,*
1江苏省农业科学院粮食作物研究所 / 国家水稻改良中心南京分中心 / 江苏省优质水稻工程技术研究中心, 江苏南京 210014;2扬州大学江苏省粮食作物现代产业技术协同创新中心, 江苏扬州 225009;3中国农业科学院作物科学研究所, 北京 100081
与是水稻的光温敏核不育基因, 其功能位点已经明确, 然而它们在两系不育系中的效应尚不清楚。本研究针对与基因功能位点, 分别设计了功能标记AS-TMS5和CAPS-PMS3。经鉴定发现, 这2个功能标记能准确区分不育、可育性状对应的隐性纯合、杂合和显性纯合3种基因型。利用AS-TMS5和CAPS-PMS3对培矮64S/9311、广占63S/湘恢47和粤光S/宁恢108的F2群体单株的基因型及育性的关系分析发现,基因是广占63S和粤光S控制光温敏不育性状的主效基因, 而基因在培矮64S和粤光S中并不能独立起作用, 还需要与其他基因共同调控。进一步分析粤光S/宁恢108的F2:3群体基因型与育性的关系, 发现在粤光S/宁恢108背景下, 携带基因的株系几乎都表现可育, 而携带基因的株系在较高气温条件下表现不育, 但育性转换温度可能较高; 而携带与基因的株系育性转换温度比仅携带基因的株系低, 这为聚合2个基因选育不育性状稳定的光温敏不育系提供了思路和方法。
;; 功能标记; 光敏不育; 温敏不育
1973年石明松在粳稻品种农垦58中发现了一株不育的水稻材料, 后来证明该不育单株是由细胞核不育基因控制的, 其育性受光照时间调控, 在此基础上提出了两系法育种的新途径[1]。两系法育种灵活地利用了核不育系的育性转换特点, 具有不育性遗传稳定、遗传行为简单、恢复源广等诸多优势, 使得两系不育系成为我国水稻育种及生产中不可或缺的类型, 在全国范围内得到了广泛的应用[2]。但两系核不育系的育性容易受光温条件波动的影响, 给不育系的繁殖和杂交种的制种造成了很多困难。2009年江苏、四川、安徽等地的持续低温使不育系育性波动, 给制种造成巨大损失[3]。因此, 针对两系不育系育性稳定性问题, 很多研究者对育性转换条件及不育的分子机制进行了深入研究[4-7]。目前, 已经定位了光敏不育基因[8-9]、[10]、()[11-12]和[13], 温敏不育基因[14]、[15-16]、[17]、[18]、[19-20]、[21]和[22], 其中和基因已被克隆。
基因为温敏不育基因, 该基因编码一个核酸内切酶——RNase ZS1, 该酶能够把UbL40的mRNA降解为短片段[23]。在温敏不育系安农S-1的编码区第71位碱基C突变为A, 形成终止密码子, RNase ZS1失活。气温高于23.5℃时, UbL40基因表达上调, 安农S-1、株1S等品种由于RNase ZS1功能缺失, 花粉母细胞中UbL40大量积累, 花粉母细胞液泡化, 最终导致雄性不育。目前普遍使用的光温敏不育系大多数由安农S-1衍生而来, 携带不育基因[23-25]。基因来源于农垦58S, 转录一个1236 bp的长链非编码RNA——LDMAR, 在第789位点上存在一个C到G的变异, 影响LDMAR加工而来的小RNA与靶序列的结合, 导致花粉不育[26-27]。研究表明, LDMAR的表达还受到DNA甲基化调控。在长日照情况下, LDMAR上游转录本AK111270产生的siRNA介导了LDMAR启动子区域的甲基化, 引起雄性不育[28]。
在实际应用中, 以和基因为背景的不育系产生的杂交稻占据了两系杂交水稻的几乎所有市场。近年来, 以携带基因的Y58S、C815S配置的Y两优和C两优系列组合迅速增加, 至2012年以基因为主导的杂交稻已经占据两系杂交水稻的95%以上[24,29]。可见, 对于和基因及它们在两系不育系中的应用研究具有非常重要的意义。本研究利用和基因功能位点开发的分子标记, 分析了光温敏不育系与常规水稻杂交F2和F2:3家系单株基因型与育性的关系, 以期为和基因在光温敏不育系选育的应用中提供新的思路。
1 材料与方法
1.1 供试材料及实验设计
供试水稻材料有常规水稻品种5份, 包括日本晴、9311、南京16号、湘恢47和宁恢108; 主流两系不育系品种或品系19份, 包括农垦58S、安农S-1、株1S、培矮64S、广占63S、粤光S、N111S、C815S、Y58S、509S、武香S、深08S、1206S、1208S、L126S、L128S、丰39S、1892S和L816S。其中, 粤光S由广东省农业科学院李传国研究员以超级97/明七596杂交后代选育而成, 为温度敏感性雄性核不育系水稻种质, 1206S、1208S为粤光S的衍生系。
培矮64S/9311、广占63S/湘恢47和粤光S/宁恢108的F2群体, 以及粤光S/宁恢108的F2:3家系, 用于分析或基因型与育性的关系。2015年正季在南京的3个F2群体播种时间为5月20日。灌浆结实后, 选取抽穗期不迟于9月10日的单株, 调查结实率, 取叶片提取DNA, 用于检测或基因型。
1.2 tms5、pms3基因功能标记设计
已克隆水稻光温敏基因, 且明确其功能位点[23]。安农S-1携带的水稻温敏不育基因在编码区71位碱基C突变为A, 形成TAG终止密码子。参照日本晴和9311基因组序列, 安农S在编码氨基酸的70位碱基也发生了变异, 由G突变成了T, 因此本研究根据该位点的突变特点, 利用Oligo 7.0软件设计等位基因特异PCR (allele-specific PCR, AS-PCR)标记, 命名为AS-TMS5 (表1)。纯合基因型(,)只能被T5n-F/T5-R引物组合有效扩增,纯合基因型(,)只能被T5m-F/T5-R引物组合有效扩增, 而杂合基因型()能同时被T5n-F/T5-R引物组合和T5m-F/ T5-R引物组合有效扩增。理论扩增产物长度为302 bp。
光温敏不育基因属于长链的非编码RNA调控基因, 在789位点由C到G的变异引起了其功能丧失, 导致雄性不育[26-27]。该位点由C到G的变异使基因能够被6 I (G/TAC)识别并切割。利用Oligo 7.0跨越该位点设计了基因特异性功能标记CAPS-PMS3 (表1)。CAPS-PMS3标记能将待测水稻材料扩增出410 bp片段,纯合基因型(,)水稻材料的扩增产物不能被6 I酶切开,纯合基因型(,)水稻材料的扩增产物能被6 I彻底酶切为280 bp和130 bp片段, 而杂合基因型()水稻材料的扩增产物被6 I酶切后, 存在410、280和130 bp这3种带型。引物序列见表1。

表1 TMS5、PMS3功能标记引物
1.3 DNA提取、PCR扩增及酶切
用CTAB法提取水稻基因组DNA。以DNA为模板, 以下列体系进行PCR。反应体系包括: 10×PCR缓冲液(含20 mmol L–1Mg2+) 2 µL, dNTP (含dATP、dGTP、dCTP、dTTP各2 mmol L–1) 2 µL, 上、下游引物(各2 µmol L–1) 2 µL,酶0.5 µL, DNA 2 µL, 用灭菌ddH2O补足至20 µL。PCR扩增条件为94℃ 5 min; 94℃ 30 s, 63℃或60℃ 30 s, 72℃ 30 s, 30个循环; 72℃延伸5 min, 结束反应。其中, AS-TMS5标记的退火温度为63℃, CAPS-PMS3标记的退火温度为60℃。CAPS-PMS3标记扩增产物用6 I (NEB)酶切, 酶切反应体系含: 10×buffer B 2 µL, PCR产物10 µL,6 I (10 U µL–1) 1 µL, 用灭菌ddH2O补足至20 µL, 37℃反应3 h。PCR产物和酶切产物分别在含有核酸染料(DuRed)的琼脂糖凝胶中电泳分离, 用凝胶成像系统记录实验结果。
1.4 TMS5和PMS3突变位点的测序验证
为了进一步明确和基因突变位点信息, 用PCR方法扩增包含突变位点的DNA片段并测序。针对基因突变位点, 设计跨越该位点的测序引物TMS5-F: 5′-CCATCGTGCTTCGTGCC AAAA-3′和TMS5-R: 5′-TCGAGGGGGACGAGGTT GTG-3′进行PCR扩增, PCR理论产物长度约为475 bp。使用CAPS-PMS3标记进行扩增检测基因突变位点。PCR产物送Invitrogen公司测序。
1.5 粤光S/宁恢108组合F2:3家系的获得及育性分析
1.5.1 F2:3家系的获得 2013年11月利用粤光S/宁恢108的F2群体种子在光照培养箱发芽长成二叶一心的小苗, 提取DNA。用AS-TMS5和CAPS- PMS3标记对100个粤光S/宁恢108 F2单株进行检测, 选取基因型单株3株,基因型单株5株,基因型单株3株,基因型单株4株; 11月30日带到海南三亚荔枝沟南繁基地加代, 2月底抽穗, 套袋自交, 各单株正常结实, 按单株收获F2:3种子。将2015年春季(4月)海南收获的F2:3种子, 于2015年正季(5月), 在江苏省农业科学院试验田(南京)分两期播种, 第1期于5月15日播种, 6月10日移栽; 第2期于6月1日播种, 6月25日移栽, 田间管理同常规大田。抽穗扬花期对第1期播种的F2:3株系(S1~S15)进行花药形态、花粉染色分析, 从每个株系随机选取3个单株。
1.5.2 花药形态观察 用镊子将颖壳小心拨开, 去除外稃, 将花药从内稃中小心拨出, 于体视显微镜(KEYENCE DIGITAL MICROSCOPE VHX-500F)下观察并照相记录。
1.5.3 花粉育性检测 将花药置载玻片上, 用盖玻片压片释放出花药, 然后用1% I2-KI溶液染色, 在显微镜(OLYMPUS BX51)下观察并用照相机(OLYMPUS DIGITAL CAMERA C5050Z)照相记录。
1.6 气象资料
用气温仪记录试验田8月1日至9月30日的气温, 8月1日至9月10日, 日均温度都高于23.5℃, 但日最低温度从8月9日开始, 只有8月15至20日高于23.5℃(图1)。日照时间见附图1。
2 结果与分析
2.1 基因的功能标记分析及测序验证
利用AS-TMS5标记分别对24份水稻品种或品系进行检测(图2)。用T5n引物对常规稻日本晴、9311、湘恢47、宁恢108和不育系农垦58S、培矮64S能扩增出产物, 而用T5m不能扩增出产物, 说明这6个品种均不携带温敏不育基因型; 用T5m对安农S-1、株1S、广占63S、粤光S、N111S、C815S、Y58S、509S、武香S、深08S、1206S、1208S、L126S、L128S、丰39S、1892S和L816S能扩增出302 bp产物, 而用T5n不能扩增出产物, 表明这17个不育系都携带纯合的基因。南京16号为常规籼稻品种, 与日本晴、9311相比, 其基因的70位碱基由G突变为T (图3), 该材料以AS-TMS5标记扩增的结果与其他常规稻相同, 为纯合基因型。以上部分结果与已报道的研究结果一致[24], 表明本研究开发的AS-TMS5标记能经过两次独立PCR准确鉴定可育基因型和不育基因型。
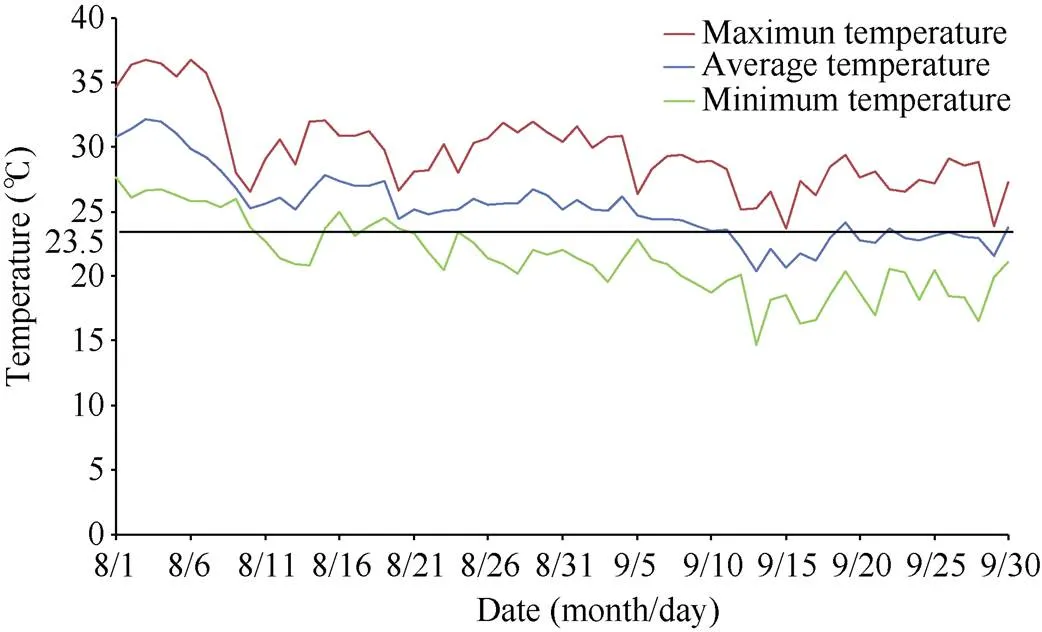
图1 2015年8月至9月田间气温走势图
利用CAPS-PMS3标记引物扩增24份水稻品种或品系的基因组, 然后用限制性内切酶6 I对PCR产物进行酶切(图2)。农垦58S、培矮64S、粤光S、509S、1206S和1208S这6个材料携带基因, 而其他都不携带基因, 也与前人报道一致[24], 说明本研究的CAPS-PMS3标记能准确鉴定与基因型。

图2 水稻品种(系)的AS-TMS5和CAPS-PMS3标记检测
1~24分别为: 日本晴、9311、南京16号、湘恢47、宁恢108、农垦58S、安农S-1、株1S、培矮64S、广占63S、粤光S、N111S、C815S、Y58S、509S、武香S、深08S、1206S、1208S、L126S、L128S、丰39S、1892S和L816S。
1–24 represent Nipponbare, 9311, Nanjing 16, Xianghui 47, Ninghui 108, Nongken 58S, Annong S-1, Zhu 1S, Pei’ai 64S, Guangzhan 63S, Yueguang S, N111S, C815S, Y58S, 509S, Wuxiang S, Shen 08S, 1206S, 1208S, L126S, L128S, Feng 39S, 1892S, and L816S.
综合两个标记检测的结果, 在24份材料中, 常规稻日本晴、9311、南京16号、湘恢47和宁恢108不携带不育基因; 安农S-1、株1S、广占63S、N111S、C815S、Y58S、武香S、深08S、L126S、L128S、丰39S、1892S和L816S只携带不育基因; 农垦58S和培矮64S只携带基因; 而509S、粤光S及其2个衍生系(1206S和1208S)同时携带2个不育基因。
利用引物TMS5-F/TMS5-R和CAPS-PMS3对部分品种的PCR产物进行测序分析(图3和图4), 进一步验证了这些材料携带的基因型与标记检测结果完全对应。说明本研究设计的2个标记能准确地鉴定和这2个基因的等位基因型。

图3 TMS5基因突变位点的测序分析
(a)和(b)的差异位点位于基因编码区之前, (c)为起始密码子, (d)为功能突变位点。
The polymorphic sites present in (a) and (b) are before the CDS ofgene; (c) site represents the start coding site; (d) site is the functional mutant site.

图4 PMS3基因突变位点的测序分析
2.2 3个0F2群体的育性及基因型分析
经检测, 培矮64S只携带基因(基因型为), 广占63S只携带基因(基因型为), 粤光S同时携带和两个基因(基因型为), 9311、湘恢47和宁恢108都不携带和基因(基因型为)(图2)。本研究利用培矮64S/9311、广占63S/湘恢47和粤光S/宁恢108的F2群体, 在南京正季播种, 单苗移栽, 灌浆结实后调查群体的结实率。
用CAPS-PMS3标记对培矮64S/9311的F2群体中的9个不育单株和53个可育单株检测发现, 不育单株既有纯合基因型也有杂合基因型, 而可育单株包含了、、这3种基因型(附表1)。从以上结果可以看出, 并非所有携带基因型的F2单株都表现雄性不育, 而有些基因型单株也表现雄性不育。推测培矮64S中还有其他基因如、或目前未发现的基因与互作。
杂交组合“广占63S/湘恢47”的89个F2单株中, 60个可育, 29个不育, 其分离比例符合3﹕1 (c2=2.34,c20.05, 1=3.84)。用AS-TMS5标记检测发现, 携带基因型的28个单株都表现为雄性不育, 而杂合基因型的单株都表现为可育; 除了17号单株外, 携带纯合基因型的单株都表现为可育(附表2)。基因与“广占63S/湘恢47”F2单株的育性几乎共分离, 表明是控制广占63S雄性不育的主效基因。
在南京正季种植, 粤光S表现不育, I2-KI染色镜检属无花粉型, 宁恢108及其杂交种花粉染色正常。利用AS-TMS5标记和CAPS-PMS3标记检测, 粤光S为基因型; 宁恢108为基因型, 它们的杂交种F1为杂合基因型, 说明两个标记都可以准确区分3种基因型, 是共显性分子标记。79个F2单株中, 可育单株57株, 不育单株22株, 育性符合3﹕1的分离比例(c2=0.06,c20.05, 1=3.84)。利用分子标记分析发现, 22个不育单株均携带纯合基因型, 而这些不育单株包含了、和基因型这3种类型; 57个可育单株是或两种基因型, 57个可育单株中也同时携带基因的、和这3种基因型(表2和图5)。

表2 粤光S/宁恢108 F2群体基因型与育性的关系
Yueguang S: 粤光S; Ninghui 108: 宁恢108。F1: 粤光S/宁恢108杂交种; +:或纯合基因型; –:或纯合基因型; *:或杂合基因型; F: 可育; S: 不育。
F1: hybrid of Yueguang S/Ninghui 108; +: homozygous genotypeor homozygous genotype; –: homozygous genotypeor homozygous genotype; *: heterozygous genotypeor; F: fertile; S: sterile.

图5 以AS-TMS5和CAPS-PMS3标记检测粤光S/宁恢108 F2群体部分单株
P1: 粤光S; P2: 宁恢108; F1: 粤光S/宁恢108杂交种; 1~45: 粤光S/宁恢108 F2群体部分单株。
P1: Yueguang S; P2: Ninghui 108; F1: hybrid of Yueguang S/Ninghui 108; 1–45: part of Yueguang S/Ninghui 108 F2population.
综合3个F2群体单株的育性和基因型检测结果发现,基因不与雄性不育性状共分离, 而基因与不育性状共分离。在携带基因的2个F2群体中, 可育单株与不育单株符合3﹕1的分离比例, 说明基因是控制温敏不育的主效基因。
2.3 粤光S/宁恢108+组合F2:3家系育性与基因型分析
为了探讨基因和基因是否存在互作关系, 进一步研究了粤光S/宁恢108组合F2:3家系4种基因型的育性情况。分两期播种F2:3家系, 第2期比第1期抽穗期大概迟约15 d (表3), 第2期花粉母细胞发育时的日平均温和最低温都显著低于第1期(图1)。
通过对F2:3家系(第1期)的花药形态、花粉染色和穗结实情况分析发现, 与父本宁恢108相似,基因型的3个株系和的4个株系(S8株系的1个单株除外)都表现可育, 其花药饱满、充满花粉, 花粉粒圆、染色深, 穗结实正常(表3和图6), 表明基因不是两系不育系粤光S的主效基因。而和基因型的株系则与母本粤光S相似, 表现不育, 其花药细窄, 几乎无花粉粒, 少量花粉粒畸形且不着色, 穗不结实。

表3 粤光S/宁恢108组合F2:3株系育性分析

图6 粤光S/宁恢108组合F2:3株系育性分析
A: 花药形态和花粉育性分析, 大图标尺为1 mm, 小图标尺为100 μm; B: 小穗结实分析, 标尺为2 cm。
A: the anther morphology and pollen fertility; white bar, 1 mm; black bar, 100 μm; B: the fertility of panicle; bar, 2 cm.
对F2:3家系(第2期)的结实情况分析发现,和基因型的所有单株(S1~S8)都表现可育;基因型株系(S9-S11)约59%的单株都可育, 与第1期相比, 可育单株数显著增加, 可能与后期气温下降及光照时间缩短有关。而基因型株系(S12~S15)中, 除S12中的1个单株外, 所有单株都表现不育, 表明基因型株系比基因型株系的育性更不易受后期气温降低及光照时间缩短的影响。
结合两期育性情况的结果可以看出, 在粤光S/宁恢108遗传背景下,基因是调控育性的主效基因, 对植株的育性起决定作用;基因可能是调控育性的微效基因, 能增强基因背景下植株不育性状的稳定性; 推测基因和基因之间可能存在着直接或间接的互作关系。
2.4 粤光S/宁恢108后代ttpp基因型株系的育性表现
明确粤光S/宁恢108的F2:3株系部分植株不结实后, 对表3中株系S12 (基因型)的3个单株、株系S13 (基因型)的2个单株和株系S14 (基因型)的1个单株去穗留稻桩, 让植株再生, 2次孕穗。由于温度降低, 花粉恢复育性, 套袋自交, 收取种子, 带海南加代繁殖, 后代按单株收种, 每个系各收取5个单株。2016年南京正季种F5代, 分两期播种, 第1期于5月10日, 第2期于5月23日, 每个株系种35株苗。抽穗时间第1期在8月4日至8月22日之间, 第2期在8月13日至9月2日之间。观察单株结实情况发现, 选育的30个株系的所有单株均表现雄性不育, 表明通过标记选择聚合、基因, 能够选育出育性更稳定的不育系。
3 讨论
两系杂交水稻是我国南方稻区的主要水稻类型,对国家粮食安全起着重要作用。近年来, 两系杂交稻的推广面积逐年增加[30]。两系不育系是培育优良两系杂交水稻的关键。然而, 目前两系不育系的选育通常是在田间自然条件下鉴定, 选育过程容易受环境条件的直接影响, 工作量大且周期长, 育种效率低; 利用人工气候房选育能够获得较准确的结果, 但工作量大, 成本很高。和基因的克隆和功能的明确为通过分子标记辅助选择培育两系不育系提供了可能。本研究根据和基因功能突变位点分别设计了等位基因特异PCR标记AS-TMS5和酶切扩增多态性序列标记CAPS-PMS3。与前人报道类似[31-33], 本研究开发的2个标记能够准确且高效地区分两个基因的可育和不育基因型, 可用于分子标记辅助选择育种。利用分子标记辅助选择和基因, 辅以田间或人工气候房选育, 能够大大缩短两系不育系选育周期, 较准确获得不育起点温度低、育性稳定的光温敏不育系。
水稻两系不育系的光温调控机制非常复杂, 很多不育系的育性转换都是光温效应连动的结果[34]。农垦58S的育性主要受光照时间调控, 而农垦58S的衍生不育系培矮64S则受温度和光照的共同影响[27]。光温敏雄性不育受主效不育基因和发育感温、感光基因的共同调控, 而众多微效不育基因影响育性转换的条件。在本研究中, 广占63S/湘恢47组合的F2单株中, 凡是携带基因的单株都表现不育, 表明基因是水稻光温敏不育的主效基因。基因编码一个核糖核酸酶RNase ZS1, 其转录受转录因子OsbHLH138调节, 但和的表达均不受气温调控[23,35]。基因突变导致RNase ZS1失去活性, 不能降解泛素基因Ub的mRNA, 而Ub基因的表达受高温诱导。在高温条件下, UbL40蛋白过量积累, 导致雄性不育。因此, 广占63S光温敏不育性状的遗传符合基因为主效基因,Ub基因为发育感温、感光基因的调控机制。与基因调控育性的机制不同,基因则是通过小RNA的表观遗传学机制调控农垦58S的光温敏不育。培矮64S/9311组合的F2单株中, 不育性状不与基因共分离, 很多携带纯合基因型的单株也表现为可育, 表明培矮64S中基因并不是独立起作用的, 还需要与其他基因(如、或目前未发现的基因)共同调控。研究表明,基因还受到其上游转录本AK111270产生的siRNA介导的甲基化调控[28]。在农垦58S品种中过表达AK111270下调了基因的表达并影响了水稻对光周期育性转换的条件。因此, 花粉的育性除了与基因型有关, 还与其表达量有一定关系。在不同遗传背景下,基因的表达量可能不同, 从而引起了育性的分化。进一步对粤光S/宁恢108 F2单株育性和基因型情况分析也发现, F2单株的育性与携带基因完全共分离, 而与基因无直接关系。本研究还发现, 广占63S/湘恢47组合中1个基因型为的F2单株及粤光S/宁恢108组合1个基因型为的F2:3家系单株均表现不育, 这些现象也暗示了水稻两系不育系光温调控机制的复杂性。随着两系杂交稻的应用和推广,基因在两系不育系中起着主要作用。直至2012年, 携带基因的杂交水稻组合已占两系杂交稻的95%以上[24]。
水稻光温敏两系不育系不仅受日平均温度的影响, 同时也受到低温持续时间的影响。通过粤光S/宁恢108四种基因型组合的F2:3家系育性与基因型关系分析发现, 虽然在9月10日前, 田间日平均气温都连续高于23.5℃, 但在8月21日之后, 田间日最低气温就持续低于23.5℃。持续低温可能是引起只携带基因的部分株系可育的原因。彭海峰等[7]研究表明, 携带不育基因的籼S、N28S的育性更不易受外界持续低温的影响, 而培矮64S、N9S和N2S则更容易受低温影响。研究发现, 利用基因编辑技术敲除基因, 能够获得水稻温敏不育材料[36-39]。在粤光S/宁恢108选出的F2:3单株中, 同时携带和基因的株系比仅携带基因的株系更不易受持续低温的影响(表3)。表明基因增加了基因背景下育性的稳定性, 预示着和基因可能在信号通路上存在直接或间接的关系。在已审定的水稻两系不育系品种中, 同时含有不育基因和的品种还比较少, 目前鉴定到的仅有N422S、广湘S和双8S等[22]。然而, 是否在不同遗传背景下, 同时携带和基因的品种的育性都相对稳定, 仍然需要更全面深入的研究。但可以预测的是, 通过聚合光温敏不育基因, 对于选育不育起点温度更低、育性更加稳定的不育系是有利的。
4 结论
开发了水稻光温敏不育基因和的功能标记, 分析了培矮64S/9311、广占63S/湘恢47、粤光S/宁恢108这3个群体F2单株及粤光S/宁恢108的F2:3家系中和基因与育性的关系, 发现基因是水稻光温敏不育系的主效基因, 而基因并不能独立起作用, 还需要与其他基因共同调控; 推测和基因同时存在可能提高不育系育性的稳定性。本研究为利用和基因培育起点温度低且育性稳定水稻两系不育系提供了思路。
附表1 培矮64S/9311 F2群体基因型与育性的关系

(续附表1)
F1: 培矮64S/9311杂交种; +:基因型; –:基因型; *:基因型; F: 可育; S: 不育。培矮64S、9311、杂交种F1及所有的F2单株都为纯合基因型。
F1: hybrid of Pei’ai 64S/9311; +: homozygous genotype; –: homozygous genotype; *: heterozygous genotype; F: fertile; S: sterile; Pei’ai 64S, 9311, hybrid and all F2population carry the homozygous genotype.

附表2 广占63S/湘恢47 F2群体基因型与育性的关系
F1: 广占63S/湘恢47杂交种; +:基因型; –:基因型; *:基因型; F: 可育; S: 不育。广占63S、湘恢47、杂交种F1及所有的F2单株都为纯合基因型。
F1: hybrid of Guangzhan 63S/Xianghui 47; +: homozygous genotype; –: homozygous genotype; *: heterozygous genotype; F: fertile; S: sterile; Guangzhan 63S, Xianghui 47, hybrid and all F2population carry the homozygous genotype.

附图1 2015年8月至9月田间日照走势图
Supplementary fig. 1 Sunshine time of experimental plot in August and September of 2015
[1] 石明松. 对光照长度敏感的隐性雄性不育水稻的发现与初步研究. 中国农业科学, 1985, 18(2): 44–48. Shi M S. The discovery and study of the photosensitive recessive male-sterile rice (L. subsp.)., 1985, 18(2): 44–48 (in Chinese with English abstract).
[2] 王智权, 肖宇龙, 王晓玲, 雷建国, 余传元. 水稻杂种优势利用的研究进展. 江西农业学报, 2013, 25(6): 23–28. Wang Z Q, Xiao Y L, Wang X L, Lei J G, Yu C Y. Research advances in rice heterosis utilization., 2013, 25(6): 23–28 (in Chinese with English abstract).
[3] Chen L Y, Lei D Y, Tang W B, Xiao Y H. Thoughts and practice on some problems about research and application of two-line hybrid rice., 2011, 18: 79–85.
[4] 孙宗修, 程式华, 闵绍楷, 熊振民, 应存山, 斯华敏, 杨仁崔, 梁康迳, 王乃元. 光敏核不育水稻的光温反应研究. 作物学报, 1993, 19: 83–87. Sun Z X, Cheng S H, Min S K, Xiong Z M, Ying C S, Si H M, Yang R C, Liang K J, Wang R Y. Studies on the response of photoperiod sensitive genic male sterile (PGMS) rice to photoperiod and temperature., 1993, 19: 83–87 (in Chinese with English abstract).
[5] 程式华, 孙宗修, 斯华敏, 卓丽圣. 水稻两用核不育系育性转换光温反应型的分类研究. 中国农业科学, 1996, 29(4): 11–16. Cheng S H, Sun Z X, Si H M, Zhuo L S. Classification of fertility response to photoperiod and temperature in dual-purpose genic male sterile lines (L.)., 1996, 29(4): 11–16 (in Chinese with English abstract).
[6] 陈立云, 肖应辉. 水稻光温敏核不育机理设想及光温敏核不育系选育策略. 中国水稻科学, 2010, 24: 103–107. Chen L Y, Xiao Y H. Mechanism of sterility and breeding strategies of photoperiod/thermo-sensitive genic male sterile rice., 2010, 24: 103–107 (in Chinese with English abstract).
[7] 彭海峰, 陈雄辉, 葛艳艳, 万邦惠. 不同光温敏核不育水稻对低温耐受度的差异比较研究. 华南农业大学学报, 2016, 37(1): 14–19. Peng H F, Chen X H, Ge Y Y, Wan B H. A comparative study on the low temperature tolerability of different photo-thero sensitive genic male sterile lines in rice., 2016, 37(1): 14–19 (in Chinese with English abstract).
[8] Liu N, Shan Y, Wang F P, Xu C G, Peng K M, Li X H, Zhang Q. Identification of an 85-kb DNA fragment containing, a locus for photoperiod-sensitive genic male sterility in rice., 2001, 266: 271–275.
[9] Fan Y, Yang J, Mathioni S M, Yu J, Shen J, Yang X, Wang L, Zhang Q, Cai Z, Xu C, Li X, Xiao J, Meyers B C, Li X., producing phased small-interfering RNAs, regulates photoperiod-sensitive male sterility in rice., 2016, 113: 15144–15149.
[10] Zhang Q, Shen B Z, Dai X K, Mei M H, Saghai Maroof M A, Li Z B. Using bulked extremes and recessive class to map genes for photoperiod-sensitive genic male sterility in rice., 1994, 91: 8675–8679.
[11] Li X H, Lu Q, Wang F L, Xu C G, Zhang Q F. Separation of the two-locus inheritance of photoperiod sensitive genic male sterility in rice and precise mapping thelocus., 2001, 119: 343–348.
[12] Lu Q, Li X H, Guo D, Xu C G, Zhang Q. Localization of, a gene for photoperiod-sensitive genic male sterility, to a 28.4-kb DNA fragment., 2005, 273: 507–511.
[13] Huang T Y, Wang Z, Hu Y G, Shi S P, Peng T, Chu X D, Shi J, Xiang Z F, Liu D Y. Genetic analysis and primary mapping of, a photoperiod-sensitive genic male sterility gene in rice ()., 2008, 15: 153–156.
[14] Wang B, Xu W W, Wang J Z, Wu W, Zheng H G, Yang Z Y, Ray J D, Nguyen H T. Tagging and mapping the thermo-sensitive genic male-sterile gene in rice (L.) with molecular markers., 1995, 91: 1111–1114.
[15] Yamagushi Y, Ikeda R, Hirasawa H, Minami M, Ujihara P. Linkage analysis of the thermo-sensitive genic male sterility genein rice (L.)., 1997, 47: 371–377.
[16] Lopez M T, Toojinda T, Vanavichit A, Tragoonrung S. Microsatellite markers flanking thegene facilitated tropical TGMS rice line development., 2003, 43: 2267–2271.
[17] Subudhi P K, Borkakati R P, Virmani S S, Huang N. Molecular mapping of a thermosensitive genetic male sterility gene in rice using bulked segregant analysis., 1997, 40: 188–194.
[18] Dong N V, Subudhi P K, Luong P N, Quang V D, Quy T D, Zheng H G, Wang B, Nguyen H T. Molecular mapping of a rice gene conditioning thermo-sensitive genic male sterility using AFLP, RFLP and SSR techniques., 2000, 100: 727–734.
[19] Yang Q, Liang C, Zhuang W, Li J, Deng H, Deng Q, Wang B. Characterization and identification of the candidate gene of rice thermo-sensitive genic male sterile geneby mapping., 2007, 225: 321–330.
[20] Peng H F, Chen X H, Lu Y P, Peng Y F, Wan B H, Chen N D, Wu B, Xin S P, Zhang G Q. Fine mapping of a gene for non-pollen type thermo-ssensitive genic male sterility in rice (L.)., 2010, 120: 1013–1020.
[21] Lee D S, Chen L J, Suh H S. Genetic characterization and fine mapping of a novel thermo-sensitive genic male-sterile genein rice (L.)., 2005, 111: 1271–1277.
[22] Liu X, Li X, Zhang X, Wang S. Genetic analysis and mapping of a thermo-sensitive genic male sterility gene,, in rice (L.)., 2010, 53: 119–124.
[23] Zhou H, Zhou M, Yang Y, Li J, Zhu L, Jiang D, Dong J, Liu Q, Gu L, Zhou L, Feng M, Qin P, Hu X, Song C, Shi J, Song X, Ni E, Wu X, Deng Q, Liu Z, Chen M, Liu Y G, Cao X, Zhuang C. RNase ZS1 processes UbL40 mRNAs and controls thermosensitive genic male sterility in rice., 2014, 5: 4884.
[24] 张华丽, 陈晓阳, 黄建中, 鄂志国, 龚俊义, 舒庆尧. 中国两系杂交水稻光温敏核不育基因的鉴定与演化分析. 中国农业科学, 2015, 48: 1–9. Zhang H L, Chen X Y, Huang J Z, Er Z G, Gong J Y, Shu Q Y. Identification and transition analysis of photo-/thermo-sensitive genic male sterile genes in two-line hybrid rice in China., 2015, 48(1): 1–9 (in Chinese with English abstract).
[25] 斯华敏, 付亚萍, 刘文真, 孙宗修, 胡国成. 水稻光温敏雄性核不育系的系谱分析. 作物学报, 2012, 38: 394–407. Si H M, Fu Y P, Liu W Z, Sun Z X, Hu G C. Pedigree analysis of photoperiod-thermo sensitive genic male sterile rice., 2012, 38: 394–407 (in Chinese with English abstract).
[26] Ding J, Lu Q, Ou-Yang Y, Mao H, Zhang P, Yao J, Xu C, Li X, Xiao J, Zhang Q. A long noncoding RNA regulates photoperiod-sensitive male sterility, an essential component of hybrid rice., 2012, 109: 2654–2659.
[27] Zhou H, Liu Q, Li J, Jiang D, Zhou L, Wu P, Lu S, Li F, Zhu L, Liu Z, Chen L, Liu Y G, Zhuang C. Photoperiod- and thermo-sensitive genic male sterility in rice are caused by a point mutation in a novel noncoding RNA that produces a small RNA., 2012, 22: 649–660.
[28] Ding J, Shen J, Mao H, Xie W, Li X, Zhang Q. RNA-directed DNA methylation is involved in regulating photoperiod-sensitive male sterility in rice., 2012, 5: 1210–1216.
[29] 柏斌, 吴俊, 庄文, 姚栋萍, 李莺歌, 邓启云. 广适性光温敏不育系Y58S幼穗分化期耐冷性表现及生理机制. 植物遗传资源学报, 2017, 18: 646–652. Bai B, Wu J, Zhuang W, Yao D P, Li Y G, Deng Q Y. Studies on cold tolerance of widely adaptable ptgms line Y58S and its physiological mechanism at the booting stage., 2017, 18: 646–652 (in Chinese with English abstract).
[30] 雷东阳, 林勇, 陈立云. 水稻两用核不育系的研究现状与发展策略. 湖南农业大学学报(自然科学版), 2019, 45(3): 225–230. Lei D Y, Lin Y, Chen L Y. The research progress and countermeasures of dual-purpose genic male sterile line.(Nat Sci), 2019, 45(3): 225–230 (in Chinese with English abstract).
[31] Zhang H L, Huang J Z, Liu Q L, Nawaz Z, Lu H P, Gong J Y, Zhu Y J, Yan W, Shu Q Y. Characterization of an RNase Z nonsense mutation identified exclusively in environment-conditioned genic male sterile rice., 2014, 34: 481–489.
[32] 李丁, 赵迎曦, 夏玉梅, 袁隆平, 高婧, 沈春修, 方真, 李祺, 曹孟良. 水稻光温敏核不育系不育基因的分子检测. 杂交水稻, 2013, 28(1): 68–71.Li D, Zhao Y X, Xia Y M, Yuan N P, Gao J, Shen C X, Fang Z, Li Q, Cao M L. The SNP detection ofandgenes in rice PTGMS lines by PCR-PFLP and sequencing techniques., 2013, 28(1): 68–71 (in Chinese with English abstract).
[33] 李军, 李白, 高荣村. 利用四引物扩增受阻突变体系PCR技术检测水稻光温敏核不育基因. 中国水稻科学, 2014, 28: 442–446. Li J, Li B, Gao R C. Deletion of genefor photoperiod- and thermo-sensitive genic male sterility by tetra-primer amplication refractory mutation system PCR in rice., 2014, 28: 442–446 (in Chinese with English abstract).
[34] 何强, 陈立云, 邓华凤, 唐文邦, 肖应辉, 袁隆平. 水稻C815S及其同源株系的育性光温特性. 作物学报, 2007, 33: 262–268. He Q, Chen L Y, Deng H F, Tang W B, Xiao Y H, Yuan L P. Fertility photo-thermo characteristics in PTGMS rice C815S and its homologous plant lines., 2007, 33: 262–268 (in Chinese with English abstract).
[35] Wen J, Wang L, Wang J, Zeng Y, Xu Y, Li S. The transcription factor OsbHLH138 regulates thermo-sensitive genic male sterility in rice via activation of., 2019, 132: 1721–1732.
[36] Zhou H, He M, Li J, Chen L, Huang Z, Zheng S, Zhu L, Ni E, Jiang D, Zhao B, Zhuang C. Development of commercial thermo-sensitive genic male sterile rice accelerates hybrid rice breeding using the CRISPR/Cas9-mediatedediting system., 2016, 6: 37395.
[37] Barman H N, Sheng Z, Fiaz S, Zhong M, Wu Y, Cai Y, Wang W, Jiao G, Tang S, Wei X, Hu P. Generation of a new thermo-sensitive genic male sterile rice line by targeted mutagenesis ofgene through CRISPR/Cas9 system., 2019, 19: 109.
[38] 黄忠明, 周延彪, 唐晓丹, 赵新辉, 周在为, 符星学, 王凯, 史江伟, 李艳锋, 符辰建, 杨远柱. 基于CRISPR/Cas9技术的水稻温敏不育基因突变体的构建. 作物学报, 2018, 44: 844–851. Huang Z M, Zhou Y B, Tang X D, Zhao X H, Zhou Z W, Fu X X, Wang K, Shi J W, Li Y F, Fu C J, Yang Y Z. Construction ofmutants in rice based on CRISPR/Cas9 technology., 2018, 44: 844–851 (in Chinese with English abstract).
[39] 吴明基, 林艳, 刘华清, 陈建民, 付艳萍, 杨绍华, 王锋. 利用CRISPR/Cas-9技术创制水稻温敏核不育系. 福建农业学报, 2018, 33: 1011–1015. Wu M J, Lin Y, Liu H Q, Chen J M, Fu Y P, Yang S H, Wang F. Development of thermo-sensitive male sterile rice with CRISPR/Cas9 technology., 2018, 33: 1011–1015 (in Chinese with English abstract).
Interactive effects of the photoperiod-/thermo-sensitive genic male sterile genesandin rice
WANG Fang-Quan1,2, FAN Fang-Jun1,2, XIA Shi-Jian1, ZONG Shou-Yu1, ZHENG Tian-Qing3, WANG Jun1,2, LI Wen-Qi1,2, XU Yang1,2, CHEN Zhi-Hui1,2, JIANG Yan-Jie1,2, TAO Ya-Jun1,2, ZHONG Wei-Gong1,2, and YANG Jie1,2,*
1Institute of Food Crops, Jiangsu Academy of Agricultural Sciences / Nanjing Branch of Chinese National Center for Rice Improvement / Jiangsu High Quality Rice R&D Center, Nanjing 210014, Jiangsu, China;2Jiangsu Co-innovation Center for Modern Production Technology of Grain Crops, Yangzhou University, Yangzhou 225009, Jiangsu, China;3Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Theandare two photoperiod-/thermo-sensitive genic male sterile genes, and their functional sites are clarified. However, the interactive effects ofandin two-line sterile lines are still unclear. In this study, the functional markers AS-TMS5 and CAPS-PMS3 were designed, according to the functional sites ofandrespectively. The three genotypes ofandwereaccurately distinguished by AS-TMS5 and CAPS-PMS3. The relationship of the phenotype and genotype in the F2population of Pei’ai 64S/9311, Guangzhan 63S/Xianghui 47 and Yueguang S/Ninghui 108 were analyzed respectively. Thewas the major gene in Guangzhan 63S and Yueguang S, whilewas a non-independent gene in Pei’ai 64S and Yueguang S. By the phenotype and genotype analysis of the F2:3population of Yueguang S/Ninghui 108, the plants carryingalmost were fertile, while the plants carryingshowed sterility, and had higher transition temperature. Furthermore, the sterility of the plants carryingandmight have lower transition temperature than those carrying. Pyramiding ofandprovides an efficient scheme to breed photoperiod-/thermo-sensitive genic male sterile lines, which have lower transition temperature and safer production.
;; functional marker; photoperiod-sensitive male sterility; thermo-sensitive male sterility
2019-07-08;
2019-09-26;
2019-10-14.
10.3724/SP.J.1006.2020.92036
杨杰, E-mail: yangjie168@aliyun.com, Tel: 025-84390320
E-mail: wfqjaas@163.com, Tel: 025-84390320
本研究由国家转基因生物新品种培育科技重大专项(2018ZX08001-02B), 江苏省自然科学基金面上项目(BK20171326)和江苏省现代农业重点研发项目(BE2018388, BE2017368)资助。
This study was supported by the National Major Project for Developing New GM Crops (2018ZX08001-02B), the Jiangsu Province Natural Science Foundation (BK20171326), and the Jiangsu Province Key Research and Development Program (Modern Agriculture) (BE2018388, BE2017368).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20191014.1534.013.html

