OSAHS患者左心室功能的超声评价及其与血清炎症因子、氧化应激介质的相关性
童梦瑶 王鹏 李映霞
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是以睡眠时打鼾伴不同程度呼吸暂停的一类睡眠呼吸障碍性疾病,多见于中老年人群及肥胖人群[1]。呼吸暂停可引起低氧血症和高碳酸血症并增加高血压、冠心病、脑梗死等心脑血管事件的发生风险[2-3]。近年来有研究报道,OSAHS患者存在不同程度的心功能改变,低氧血症的存在一方面能够直接增强心肌做功并引起心肌肥厚、重构等改变,进而造成心功能的变化;另一方面能够引起内环境紊乱,增加儿茶酚胺及醛固酮等内分泌激素释放、增强炎症及氧化应激反应,进而也造成心功能的变化。为了明确OSAHS病情发展变化过程中的心功能情况及造成心功能变化的可能机制,本研究采用彩色多普勒超声对OSAHS患者的左心室功能进行评价并分析心功能与血清炎症因子、氧化应激介质的相关性。
资料与方法
一、资料
选择2016年4月-2018年12月期间我收治的OSAHS患者,纳入标准:(1)经多导睡眠监测确诊OSAHS;(2)首次确诊;(3)临床资料完整。排除标准:(1)有脑梗死、心肌梗死病史的患者;(2)合并肝肾功能不全的患者;(3)合并感染、恶性肿瘤的患者;(4)近期使用过呼吸兴奋剂或接受过气道正压通气的患者。根据OSAHS的严重程度将患者分为轻度组、中度组和重度组。轻度组共28例、AHI 5~20,男性18例、女性10例,年龄38~61岁、平均45.51±8.29岁;中度组共34例、AHI 20~35,男性23例、女性11例,年龄34~58岁、平均43.95±8.72岁;重度组共22例、AHI>35,男性15例、女性9例,年龄38~57岁、平均44.45±9.14岁。另取同期体检的健康者作为对照组,共40例,男性25例、女性15例,年龄35~60岁、平均49.51±8.33岁。四组间一般资料的比较无显著性差异(P>0.05)(见表1)。

表1 患者临床资料比较
与对照组比较,*P<0.05;与轻度组比较,aP<0.05;与中度组比较,bP<0.05
二、方法
1 左心室功能的超声评价方法 四组受试者均采用彩色多普勒超声诊断仪进行心超检查,探头频率1.5~4.0MHz,获得心尖四腔切面后测量左心室收缩末内径(LVSd)、左心室舒张末内径(LVDd)、左心室质量指数(LVMI)以及左心室射血分数(LVEF)。
2 血清炎症因子及氧化应激介质的检测方法 空腹状态下在含有促凝胶的生化采血管内采集四组受试者的肘静脉血5mL,静置后离心分离血清,采用上海西唐公司的酶联免疫吸附试剂盒检测肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)、白细胞介素(IL)-6、IL-8、IL-17、8-羟基脱氧鸟苷(8-OHdG)、髓过氧化物酶(MPO)的含量;采用南京建成研究所的硫代巴比妥酸试剂盒检测丙二醛(MDA)含量、羟胺法试剂盒检测锰-超氧化物歧化酶(Mn-SOD)含量、微板法试剂盒检测谷胱甘肽过氧化物酶(GSH)含量。
3 统计学方法 采用SPSS 22.0软件录入数据,计量资料的四组间比较采用单因素方差分析的方法,四组之间两两比较采用SNK-q检验的方法、相关性分析采用Pearson检验,P<0.05为差异有统计学意义。
结 果
一、四组间左心室功能的比较
轻度组、中度组和重度组患者的LVSd、LVDd、LVMI水平均明显高于对照组(P<0.05)且随着OSAHS病情加重,LVSd、LVDd、LVMI水平水平均明显增加(P<0.05);轻度组患者的LVEF水平与对照组比较无显著性差异(P>0.05),中度组和重度组患者的LVEF水平均明显低于对照组(P<0.05)。
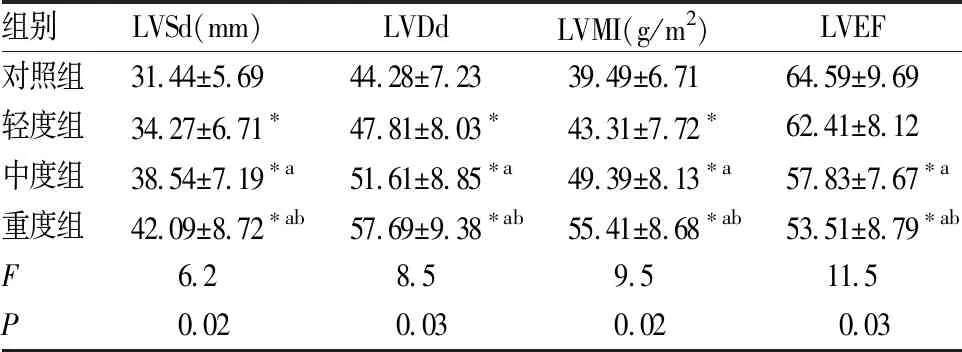
表2 四组间LVSd、LVDd、LVMI、LVEF的比较
注:与对照组比较,*P<0.05;与轻度组比较,aP<0.05;与中度组比较,bP<0.05
二、四组间血清炎症因子含量的比较
轻度组、中度组和重度组患者的血清TNF-α、MCP-1、IL-6、IL-8、IL-17含量均明显高于对照组(P<0.05)且随着OSAHS病情加重,血清TNF-α、MCP-1、IL-6、IL-8、IL-17含量均明显增加(P<0.05)。
三、 四组间血清氧化应激介质含量的比较
轻度组、中度组和重度组患者的血清MDA、8-OHdG、MPO含量均明显高于对照组,MnSOD、GSH含量均明显低于对照组(P<0.05)且随着OSAHS病情加重,血清MDA、8-OHdG、MPO含量均明显增加,MnSOD、GSH含量均明显降低(P<0.05)。
四、OSAHS患者左心室功能与血清炎症因子、氧化应激介质的相关性
OSAHS患者的LVEF水平与血清TNF-α、MCP-1、IL-6、IL-8、IL-17、MDA、8-OHdG、MPO含量呈负相关,相关系数r分别为-0.231、-0.187、-0.177、-0.261、-0.203、-0.313、-0.197、-0.276;与血清MnSOD、GSH呈正相关,相关系数r分别为0.256、0.190。
讨 论
OSAHS是心脑血管事件的独立危险因素,同时也会对心肌舒缩功能造成应[4]。本研究通过彩色多普勒超声对左心室的结构和功能进行了评价。LVSd、LVDd、LVMI反应左心室结构,轻度组、中度组及重度组患者的LVSd、LVDd、LVMI均明显升高,说明OSAHS患者存在明显的心室肌肥厚及心腔扩大且这一变化从OSAHS病情的轻度阶段已经出现,这可能与OSAHS患者体内缺氧促进心肌做功有关[5-7]。LVEF反应左心室功能,本研究中轻度组患者的LVEF无明显变化,而中度组及重度组患者的LVEF明显降低,说明轻度OSAHS患者虽然出现了左心室结构的变化、但其收缩功能并未发生明显改变,这与左心室做功增加后的自身代偿有关;而中重度OSAHS患者的左心室收缩功能已经发生了明显变化,这与左心室做功增加无法彻底代偿左心室的肥厚及心腔的扩大,因而出现了功能变化。
OSAHS患者体内持续存在的低氧血症能够刺激炎症反应及氧化应激反应的激活,多种炎症因子和氧化应激介质在该过程的大量释放能够造成心肌重构、影响心肌舒缩功能[8-9]。TNF-α、MCP-1、IL-6、IL-8、IL-17是具有促炎及趋化作用的细胞因子,能够促进多种炎症细胞向心肌内浸润并介导炎症反应的级联放大[10-12]。MPO由活化的中性粒细胞、单核巨噬细胞分泌,能够催化氧自由基的生成[13];氧自由基攻击细胞中的脂质、核酸后产生MDA、8-OHdG并造成细胞结构和功能损伤,同时MnSOD、GSH等具有抗氧化作用的代谢酶在清除氧自由基的过程中被大量消耗、含量降低[14-15]。本研究对OSAHS患者体内炎症因子及氧化应激介质的分析显示:轻度组、中度组和重度组患者的血清TNF-α、MCP-1、IL-6、IL-8、IL-17、MDA、8-OHdG、MPO含量均明显升高,MnSOD、GSH含量均明显降低且随着OSAHS病情加重、上述血清指标的变化更加明显,说明OSAHS患者体内的炎症及氧化应激反应均呈过度激活的状态,并且随着OSAHS病情加重、炎症及氧化应激反应的激活程度也加剧。

表3 四组间血清TNF-α、MCP-1、IL-6、IL-8、IL-17的比较(pg/mL)
注:与对照组比较,*P<0.05;与轻度组比较,P<0.05;与中度组比较,bP<0.05
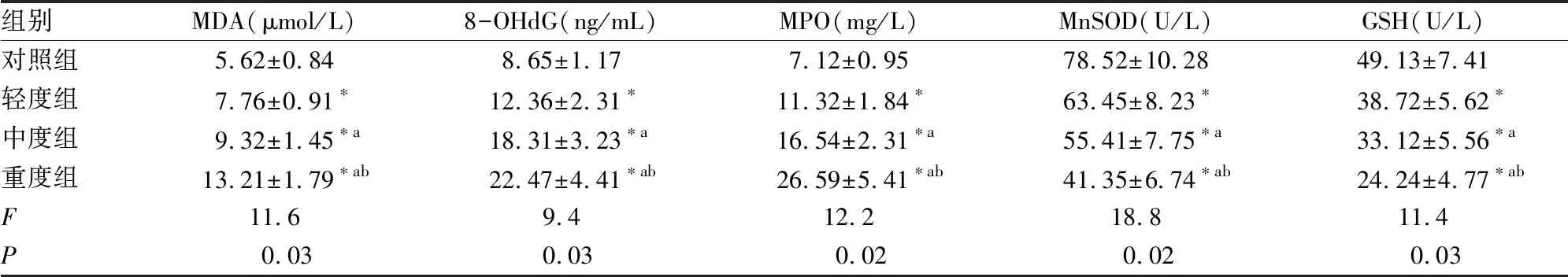
表4 四组间血清MDA、8-OHdG、MPO、MnSOD、GSH的比较
注:与对照组比较,*P<0.05;与轻度组比较,aP<0.05;与中度组比较,bP<0.05
在明确OSAHS患者存在左心室功能的变化及炎症反应、氧化应激反应过度激活后,本研究进一步分析炎症及氧化应激反应与心功能的相关性,LVEF水平与血清TNF-α、MCP-1、IL-6、IL-8、IL-17、MDA、8-OHdG、MPO含量呈负相关,与血清MnSOD、GSH呈正相关,说明OSAHS患者体内炎症及氧化应激反应的激活与左心室功能的改变有关。近年来,炎症反应、氧化应激反应与心功能改变、心肌重构的关系已经在高血压、心肌梗死等多种疾病中被证实。一方面,炎症及氧化应激刺激蛋白酶及转化生长因子等释放、促进心肌细胞间质内胶原代谢紊乱,能够导致心肌重构并影响心肌舒缩做功;另一方面,炎症及氧化应激也能直接损害心肌细胞并导致心功能减退[16-17]。结合本研究中炎症反应、氧化应激反应与左心室功能相关性的分析说明,OSAHS患者体内炎症反应、氧化应激反应的激活可能是造成左心室功能减退的机制之一。
综上所述,中重度OSAHS患者存在左心室功能异常且炎症反应、氧化应激反应的激活与左心室功能的改变有关。

