地黄梓醇对椎间盘髓核细胞NLRP3 炎性体的调控作用
张 鹏 尹志良朱献忠刘 康冯 刚*
(1.西南医科大学,四川 泸州 646000; 2.成飞医院,四川 成都 610091; 3.南充市中心医院·川北医学院第二临床医学院,四川 南充 637000)
椎间盘病变为临床骨科常见疾病之一,因其病理牵延性、严重损伤性及其继发炎性已逐渐被临床所重视[1]。目前,椎间盘病变的临床病理机制尚未完全弄明白,现有的相关性结论大多与患者年龄、遗传、生物力学、生存环境等因素有关;近年来逐渐有学者提出了不同学说,从分子生物学(氧化应激反应、免疫炎症)、机械力学、细胞衰老等方面阐述了其观点[2]。椎间盘退行性改变的病理学基础是病灶部位髓核细胞减少引起的胞外基质合成减少和成分改变,继发细胞快速凋亡[3],而过度凋亡是椎间盘髓核细胞减少的直接原因[4]。研究表明,细胞凋亡与胞内氧化应激反应有直接相关性[5],因此,如何提高髓核细胞对氧化应激反应引起凋亡的防御能力,降低髓核细胞凋亡率成为了近年来治疗椎间盘病变领域的基础研究热点[6]。地黄Rehmannia glutinosa为玄参科地黄属植物,其味甘、苦,性寒,块根为常用中药,素有清热生津、益精填髓之功效。对于地黄药效物质基础的研究比较明确的为环烯醚萜类,而其中又以梓醇最为突出。研究表明,地黄梓醇等成分具有调节免疫、抗骨质疏松、抗炎、神经保护、抗糖尿病等多种药效学,以及抗炎、抗氧化、抗凋亡等多种生物学效应[7-8],但目前对其抗椎间盘髓核细胞退变尚无系统全面的研究。本实验检测了地黄梓醇在体外对H2O2刺激髓核细胞的影响,为加快该成分应用于临床相关疾病的治疗提供实验依据。
1 材料
1.1 动物 雄性SD 大鼠(4~6 周龄),购于北京维通利华实验动物技术有限公司,动物生产许可证号SCXK(京)2016-0011。
1.2 试剂与药物 地黄梓醇,质量分数>98%(南京道斯夫生物科技有限公司,批号180612Z)。改良 1640 培养基(美国 Gibco 公司,批号1848026);青霉素、链霉素混合液(碧云天生物技术有限公司,批号C0222);CCK-8 细胞活力试剂盒(日本Dojindo 公司,批号GB707);逆转录及qPCR 试剂盒(北京全式金生物技术有限公司,批号H31203);抗TXNIP、IL-1β、NF-κB p65(英国Abcam 公司,货号分别为ab188865、ab8320、ab7970);抗NLRP3、caspase-1(美国STC 公司,批号分别为13158、sc-514);TRITC 标记的兔抗山羊二抗、FITC 标记的羊抗兔二抗(北京中杉金桥生物技术有限公司,批号分别为119343、116128));T-SOD、MDA、IL-1β(北京安迪华泰生物科技有限公司,批号分别为E-11084、E-10376、E-10083);细胞凋亡检测试剂盒Annexin V-FITC/PI(碧云天生物技术有限公司,批号C3062M)。
1.3 仪器 多功能酶标仪(美国Molecular Devices公司);高速低温离心机(美国Thermo Fisher 公司);CO2 培养箱(日本Sanyo 公司);倒置相差显微镜(日本Nikon 公司);EVOS FL 无目镜荧光倒置显微镜(美国AMG 公司)。
2 方法
2.1 细胞原代培养 SD 大鼠用大剂量麻醉药物处死,无菌条件下小心完整分离腰椎椎间盘,无菌PBS 冲洗干净,小心去除非腰椎间盘组织,超净工作台上在解剖显微镜下分离椎间盘中凝胶状髓核组织,置于无菌培养皿中并剪碎成1 mm3组织碎块,转入培养瓶中,加入2 倍量0.1% Ⅱ型胶原酶,37 ℃恒温振荡消化直至块状组织基本消失时终止消化,取上清,1 400 r/min 离心5 min,弃上清加入完全培养液,置于37 ℃、5% CO2培养箱中进行培养,倒置显微镜下每天观察髓核细胞贴壁和生长情况,每3 d 更换1 次培养基,除去未贴壁细胞,继续培养贴壁细胞。髓核细胞形成单层后,0.25%胰蛋白酶(含EDTA)进行消化传代,取第3 代细胞进行后续实验。
2.2 CCK-8 测定梓醇安全浓度及H2O2作用最佳浓度 取对数生长期椎间盘髓核细胞,收集细胞后将细胞浓度调整为2×105/mL 并接种于96 孔板中,每孔100 μL,37 ℃、5% CO2培养箱中24 h,让其贴壁。将细胞培养板孔内的培养液吸出,设置地黄梓醇 7 个组(40、20、10、5、2.5、1.25、0 μmol/L)H2O28 个组(1 000、500、250、125、62.5、31.25、15.625、0 μmol/L)样品各100 μL,每组各设3 个复孔,实验重复至少3 次。细胞按照上述方法处理后分别培养24、48 h,进行细胞存活率测定。
2.3 分组 根据安全浓度测试结果,取对数期生长细胞随机分为空白组、模型组(500 μmol/L H2O2)、地黄梓醇(5 μmol/L)组、地黄梓醇(10 μmol/L)组。空白组不做任何处理;模型组用500 μmol/L H2O2刺激24 h;地黄梓醇组用不同浓度成分预处理1 h 后,500 μmol/L H2O2刺激24 h。
2.4 流式细胞术检测髓核细胞凋亡 调整细胞浓度为1×105/mL 后接种于6 孔板,每孔2.5 mL,待细胞贴壁生长至70%左右时按“2.3”项下分组处理,24 h 后用不含EDTA 的胰酶消化髓核细胞,转入离心管中,4 ℃、1 500 r/min 离心5 min,用预冷的PBS 洗涤细胞2 次,4 ℃、1 500 r/min 离心5 min,吸弃PBS,加入100 μL 1×Binding Buffer 重悬细胞,每管加入5 μL AnnexinV-FITC 和5 μL PI Stainning Solution 后轻轻混匀,在避光、室温条件下孵育15 min,加入400 μL 1×Binding Buffer 混匀。上机检测。
2.5 测定细胞上清液MDA、T-SOD、IL-1β 水平 调整细胞浓度为2×105/mL 后接种于96 孔板中,每孔100 μL,培养箱培养中24 h 后,根据细胞分组处理细胞,收集上清液进行T-SOD、MDA、IL-1β 水平测定,具体步骤参见试剂盒说明书。每组各设3 个复孔,实验重复至少3 次。
2.6 实时荧光定量PCR 测定TXNIP、NLRP3、casepase-1、IL-1βmRNA调整细胞浓度 为1×105/mL,接种于6 孔板,培养箱中培养24 h 后根据细胞分组处理,Trizol 法提取mRNA,置于PCR扩增仪中进行mRNA 扩增,收集各组数据,并且进行统计学分析,2-△△Ct法计算各基因的相对表达。引物序列见表1,PCR 扩增反应条件为预变性(95 ℃,2 min),变性(95 ℃,15 s),退火(57 ℃,15 s),延伸(72 ℃,1 min),55 个循环。

表1 引物序列Tab.1 Primer sequences
2.7 Western blot 检测蛋白表达 调整细胞浓度为1×105/mL,每孔2 000 μL 接种于6 孔板,培养箱中培养24 h 后按“2.3”项下分组处理,收集细胞,提取细胞总蛋白,BCA 试剂盒定量后100 ℃变性5 min。SDS-PAGE 凝胶电泳分离并转移至PVDF 膜。5% 的 BSA 室温封闭 1 h 后一抗(1∶800)4 ℃孵育过夜。次日复温后TBST 清洗3次,加入辣根过氧化物酶标记的二抗,室温孵育1 h,PBS 清洗。室温下加入ECL 发光液,凝胶成像系统曝光显影,Quantity One 软件统计灰度值,计算蛋白相对表达量。实验重复至少3 次。
2.8 免疫荧光法测定NLRP3 和TXNIP 蛋白表达 调整细胞浓度为1×105/mL,每孔600 μL 接种于24 孔板,培养箱中培养24 h 后根据细胞分组处理,PBS 洗涤3 次后弃上清液,4%甲醛500 μL固定细胞15 min,滴加0.3% TritonX-100 打孔,5%BSA 封闭。滴加一抗,4 ℃放置过夜后复温,滴加荧光二抗,37 ℃避光孵育,甘油封片,上机观察并拍照。
2.9 统计学分析 采用SPSS19.0 软件进行处理,计量资料以(±s)表示,组间比较采用单因素方差分析,假定方差齐性采用LSD 法检验,未假定方差齐性采用Dunnett's T3 法检验,偏态分布的计量资料组间比较采用Kruskal-wallis 秩和检验。以P<0.05为差异有统计学意义。
3 结果
3.1 地黄梓醇、H2O2对大鼠髓核细胞毒性的影响 根据《美国药典》中细胞相对增殖率与细胞毒性分级的关系,500 μmol/L H2O2作用24 h 后细胞存活率为56%左右,可用此浓度完成后续实验。地黄梓醇作用24、48 h,浓度为1.25~20 μmol/L时,细胞毒性分级≤1 级。见图1。

图1 地黄梓醇、H2O2对大鼠髓核细胞毒性的影响Fig.1 Effects of catalpol and H2O2on the cytotoxicity of rat nucleus pulposus cells
3.2 地黄梓醇对H2O2刺激后大鼠髓核细胞凋亡的影响 AnnexinV-FITC/PI 染色结果显示,H2O2刺激后,细胞凋亡率上调(P<0.01);地黄梓醇预处理髓核细胞后,H2O2刺激所引起的细胞凋亡被抑制(P<0.01)。见图2。
3.3 地黄梓醇对H2O2刺激后大鼠髓核细胞上清液T-SOD、MDA、IL-1β 水平的影响 与模型组比较,地黄梓醇能上调大鼠髓核细胞上清液T-SOD水平(P<0.05),下调MDA、IL-1β 水平(P<0.05,P<0.01)。见图3。
3.4 地黄梓醇 对TXNIP、NLRP3、caspase-1、IL-1βmRNA 表达的影响 与空白组比较,模型组细胞TXNIP、NLRP3、caspase-1、IL-1βmRNA 表达升高(P<0.05,P<0.01);与模型组比较,5、10 μmol/L 地黄梓醇预处理后抑制了TXNIP、NLRP3、caspase-1、IL-1βmRNA 表达(P<0.05,P<0.01),并且以10 μmol/L 作用更强。见图4。
3.5 地黄梓醇 对 TXNIP、NLRP3、caspase-1、IL-1β蛋白表达的影响 与空白组比较,模型组TXNIP、NLRP3、caspase-1、IL-1β 蛋白表达升高(P<0.01);与模型组比较,地黄梓醇(5、10 μmol/L)组TXNIP、NLRP3、caspase-1、IL-1β蛋白表达降低(P<0.05,P<0.01),见图5。免疫荧光结果显示,与空白组比较,模型组NLRP3、TXNIP 表达均上调,地黄梓醇(10 μmol/L)组细胞两者表达降低,见图6。
3.6 地黄梓醇对NF-κB p65 蛋白表达的影响 与对照组比较,模型组NF-κB p65 蛋白表达升高(P<0.05);与模型组比较,10 μmol/L 地黄梓醇能抑制NF-κB p65 蛋白表达(P<0.05)。见图7。
4 讨论

图2 地黄梓醇对H2O2刺激后大鼠髓核细胞凋亡的影响Fig.2 Effects of catalpol on apoptosis of rat nucleus pulposus cells stimulated by H2O2
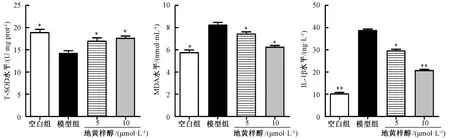
图3 地黄梓醇对H2O2刺激后大鼠髓核细胞上清液T-SOD、MDA、IL-1β 水平影响Fig.3 Effects of catalpol on levels of T-SOD,MDA and IL-1β in supernatant of rat nucleus pulposus cells stimulated by H2O2
目前椎间盘退行性病变的治疗策略主要以减轻临床症状为主,包括保守治疗和外科手术,如果保守治疗失败,通常会选择通过外科手术来减轻疼痛[9],然而,这些治疗措施仅是对临床症状的改善,而不是彻底解决病因。随着临床技术的不断进步,治疗椎间盘退行性疾病的药物、物理与手术疗法有很大进展,但仍然无法避免椎间盘退行性变发生,无法从根本上解决患者痛苦[10]。大量研究显示,椎间盘退变与髓核细胞的凋亡密切相关,而氧化应激环境是造成细胞凋亡的重要环节[11]。本研究采用H2O2作用于髓核细胞后,流式细胞仪检测细胞凋亡率,结果显示细胞大量凋亡,而地黄梓醇能够明显降低其凋亡率。
SOD 被称作机体抗氧化的第一道防线,其主要作用是清除超氧阴离子自由基()保护细胞免受损伤[12-13],可避免因浓度过高引起的不良反应及损伤。MDA 是膜脂过氧化最重要的产物之一,间接反映了机体细胞受自由基攻击的严重程度[14]。本实验中H2O2导致髓核细胞上清T-SOD水平降低,MDA 水平升高,加入地黄梓醇预处理后能明显升高髓核细胞清T-SOD 水平,降低MDA水平,表明地黄梓醇能够通过降低细胞氧化应激反应从而实现抗凋亡作用。

图4 地黄梓醇对H2O2刺激后大鼠髓核细胞TXNIP、 NLRP3、 caspase⁃1、 IL⁃1β mRNA 表达的影响Fig.4 Effects of catalpol on TXNIP,NLRP3,caspase⁃1 and IL⁃1β mRNA expression in rat nucleus pulposus cells stimulated by H2O2
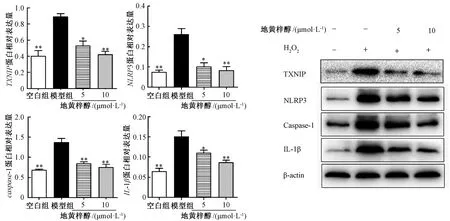
图5 地黄梓醇对H2O2刺激后大鼠髓核细胞TXNIP、NLRP3、caspase-1、IL-1β 蛋白表达的影响Fig.5 Effects of catalpol on the expression of TXNIP,NLRP3,caspase-1 and IL-1β in rat nucleus pulposus cells stimulated by H2O2

图6 地黄梓醇对H2O2刺激大鼠髓核细胞NLRP3 和TXNIP 的表达影响Fig.6 Effects of catalpol on the expression of TXNIP and NLRP3 in rat nucleus pulposus cells stimulated by H2O2
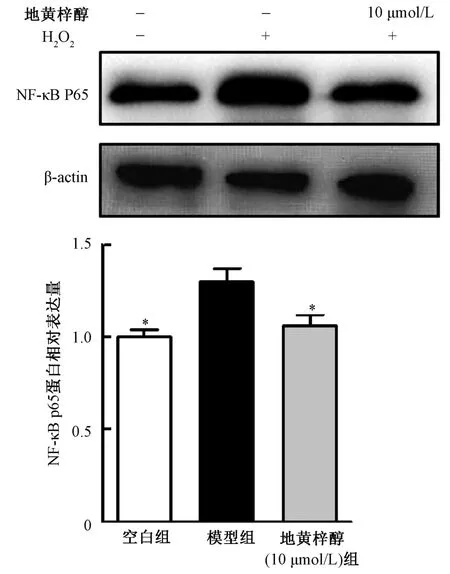
图7 地黄梓醇对H2O2刺激后大鼠髓核细胞NF-κB 蛋白表达的影响Fig.7 Effects of catalpol on the expression of NK-κB in rat nucleus pulposus cells stimulated by H2O2
NLRP3 炎性复合体是固有免疫的重要组成部分,活化的共同上游机制包括ROS 产生、溶酶体破裂、细胞内K+外流[15-16]。MDA、T-SOD 水平反映机体脂质损伤程度,脂质损伤的发生常伴随着ROS 的生成,TXNIP 作为内源硫氧还蛋白抑制剂,能够抑制硫氧还蛋白的活性氧清除功能,导致细胞氧化应激反应,而ROS 的过度产生可以上调TXNIP 的表达,进而激活NLRP3 炎性小体[17-18]。本研究中,暴露于氧化应激反应中的髓核细胞TXNIP、NLRP3 炎性体表达增加,而地黄梓醇可明显降低此作用。NLRP3 是一种复合体支架,在内外源性刺激因素作用下进行低聚化后招募procaspase-1 和ASC 形成NLRP3 炎性小体,随后进一步激活caspase-1,进而促进IL-1β 的成熟和分泌[19]。IL-1β 形成后,可以通过招募CD45+Grhigh中性粒细胞进一步促进炎症因子的释放,以及与TNF-α 协同作用激活NF-κB 通路,引起纤维蛋白原样2 释放增加的双重作用,引起细胞凋亡和纤维蛋白沉积[20]。本研究采用ELISA、Western blot、PCR 等手段检测casepase-1、IL-1β、NF-κB 的变化情况,观察到H2O2作用髓核细胞后出现髓核细胞casepase-1 表达、IL-1β 释放、IκBα 磷酸化,导致NF-κB 释放亚基p65 表达明显增加,而地黄梓醇可明显抑制上述作用,表明它对NLRP3 炎性体激活引起的下游产物增加有明显抑制作用。
综上所述,地黄梓醇对H2O2诱导的髓核细胞凋亡具有保护作用,可能与调控ROS/NLRP3/IL-1β通路轴有关,可抑制活性氧簇激活NILRP3炎性体,引起IL-1β释放增加,导致NF-κB 通路被激活,从而发挥抗凋亡作用。因此,地黄梓醇有望成为阻止髓核细胞进一步退变的理想抗凋亡剂。

