肺腺癌组织中Trophinin 相关蛋白的表达及临床病理联系
雷 宇,黄 山,路 燕
肺腺癌是非小细胞肺癌常见的病理类型。其发病隐匿,发展迅速,确诊时约有超过一半的患者已失去了根治性手术机会。晚期肺癌的治疗方式除了传统的放化疗,还包括靶向治疗以及近年来兴起的程序性细胞死亡蛋白-1(programmed Cell Death Protein-1,PD-1)抑制剂免疫治疗,逐渐形成了根据不同的生物标志物选择不同治疗的精准治疗模式[1]。这些治疗方式使得一部分患者获了较好的疗效,但是随之而来的获得性耐药鞭策人们继续搜寻新的与肿瘤发生、发展或治疗相关的生物标志物。Trophinin 相关蛋白(trophinin associated protein, TROAP), 也被称为Tastin,TROAP基因的功能研究并不深入,目前被认为可能与胚胎发育时期的着床相关,但机制尚未完全明确[2]。
现通过对多个公共数据库的发掘和整理,分析TROAP的差异表达及其对患者预后的影响。同时检测30例肺腺癌患者肿瘤组织与癌旁组织中TROAP的表达,旨在探究其与肺腺癌发生发展的关系及其与患者临床病理特征之间的联系。
1 材料与方法
1.1 大数据采集分析
1.1.1GEO数据库 对由美国国立生物技术信息中心建立的GEO数据库中关于非小细胞肺癌的RNASeq数据集进行检索,对2016年6月发布的GSE81089数据集和2012年9月发布的GSE40419数据集进行下载,随后应用Cufflinks软件对原始数据进行比对,标准化,通过质控后计算相对表达量FPKM值,分析TROAP基因表达的差异性,并计算校正P值。同时还对发布于2016年5月的GSE74706数据集和发布于2010年5月的GSE19188数据集中的表达谱芯片数据进行下载,分析TROAP基因对应的探针所测定的mRNA表达的相对水平,经质控检验及校准化后,分析该基因差异表达并计算校正P值。
1.1.2GENT数据库 韩国国立生物科学与生物技术研究所建设的GENT数据库中主要收录了经U133Plus2和U133A表达谱芯片检测的347 264例样本中的基因表达情况。该数据集中的样本来源广泛,基本上包含了大部分肿瘤类型与对应的正常组织。选取U133Plus2芯片类型进行统计分析,对比TROAP基因在不同组织中的表达变化情况。
1.1.3TCGA数据库 由美国国家癌症和肿瘤研究所和国家人类基因组研究所联合建立的TCGA数据库包含了大部分人类常见的肿瘤类型数据,更重要的是其包含部分患者的预后随访数据,可以综合患者生存信息进行分析。选取TCGA数据库中的肺腺癌RNASeq数据集(LUAD-Illuminal HiSeq)进行分析,按照前述方法通过RNASeq数据计算TROAP表达的相对丰度,结合患者随访信息,绘制Kaplan-Meier生存曲线。
1.2 病例资料经医院伦理委员会讨论同意,同时取得患者知情同意后,筛选2018年12月~2019年6月在安徽医科大学第一附属医院就诊并经手术或经皮肺穿病理诊断确诊的肺腺癌患者30例。其中男性14例、女性16例,年龄33~80(56.60±11.49)岁。所有入选病例均无其他肿瘤病史,均无心、肝、肾等重要脏器的严重器质性病变。入选病例的临床资料相对完整,按照国际肺癌研究协会(IASLC)第八版分期标准进行分期,其中Ⅰ期:10例;Ⅱ期:2例;Ⅲ期:4例;Ⅳ期:14例。
1.3 检测方法采用免疫组化法进行检测,每例入选病例选取肿瘤组织与癌旁正常肺组织制作石蜡切片。烤箱65 ℃干烤过夜,二甲苯脱蜡,梯度乙醇溶液浸泡。经过柠檬酸盐高温修复后,过氧化氢溶液(3%)孵育30 min,PBS清洗后滴加(1 ∶500)稀释后的一抗(兔抗人TROAP多克隆抗体,Novus Biological USA),4 ℃孵育过夜。PBS清洗后滴加(1 ∶1 000)稀释后的二抗孵育60 min。PBS清洗后滴加DAB工作液显色,时间约为30 s,苏木精复染后梯度乙醇溶液脱水,二甲苯透明后中性树胶封片。PBS 溶液代替一抗作为阴性对照。
1.4 结果判读由2位经验丰富的肿瘤病理医师独立阅片并拍照。TROAP定位于细胞质中,通过免疫染色着色后呈现黄褐色。每张切片随机选取5个视野进行读片,判定细胞免疫组化染色的颜色强度。细胞免疫着色为:未染色、淡黄、黄色、黄褐分别计0、1、2、3分。同时判定免疫染色阳性细胞百分比(0%~100%)。据此计算TROAP表达的组织学得分(histological Score, H-Score)[3]。H-Score=(1×着色强度为1的细胞百分比)+(2×着色强度为2的细胞百分比)+(3×着色强度为3的细胞百分比)。

2 结果
2.1 数据库结果分析
2.1.1GEO数据库分析结果 通过对GEO数据库中多组RNASeq数据和表达谱芯片数据的下载、整理和分析。发现TROAP基因在多个有关非小细胞肺癌的数据集中,肺腺癌组织内的表达与正常肺组织相比明显升高(表1),差异有统计学意义。
2.1.2GENT数据库分析结果 对GENT数据库的分析发现,在U133Plus2芯片数据集中的347 264个样本数据中,TROAP在肺癌、卵巢癌、黑色素瘤、宫颈癌、膀胱癌、甲状腺癌、肝癌、大肠癌等多种实体肿瘤与其对应的正常组织中的表达也具有明显差异(图1)。
2.1.3TCGA数据库分析结果 对TCGA数据库中患者生存数据的分析发现(图2),在肺腺癌RNAseq(LUAD-Illuminal HiSeq)数据集的564例肺腺癌患者中,TROAP基因高表达组(280例)的中位生存是41.2个月,而低表达组(284例)的中位生存是54.2个月,组间差异具有统计学意义(P=0.004, Log-rank test statistics=8.181),提示该基因高表达的肺腺癌患者较低表达者生存期短,预后不良。

表1 TROAP基因在肺腺癌与正常肺组织中的表达差异情况
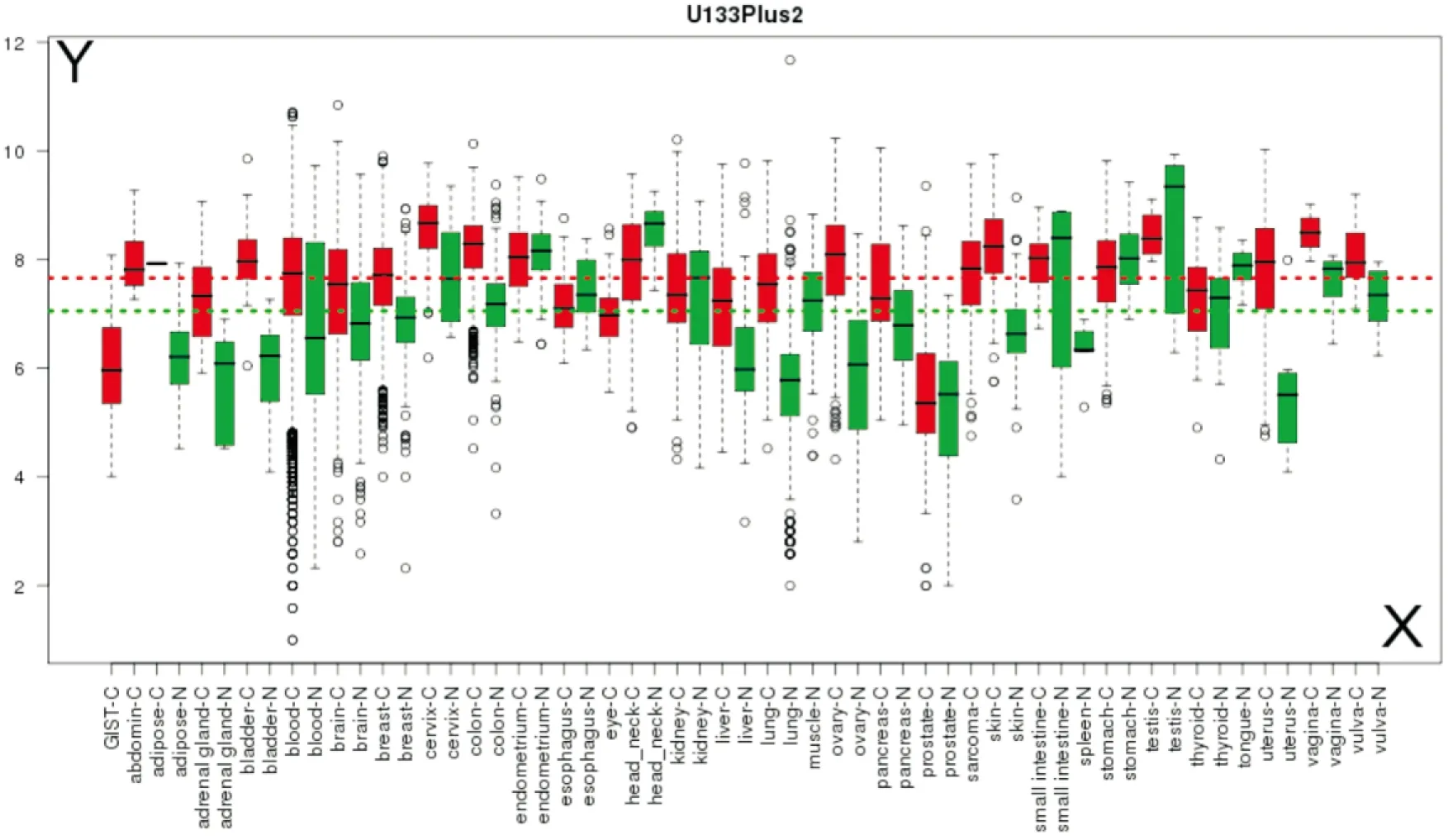
图1 TROAP基因在多种肿瘤与对应正常组织中的表达差异
Y轴:表达谱芯片检测TROAP基因表达丰度的对数值(Log2);X轴:各种肿瘤与其对应的正常组织,C-肿瘤、N-正常组织
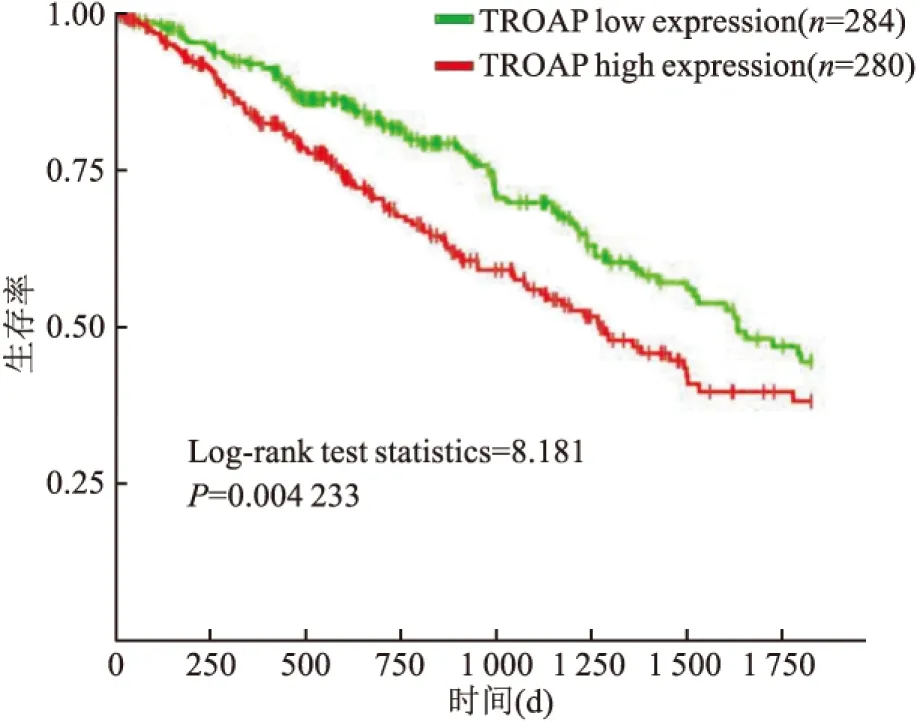
图2 TROAP基因的表达丰度与肺腺癌患者生存的关系(Kaplan Meier生存曲线)
2.2 肺腺癌及癌旁肺组织中TROAP的表达情况免疫组化染色显示在肺腺癌组织中,该基因存在高表达,免疫染色呈黄褐色,主要分布于细胞质中(图3A),这与TROAP理论上的细胞定位一致。而在癌旁正常肺组织中,免疫染色较淡,提示其在正常肺组织中表达量较低(图3B)。
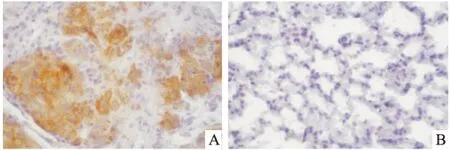
图3 免疫组化检测TROAP在肺腺癌与癌旁正常肺组织中的表达 ×400
A:TROAP在肺腺癌组织中表达量较高,主要定位于细胞质中;B:TROAP在癌旁正常肺组织中无明显表达
对30例肺腺癌患者的肿瘤-癌旁配对组织进行免疫组化染色,计算H-Score。结果显示(图4A)在30对样本中,肿瘤组织TROAP的H-Score比癌旁正常组织升高的有25对(83.3%),其中明显升高(H-Score升高2倍以上)的有11对(36.7%)。
对TROAP表达进行统计分析发现(图4B),30例肺腺癌组的H-Score为150.00(100.00,180.00),30例癌旁正常肺组织的H-Score为80.00(58.75,125.00)。通过Wilcoxon配对样本的秩和检验发现,与癌旁正常肺组织相比,肺腺癌组织中的TROAP表达的H-Score明显升高,差异有统计学意义(Z=-4.198,P=2.69×10-5)。
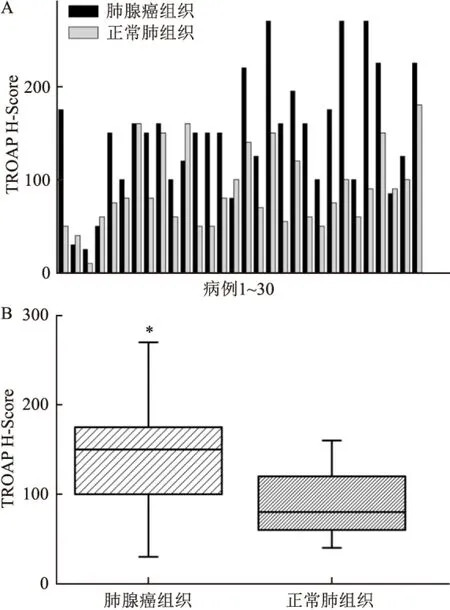
图4 TROAP H-Score 在肺腺癌与癌旁正常肺组织中的比较
A:30对肿瘤-癌旁组织中的TROAP H-Score分布情况;B:肺腺癌组与癌旁正常肺组织组中的TROAP H-Score,与正常肺组织相比,*P<0.05
2.3 TROAP的表达与肺腺癌患者的临床病理联系结果如表2所示:TROAP表达的H-Score在肿瘤分期较晚(Ⅲ~Ⅳ期)的患者中明显高于分期较早(Ⅰ~Ⅱ期)的患者(Z=-2.064,P=0.039);在有远处转移(M1)者中明显高于无远处转移(M0)者(Z=-2.152,P=0.031);在细胞增殖相关蛋白Ki-67高表达(≥15%)的患者中明显高于低表达(<15%)的患者(Z=-2.728,P=0.006),差异均有统计学意义。而在患者其他临床病理特征(性别、年龄、T分期、N分期、有无吸烟史、有无胸腔积液以及EGFR突变状态)之间的差异无统计学意义。
3 讨论
TROAP基因的结构和功能于1995年由Fukuda et al[2]首次报道,该团队在研究滋养层细胞与子宫内膜细胞的黏附机制时发现将该基因与TRO基因(Trophinin)的cDNA同时转染COS细胞后,原本没有黏附能力的COS细胞获得了黏附子宫内膜细胞的能力。而单独转染其中之一以后,COS细胞则无法获得黏附能力。并发现TROAP与TRO基因的表达高峰与胚胎着床的时间窗一致,推测其可以促进胚胎细胞增殖以及滋养层细胞侵入子宫内膜的过程[4-5]。在正常组织中,该基因在睾丸、骨髓、小肠、胸腺和胎儿肝脏中表达量较高,而在其他绝大部分正常组织中表达量低或缺失[6]。然而TROAP基因在肿瘤组织中的表达和作用机制却鲜有报道。一些小样本研究提示该基因在肝细胞癌组织中高表达,并推测其表达丰度影响患者的预后[7-8]。

表2 TROAP在肺腺癌组织中的表达与患者
本研究分析了多个公共数据库,显示TROAP基因在肺腺癌组织中的表达较正常组织明显升高。在其他多种实体瘤中也具有类似表达特征。该基因的表达丰度与肺腺癌患者的生存相关。高表达TROAP基因的肺腺癌患者生存期较低表达者明显缩短。提示该基因很可能参与肿瘤发生、细胞增殖和侵袭,并且其表达水平影响肺腺癌患者的生存,可能作为潜在的肺腺癌发病、治疗以及判断预后的生物标志物。
肺腺癌患者TROAP表达免疫组化染色结果提示:该基因在肺腺癌患者肿瘤组织中的表达明显高于癌旁正常肺组织。这一结果与上述多个公共数据库分析得出的结果相吻合。提示该基因可能参与了肺腺癌的发生过程。在肺腺癌患者中,TROAP基因的表达在不同疾病分期、是否存在远处转移以及不同Ki-67表达中存在显著差异。患者疾病分期晚、存在远处转移和Ki-67高表达者肿瘤组织中的TROAP含量高。Ki-67与细胞分裂活跃程度正相关,表示肺腺癌细胞的增殖速度[9]。提示TROAP表达越高的患者,肿瘤增殖速度越快,越容易出现远处转移,同时肿瘤分期也越晚。
就具体分子机制而言,目前的研究[10]表明TROAP通过与TRO和Bystin形成复合物而被激活,促进滋养层细胞的快速增殖并侵入子宫内膜基质中,其分子机制可能与细胞膜表面erbB4受体酪氨酸激酶的异常活化有关。而恶性肿瘤的侵袭和转移以及快速增殖的行为恰恰类似于胚胎发育和着床过程中滋养层细胞与子宫内膜细胞的黏附,侵入子宫内膜基质以及随后的迅速增殖。然而近年来该基因在肿瘤中的机制研究较少,尚待深入探索。一些体外研究[11-12]显示下调该基因后,肿瘤细胞的增殖和迁移能力受到抑制,可能与WNT3/survivin信号通路的调控有关。此外还有少量研究表明,TROAP基因可能与细胞有丝分裂过程中纺锤体的形成有关,其缺失后会造成细胞分裂时产生多极纺锤体,然而机制尚不十分明确[13]。
本研究还分析了TROAP的表达与患者EGFR突变状态的关系,发现该基因的表达与患者EGFR突变状态无明显关联,提示该基因的作用可能是独立于EGFR这一著名肺癌驱动基因的。也就是说患者经过针对EGFR突变基因的靶向治疗出现耐药后,有望针对TROAP设计靶向治疗药物而获得一定的疗效。

