日本米虾胚胎发育及离体孵化*
曹林泉 秦 政 姜玉声 刘 鑫 李晓东 林 源 黄楷涛 刘 胥
日本米虾胚胎发育及离体孵化*
曹林泉1秦 政1姜玉声1①刘 鑫1李晓东2林 源3黄楷涛1刘 胥2
(1. 大连海洋大学水产与生命学院 大连 116023;2. 盘锦光合蟹业有限公司研发中心 盘锦 124200;3. 辽宁省水产苗种管理局 大连 116015)
本研究采用自制离体孵化装置,对日本米虾()不同发育期胚胎进行离体孵化研究,结果显示,水温为25.5℃时,日本米虾受精卵孵化大约需要25 d,发育积温为637.5℃。胚胎发育历经受精卵、卵裂期、囊胚期、原肠胚期、前无节幼体期、后无幼体期、前溞状幼体期和膜内溞状幼体期8个时期。各期离体胚胎均能孵化出幼体,膜内溞状幼体期离体胚胎孵化率最高,为(80.7±2.4)%,非离体孵化的对照组为(79.1±4.9)%,二者差异不显著;卵裂期离体胚胎孵化率最低,为(28.2±2.6)%,与对照组差异显著。各组离体胚胎所孵化出的Ⅰ期(ZⅠ)和Ⅱ期溞状幼体(ZⅡ)的变态率无显著差异。温度对日本米虾前溞状幼体期胚胎离体孵化影响显著,在15.0℃~32.5℃范围内,随水温升高孵化时间逐渐缩短,15.0℃时,前溞状幼体离体孵化时间为(436.8±124.8) h,32.5℃时缩短至(228.0±88.8) h,但温度高于29.0℃时,孵化出的幼体变态率开始下降。本研究可为日本米虾繁殖生物学及甲壳动物胚胎离体孵化技术研究提供参考。
日本米虾;胚胎发育;离体孵化;温度
日本米虾(),又称大和藻虾、珍珠虾,隶属于软甲纲(Malacostraca),十足目(Decapoda),匙指虾科(Atyidae),米虾属()。其习性温和,体色透明,喜食藻类和有机碎屑,具有洄游习性,对盐度适应性强,易于饲养,常作为水族箱中的“清道夫”以及生态学与环境学研究的实验材料(Tlusty, 2002; 赵朝阳等, 2012; 高淑娇, 2012; 蔡生力等, 2006; 李帆, 2007)。近年来,日本米虾的市场需求量日益增加,价格逐年攀升,然而对其生物学的研究甚少。日本学者对此虾的洄游等生物学习性进行了初步的研究,发现盐度16.9,温度25℃为胚胎发育的适宜条件,其幼体经过9个时期发育成为仔虾(Hamano, 1992; Hayashi, 1984)。国内鲜有此虾的相关报道,而对于没有洄游习性、在淡水中繁殖的中华锯齿米虾()生物学相关研究较多(薛俊增等, 1995; 孙世杰等, 2007)。这2种米虾胚胎发育等繁殖特性的差异有待进一步研究。
腹胚亚目的虾蟹类有抱卵习性,但在环境不适或受惊扰时会发生弃卵现象。一些人工繁殖的种类其亲体在抱卵过程中会发生死亡,造成一定的经济损失,因此,虾蟹类胚胎离体孵化技术研究具有重要的应用价值。阎斌伦(2002)的研究表明,虾蟹受精卵与亲体仅以刚毛连接,腹肢摆动保证发育过程中氧气充足,但没有营养上的联系。因此,在进行虾蟹类胚胎离体孵化时,研究者通常关注于水中的溶解氧,多采用充气的方法。迄今,已有关于日本沼虾()、中华绒螯蟹()等离体孵化的研究报道,但离体孵化的效果往往与胚胎离体的时间呈负相关(王吉桥等, 2006; 康现江等, 1996; 顾功超等, 1995)。也有研究者认为,水中微生物及死卵滋生的原生动物会影响离体胚胎的孵化率,尝试使用化学药物对胚胎及水体进行消毒处理,但这一方法有可能会对胚胎产生潜在的毒性,同时也会造成环境的污染(廖永岩等, 2001; 鲍鹰等, 1999)。如何能提高较早离体胚胎的孵化效果具有一定理论与应用意义。
日本米虾抱卵亲体在胚胎临近孵化的后期常出现弃卵现象,推测原因为胚胎发育不同步,部分幼体先孵出后刺激亲体去除剩卵。现阶段尚缺乏对日本米虾胚胎发育的系统报道,限制了对弃卵机理的深入研究,而弃卵如何再利用也是需要解决的问题。本研究用自制水产动物胚胎孵化装置对不同时期胚胎进行离体孵化,研究了日本米虾的胚胎发育特征及温度对其离体孵化效果的影响,以期为此种类繁殖生物学研究及甲壳动物胚胎离体孵化技术的优化提供参考。
1 材料与方法
1.1 材料
本研究于2017年2~4月在大连海洋大学实验室进行。日本米虾购于广州花地湾花鸟鱼虫批发市场,平均体长为(3.5±0.8) cm,平均体重为(4.9±0.9) g,经促熟培育至产卵。养殖容器为9.0 L玻璃鱼缸,配有温度计、50 W加热棒(闽江HK-50)、5 W水泵(森森JP-032)和气石等辅助装置。自制离体孵化装置见图1。
1.2 方法
1.2.1 胚胎形态学观察 将抱卵亲虾挑出单独饲养。抱卵后,前3 d每隔6 h取卵1次,以后每24 h取卵1次,取卵时将抱卵亲虾置于表面皿中,用解剖针轻轻将胚胎从附肢上剥离,再将粘连的胚胎分开,并及时放入已经消毒的水中备用。每次随机取胚胎4~5个,4组平行。使用Nikon E100显微镜观察胚胎发育特征,测量胚径,并拍照,最后计算发育积温。发育积温计算公式(周洲等, 2015)为:
发育积温=胚胎发育天数×平均水温
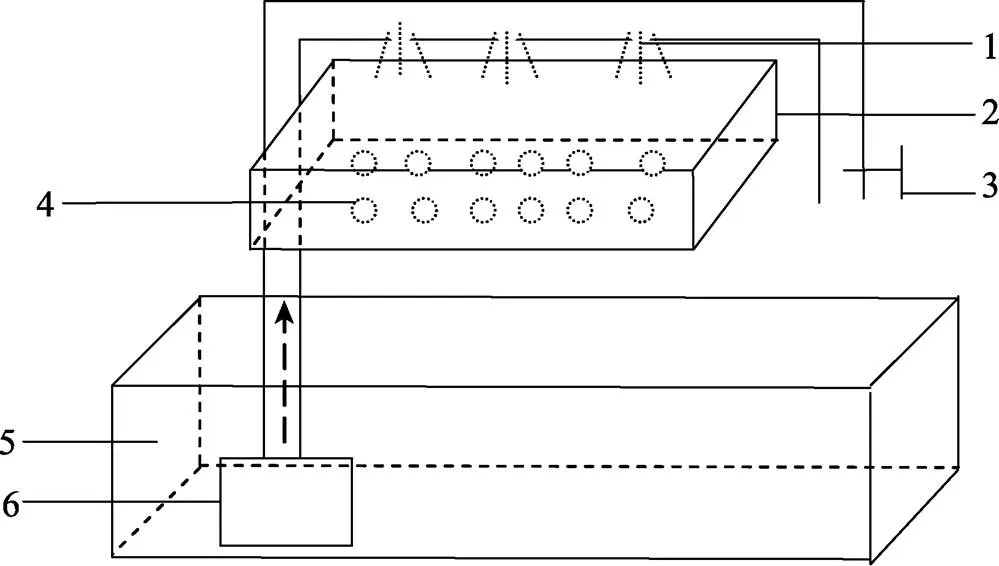
图1 离体孵化装置
1:滴水孔;2:孵化槽;3:调节阀;4:离体胚胎;5:水族缸;6:水泵
1: Drip water hole; 2: Incubator; 3: Regulating valve; 4: Embryo; 5: Aquarium; 6: Pump
1.2.2 胚胎离体孵化 离体孵化装置中的水泵将水抽入管道,管道上有小孔,水从小孔喷洒到孵化槽中的滤棉上,其上放置离体胚胎(图1)。将卵裂期、囊胚期、原肠胚、前无节幼体期、后无节幼体期、前溞状幼体期和膜内溞状幼体期的胚胎分别置于离体孵化装置,每组置有100个胚胎,同时在孵化装置的玻璃缸中放入胚胎发育至相应时期的抱卵亲虾。孵化期间盐度为17.0±1.0,温度为(25.5±1.0)℃,每组重复5次。
1.2.3 温度对胚胎离体孵化的影响 设置15.0℃、18.5℃、22.0℃、25.5℃、29.0℃和32.5℃共6个温度组,盐度为17.0。每个温度组在实验时,于离体孵化装置中放入处于前溞状幼体期的胚胎100个,每组实验重复5次。
1.3 数据分析
实验数据使用SPSS 20进行单因素方差分析和Turkey多重比较计算各数据间的差异显著性,以<0.05作为显著差异判定条件。
2 结果
2.1 胚胎发育分期与形态特征
日本米虾产卵后由卵柄将卵粘在一起,抱于腹部。根据胚胎发育过程中形态学特征的变化,将胚胎发育过程分为受精卵、卵裂期、囊胚期、原肠期、前无节幼体期、后无节幼体期、前溞状幼体期和膜内溞状幼体期8个时期,各个发育期主要形态特征见表1。
表1 日本米虾胚胎发育各时期特征
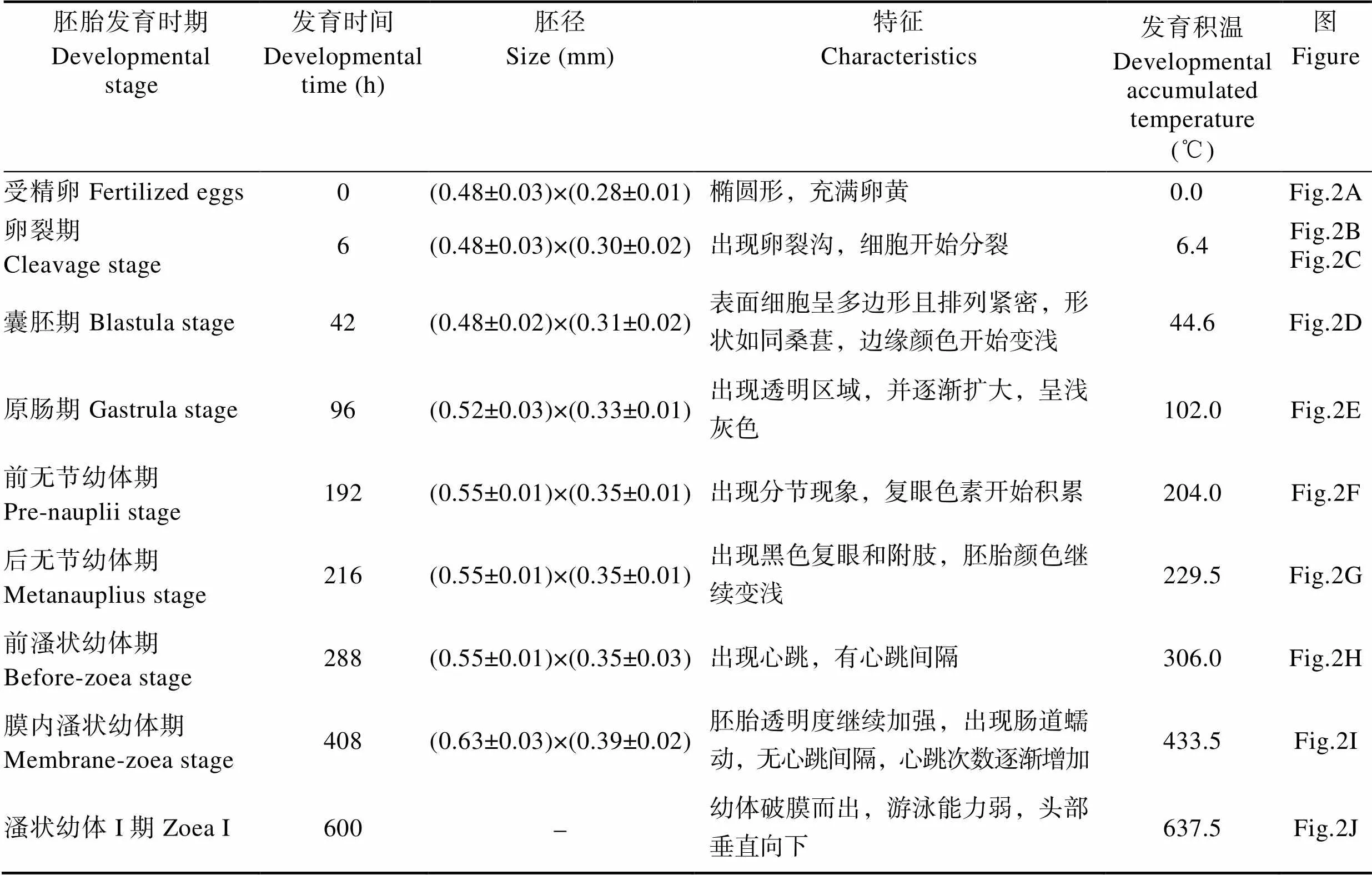
Tab.1 Characteristics of each embryonic developmental stage of C. japonica
受精卵(图2A):不规则椭圆形,呈深灰色,卵径为(0.48±0.03) mm×(0.28±0.01) mm,4~6 h后进入卵裂期。
卵裂期(图2B、图2C):胚胎发育至卵裂期,呈深灰色,不透明。分裂过程中明显可见卵裂沟。新分裂的2个细胞中央颜色较深,充满整个胚胎内。卵裂期阶段持续约36 h。
囊胚期(图2D):产卵后42 h,胚胎发育进入囊胚期,此期胚胎边缘颜色变浅,中央颜色加深。胚径与受精卵相当。囊胚期胚胎内分化出大量小细胞,胚胎表面细胞呈多边形且排列紧密,形状如同桑葚。由于分裂的细胞较小,无法区分植物极、动物极与囊胚腔。
原肠期(图2E):产卵后96 h,胚胎发育进入原肠期,此时阴影区域外圈颜色变浅至半透明,中央颜色也略变浅,呈浅灰色。随着胚胎发育,透明区域扩大到整个胚胎的1/4后开始发育形成腹板。胚径明显增大,为(0.52±0.03) mm×(0.33±0.01) mm。胚体不断吸收利用卵黄,胚胎细胞继续分裂,细胞数量更多更加微小。胚胎的一端出现月牙状透明区域,为进入原肠期的重要标志。
前无节幼体期(图2F):产卵后192 h,胚胎发育进入前无节幼体期,该期仅持续24 h。此期胚胎一端的透明区域约占整个受精卵的1/3,阴影区域与透明区域相连接的位置出现凹陷,阴影区域颜色变浅,仅中央部分呈深灰色,其他部分均呈半透明。透明区域出现分节现象,将发育为幼体的腹部。阴影区域开始积累复眼色素,将发育为复眼。卵径略有增大,为(0.55±0.01) mm×(0.35±0.01) mm。
后无节幼体期(图2G):产卵后216 h进入后无节幼体期,此期胚胎卵黄继续缩小,透明区域继续扩大,约占胚胎的1/2。卵径与前无节幼体期相当。本期胚胎中出现明显可见的黑色复眼,为胚胎进入后无节幼体期的重要标志。胚胎腹部透明区域隐约出现1个棒状结构,未来发育成肠道,出现5对附肢,但不分节。约48 h后,头部及胸部出现分化,腹部分节进一步明显,附肢及肠道进一步分化,附肢数目增加为7对。
前溞状幼体期(图2H):胚胎发育288 h进入前溞状幼体期,由于卵黄持续减少,胚胎颜色进一步变浅,几乎为半透明状。卵径与前无节幼体期相当。此期隐约可见分节,复眼增大,头部及胸部进一步发育分化,头部出现弯曲的条状结构,将发育成额角,胸部出现类似心脏的组织,并不规律的跳动,为胚胎进入前溞状幼体期的重要标志,心跳60~100次/min,有心跳间隔,此时胚胎发育积温约达到306.0℃。72.0 h后心跳逐渐稳定,心跳间隔出现次数减少,心跳约为100次/min。
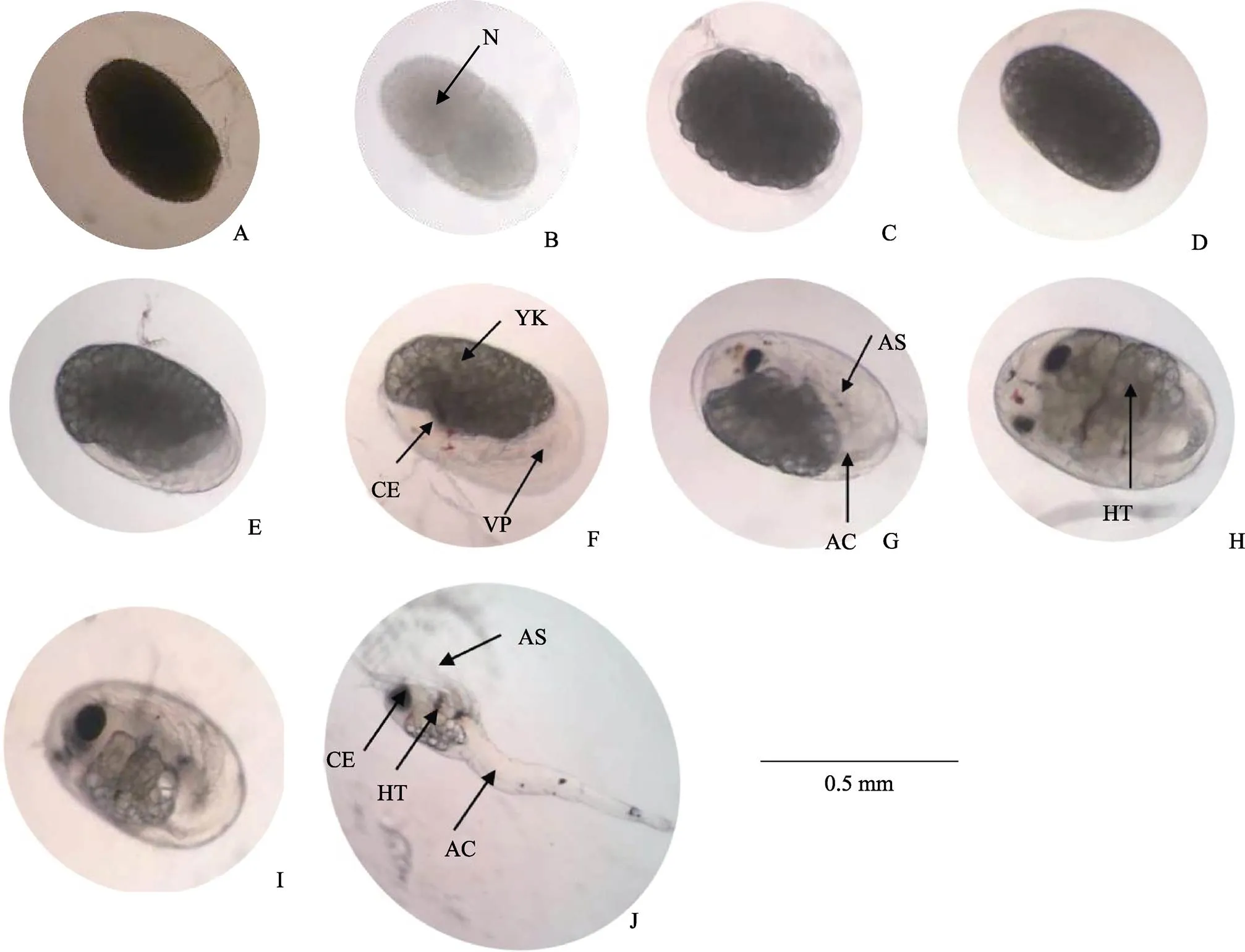
图2 日本米虾胚胎发育各时期的形态特征
A:受精卵;B、C:卵裂期;D:囊胚期;E:原肠期;F:前无节幼体期;G:后无节幼体期;H:前溞状幼体期;I:膜内溞状幼体期;J:溞状幼体I期;N:细胞核;YK:卵黄;CE:复眼;VP:腹板;AS:附肢;AC:消化道;HT:心脏
A: Fertilized eggs; B, C: Cleavage stage; D: Blastula stage; E: Gastrula stage; F: Pre-nauplii stage; G: Metanauplius stage; H: Before-zoea stage; I: Membrane-zoea stage; J: Zoea I stage; N: Nuclei; YK: Yolk; CE: Compound eyes; VP: Ventral plate; AS: Appendages; AC: Alimentary canal; HT: Heart
膜内溞状幼体期(图2I):雌虾产卵后408 h进入膜内溞状幼体期,此时卵黄仅存少量于胚体的头胸部背面,透明区域几乎充满整个胚胎。卵径增大明显,为(0.63±0.03) mm×(0.39±0.02) mm。复眼发育成亮黑色,四周隐约出现放射状条纹,出现眼柄,复眼呈半球状突出于背部表面。头部额角变粗,头胸部附肢分节,附肢末端出现色素块。胚胎组织结构清晰可见,肠道发育完全,偶尔可见蠕动。身体仍然弯曲,偶见抽动。膜内溞状幼体期胚胎心脏发育日趋完全,心跳稳定且加快,不再出现心跳间隔。此时胚胎发育基本完成,体型与溞状幼体类似。
溞状幼体Ⅰ期(图2J):胚胎发育至600 h左右,发育积温达到637.5℃,心跳增加到约180次/min,陆续开始有幼体孵出,幼体破膜时用头部的额角及附肢刺破卵膜。出膜后的幼体游泳能力弱,头部垂直向下,随水流而浮动。自此,日本米虾完成胚胎发育阶段,将进入幼体变态发育阶段。
2.2 不同时期的胚胎离体孵化效果
水温25.5℃时,不同时期离体胚胎均能于离体孵化装置中孵出幼体,但孵化率有较大差异(表2)。卵裂期离体胚胎孵化率为(28.2±2.6)%,囊胚期离体胚胎孵化率为(33.1±4.4)%,二者无显著差异(>0.05);前无节幼体期离体胚胎孵化率为(64.9±6.5)%,后无节幼体期离体胚胎的孵化率为(66.8±13.2)%,其无显著差异(>0.05),但与非离体孵化的对照组(79.1±4.9)%差异显著(<0.05)。前溞状幼体期胚胎的离体孵化率为(78.9±2.2)%,膜内溞状幼体期孵化率为(80.7±2.4)%,与对照组差异不显著(>0.05)。各组离体胚胎所孵化出的Ⅰ期溞状幼体(ZⅠ)到Ⅱ期溞状幼体(ZⅡ)的变态率无显著差异(>0.05)。
表2 不同发育期胚胎离体孵化效果

Tab.2 Effects of embryo incubation in vitro on different developmental stages
注:同行中标有不同小写字母者表示组间有显著性差异(<0.05),标有相同小写字母者表示组间无显著性差异(>0.05);ZⅠ表示溞状幼体Ⅰ期;ZⅡ表示溞状幼体期,下同
Note: The data with different letters within the same row are significantly different at the 0.05 probability level, and the data with the same letters within the same row are not significantly different; the ZⅠrepresents the 1st phase of the zoea larva; ZⅡrepresents the 2nd phase of the zoea larva. The same as below
2.3 温度对离体孵化效果的影响
由表3可知,当盐度为17.0时,不同温度组日本米虾前溞状幼体期胚胎离体孵化时间和孵化率有明显差异。从15.0℃到32.0℃,随着水温的升高,胚胎孵化时间逐渐缩短,15.0℃组孵化时间需要(436.8± 124.8) h,而32.0℃组缩短至(228.0±88.8) h。温度对胚胎离体孵化率有显著影响,从15.0℃到29.0℃,随着水温升高而呈逐渐升高趋势,29.0℃时孵化率最高,为(78.2±2.8)%,但在32.5℃时下降至(73.2±3.2)%。由此可知,温度过高或过低均不利于离体胚胎的发育与孵化。
温度对离体孵化出幼体的质量也有影响。25.5℃组中溞状幼体变态率最高,为(67.2±1.8)%,32.5℃组溞状幼体变态率最低,为(57.3±4.0)%,与其他各组均有显著差异(<0.05);15.0℃、18.5℃、22.0℃3组间溞状幼体变态率差异不显著(>0.05)。综合孵化率和溞状幼体变态率,胚胎离体孵化温度控制在25.5℃到29.0℃间,有利于提高孵化率和幼体质量。
3 讨论
3.1 胚胎发育的分期
虾蟹类胚胎发育可分为胚胎早期和晚期2个主要阶段,早期阶段为卵裂期、囊胚期和原肠胚;而晚期阶段也就是绝大部分虾蟹具有的膜内幼体期,其因种类而异,分期尚无统一标准。适宜的条件下,锦绣龙虾()膜内幼体期为14~15 d,根据附肢数量和复眼色素形成等特征分为7对附肢期、 9对附肢期、11对附肢期、复眼色素形成期、准备孵化期和孵化期(梁华芳等, 2012);白须条斑鞭腕虾()膜内幼体期约为8.5 d,根据复眼色素形成和心跳等特征分为无节幼体发生期、复眼色素形成前期、复眼色素形成后期、孵化前期和孵化期(张雅静等, 2012);远海梭子蟹()的膜内幼体期也为8.5 d左右,但根据身体分节和心跳等特征仅分为无节幼体、后无节幼体和原溞状幼体(廖永岩等, 2011)。对中华新米虾的研究表明,其胚胎发育分为卵裂期、囊胚期、原肠期、无节幼体期Ⅰ、无节幼体期Ⅱ、无节幼体Ⅲ期和无节幼体Ⅳ期,在水温为22℃~26℃条件下发育历时376 h (薛俊增等, 2009)。也有研究者将中华锯齿米虾的胚胎发育分为卵裂期、囊胚期、原肠期、前无节幼体期、后无节幼体期、复眼色素形成期和溞状幼体期(孙世杰等, 2007)。本研究参考已报道的虾蟹类胚胎分期方法(薛俊增等, 2009; 徐慈浩等, 2015),将日本米虾早期胚胎分为受精卵、卵裂期、囊胚期和原肠胚期,而将晚期胚胎分为前无节幼体期、后无节幼体期、前溞状幼体期和膜内溞状幼体期。日本米虾胚胎发育过程与中华新米虾等大多数淡水虾类胚胎发育特征相似,其发育时间长,膜内幼体期多。但多数淡水虾类孵化出的幼体直接或者经过短暂的变态发育进入仔虾期(薛俊增等, 1995; 孙世杰等, 2007; 刘哲玉, 2009),日本米虾幼体孵化后要经历较长的浮游期,这一点又与多数海水虾类相似(蔡生力等, 2006; 季文娟, 1996; 梁俊平, 2013)。日本米虾的胚胎发育及幼体的行为表现兼具淡水和海水种类的特征,与其降河洄游特性相一致。
表3 不同温度下离体胚胎孵化效果
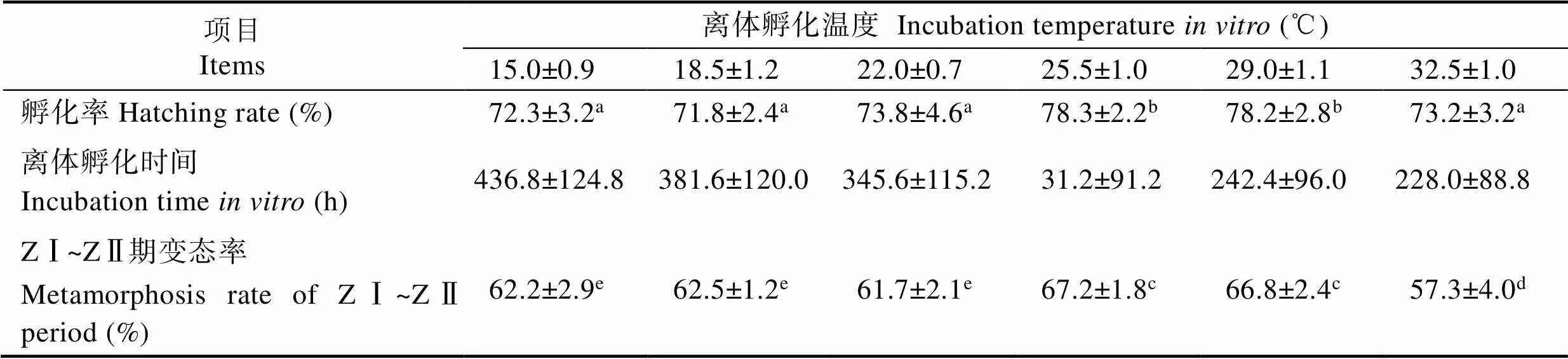
Tab.3 Effects of water temperature on in vitro embryo hatching performance
3.2 不同发育时期胚胎离体孵化的效果
虾蟹类胚胎离体孵化过程中除了要保证足够的溶解氧,最主要的影响因素来自于真菌和原生动物等有害生物的滋生,由于没有亲体的及时清理,大量的有害生物附着于胚胎表面,导致胚胎腐烂,或被这些生物直接进食。为提高胚胎的离体孵化率,不少研究者使用药物处理胚胎。廖永岩等(2001)研究表明,使用0.2 mg/dm3浓度的孔雀石绿处理远海梭子蟹离体卵效果显著;鲍鹰等(1999)对中华绒螯蟹胚胎离体孵化研究表明,福尔马林与孔雀石绿联用比其单独使用的效果明显。虽然使用药物处理离体胚胎取得了一定成果,但规模化生产中这无疑将增加生产成本,且很多作用明显的化学药物会对环境造成危害,已被列入禁用药品。本研究没有使用任何药物处理离体胚胎,获得了较好的孵化效果,这主要取决于装置的持续流水,以及精细的过滤装置,其不仅能保证充足的溶解氧,及时冲洗胚胎表层的有害生物,而且能将水中的悬浮物滤除,减少细菌或原生动物对胚胎的影响。实验中还发现水流过大易击破卵膜,过小又不能彻底清除有害生物,水流大小对胚胎孵化效果的影响需要进一步研究。
日本米虾各阶段胚胎均能够离体孵化出幼体,且所孵出的ZⅠ幼体均能够发育至ZⅡ幼体,其与抱卵亲虾所孵出幼体的变态率无显著差异,表明本研究所采用的胚胎离体孵化装置及操作对幼体质量无显著影响。因此,本实验装置经过规模放大及适当的技术优化可以满足生产需求,对抱卵过程中因亲体死亡而废弃的受精卵重新利用,为虾蟹人工育苗技术创新提供参考。
3.3 温度对日本米虾胚胎离体孵化效果的影响
虾蟹类生长繁育中温度是重要环境因子,不仅影响其抗逆能力(冯亚萍等, 2018)和生长性状(王明珠等, 2018),更对胚胎发育起决定性作用,但迄今有关温度对虾蟹离体胚胎发育及孵化效果影响的研究较少。本研究发现,在15.0℃~32.0℃范围内,日本米虾的离体孵化胚胎孵化时间逐渐缩短,15.0℃组孵化需要(436.8±124.8) h,而32.0℃组缩短至(228±88.8) h。在15.0℃~29.0℃范围内,孵化率也随着水温的升高而呈上升趋势,但温度高于29.0℃时,孵化率和幼体的变态率会明显下降。已有研究表明,在19.0℃~31.0℃范围内,脊尾白虾()胚胎发育时间随温度升高而缩短,但高于28.0℃时随着温度升高幼体存活率开始下降,达到36.0℃时幼体无法变态(梁俊平等, 2013)。这可能由于温度升高导致胚胎代谢加快,机体发育时各组织器官发育又不完善,造成各器官的衰竭。另外,与机体代谢相关的酶及其他大分子物质的活性也均受到温度影响,过高的温度可能会直接导致其功能受损。水生生物胚胎通常要达到一定的积温才能孵化,本研究计算了日本米虾离体孵化的积温,约为637.5℃,与锦绣龙虾的642.4℃相近(梁华芳等, 2012),但远高于一般虾蟹的300.0℃~ 400.0℃(蔡生力等, 2006; 顾功超等, 1995)。人工繁育时应建立起孵化温度、孵化率和幼体质量间的平衡,在保证胚胎正常发育和幼体质量的前提下,参考积温数值,利用温度调控胚胎发育时间,以合理安排生产计划,降低生产成本。
Bao Y, Liu J, Lin SJ. Study on the breeding of in vitro embryo ofmitten crab (). Marine Sciences, 1999(1): 55–58 [鲍鹰, 刘军, 林少军. 中华绒螯蟹受精卵离体培育的初步研究. 海洋科学, 1999(1): 55–58]
Cai SL, Chen Y. Research status of marine ornamental crust- aceans. Scientific Fish Farming, 2006(1): 2–4 [蔡生力, 陈岩. 海洋观赏性甲壳类的研究现状. 科学养鱼, 2006(1): 2–4]
Feng YP, Kong J, Luo K,. The difference of tolerance to white spot syndrome virus betweenandat different temperatures. Progress in Fishery Sciences, 2018, 39(2): 120–127 [冯亚萍,孔杰, 罗坤, 等. 不同温度下凡纳滨对虾和中国明对虾对白斑综合征病毒(WSSV)耐受性比较. 渔业科学进展, 2018, 39(2): 120–127]
Gao SJ. Characteristics and development prospect of several ornamental shrimp species. Fujian Agricultural Science and Technology, 2012(3–4): 129–131 [高淑娇. 几种观赏虾的特征特性及开发前景. 福建农业科技, 2012(3–4): 129– 131]
Gu GC, Huang XX, Tan ZQ. Artificial hatching of isolated eggs ofand its application. Fishery Modernization, 1995(5): 11–14 [顾功超, 黄旭雄, 谭正启. 中华绒螫蟹离体卵的人工孵化及其利用. 渔业现代化, 1995(5): 11–14]
Hamano T. Ecology of an atyid shrimp(De Man, 1892) migrating to upstream habitats in the Shiwagi rivulet, Tokushima Prefecture. Researches on Crustacea, 1992, 21: 1–13
Hayashi KI, Hamano T. The complete larval development ofDe Man (Decapoda, Caridea, Atyidae) reared in the laboratory. Zoological Science, 1984, 1(4): 571–589
Ji WJ. Fatty acids changes during larval development of. Journal of Fishery Sciences of China, 1996, 3(4): 28–34 [季文娟. 中国对虾()幼体发育各阶段脂肪酸组成的研究. 中国水产科学, 1996, 3(4): 28–34]
Kang XJ, Sun TC, Wang SA. Preliminary study on the isolated culture of the fertilized egg and embryonic development of the(Crustacea Decapoda). Journal of Hebei University (Natural Science), 1996(4): 44–48 [康现江, 孙天才, 王所安. 日本沼虾受精卵的离体培养及其胚胎发育的初步观察. 河北大学学报(自然科学版), 1996(4): 44–48]
Li F. Prospects for the development of freshwater ornamental shrimp. Aquarium, 2007(6): 52–55 [李帆. 淡水观赏虾开发展望. 水族世界, 2007(6): 52–55]
Liang HF, He JG. Study on the artificial propagation and embryonic development of. Acta Hydrobiologica Sinica, 2012, 36(2): 236–245 [梁华芳, 何建国. 锦绣龙虾人工繁殖和胚胎发育的研究. 水生生物学报, 2012, 36(2): 236–245]
Liang JP, Li J, Li JT,. Effects of water temperature on the embryonic development, survival and development period of larvae of ridgetail white prawn () reared in the laboratory. Acta Ecologica Sinica, 2013, 33(4): 1142–1152 [梁俊平, 李健, 李吉涛, 等. 不同温度对脊尾白虾胚胎发育与幼体变态存活的影响. 生态学报, 2013, 33(4): 1142–1152]
Liang JP. Study on the technology of artificial breeding and expression of genes involving in reproducing ofDoctoral Dissertation of Ocean University of China, 2013 [梁俊平. 脊尾白虾全人工繁育及繁殖相关基因的研究. 中国海洋大学博士研究生学位论文, 2013]
Liao YY, Li F, Dong XX. External morphological characteristics during the embryonic development of. Zoological Research, 2011, 32: 657–662 [廖永岩, 李锋, 董学兴. 远海梭子蟹胚胎发育观察. 动物学研究, 2011, 32: 657–662]
Liao YY, Zhao LM. Hatching and larval culture ofembryo ofunder anti-fungus. Journal of Oceanography in Taiwan Strait, 2001, 20(3): 363–370 [廖永岩, 赵丽梅. 抗真菌药物对远海梭子蟹离体胚胎(卵)孵化及幼体培育的影响. 台湾海峡, 2001, 20(3): 363–370]
Liu ZY. The early development and vitellin levels of the crayfish,. Master´s Thesis of Hebei University, 2009 [刘哲玉. 克氏原螯虾早期发育及卵黄蛋白含量的研究. 河北大学硕士研究生学位论文, 2009]
Sun SJ, Fan CG, Li FC,. Preliminary study on the conformation development of. Hebei Fishery, 2007(12): 22–25 [孙世杰, 范成功, 李凤超, 等. 中华锯齿米虾形态发育的初步研究. 河北渔业, 2007(12): 22–25]
Tlusty M. The benefits and risks of aquacultural production for the aquarium trade. Aquaculture, 2002, 205(3–4): 203–219
Wang JQ, Liu J, Jiang JY,. Morphological observation of egg envelops and pleopods and egg attachment in Chinese mitten-handed crab (). Chinese Journal of Fisheries, 2006, 19(2): 32–36 [王吉桥, 刘晶, 姜静颖, 等. 中华绒螯蟹卵膜和腹肢的形态及卵附着机制. 水产学杂志, 2006, 19(2): 32–36]
Wang MZ, Meng XH, Kong J,. Evaluation of genetic parameters for growth and cold tolerance traits inunder low-temperature stress. Progress in Fishery Sciences, 2018, 39(3): 96–102 [王明珠, 孟宪红, 孔杰, 等. 低温胁迫条件下中国明对虾生长性状和耐低温性状的遗传参数评估. 渔业科学进展, 2018, 39(3): 96–102]
Xu CH, Xiao RY, Mu LL,. Observation on development ofembryos and influence of temperature on embryonic development. Guangdong Agricultural Sciences, 2015, 42(20): 112–117 [徐慈浩, 肖锐媛, 木亮亮, 等. 罗氏沼虾胚胎发育观察及温度对胚胎发育的影响. 广东农业科学, 2015, 42(20): 112–117]
Xue JZ, Du NS. Crustacea. Shanghai: Shanghai Education Publishing House, 2009 [薛俊增, 堵南山. 甲壳动物学. 上海: 上海教育出版社, 2009]
Xue JZ, Zheng L, Chen ZF. Primary study of the embryo development of. Journal of Hangzhou Teachers Colloege, 1995(6): 79–83 [薛俊增, 郑璐, 陈樟福. 中华新米虾胚胎发育的初步研究. 杭州师范大学学报, 1995(6): 79–83]
Yan BL. Causes of the shedding of fertilized eggs and prevention measures. China Fisheries, 2002(7): 50–51 [阎斌伦. 河蟹受精卵脱落的原因与预防措施. 中国水产, 2002(7): 50–51]
Zhang YJ, Cai SL, Liu H. Morphological observation of embryonic development of marine ornamental shrimp (). Journal of Fishery Sciences of China, 2012, 19(6): 923–929 [张雅静, 蔡生力, 刘红. 海洋观赏虾类清洁虾胚胎发育的形态学观察. 中国水产科学, 2012, 19(6): 923–929]
Zhao CY, Zhang YN. Industrialized exploitation and prospect of ornamental shrimp in China. Chinese Fisheries Economics, 2012, 30(1): 83–87 [赵朝阳, 张亚楠.中国观赏虾的产业化开发及展望. 中国渔业经济, 2012, 30(1): 83–87]
Zhou Z,Li ZY,Zhang LT,. The study on relationship of cumulative temperature and the sex gland development of sturgeon in artificial breeding condition. Guizhou Journal of Animal Husbandry and Veterinary Medicine, 2015, 39(5): 65–68 [周洲, 李正友, 张龙涛, 等. 人工培育条件下鲟鱼性腺发育积温的研究. 贵州畜牧兽医, 2015, 39(5): 65–68]
Embryonic Development ofandIncubation of Its Fertilized Eggs
CAO Linquan1, QIN Zheng1, JIANG Yusheng1①, LIU Xin1, LI Xiaodong2, LIN Yuan3, HUANG Kaitao1, LIU Xu2
(1. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023; 2. Research and Development Center, Panjin Guanghe Crab Industrial Company Ltd, Panjin 124200; 3. Liaoning Provincial Aquatic Seeds Management Bureau, Dalian 116015)
In this study,eggs at different developmental stages were incubatedwithin a self-made incubator. The goal was to provide a reference for research onreproductive biology and crustacean embryohatching technology. The results showed thatfertilized eggs took about 25 days to hatch into larvae at a water temperature of 25.5℃ and the developmental accumulated temperature reaches about 637.5℃. The embryonic development went through eight stages: Fertilized eggs, cleavage stage, blastula stage, gastrula stage, embryonized nauplius stage, embryonized metanauplius stage, embryonized protozoea stage, and embryonized zoea stage. The embryos at different developmental stages could hatch to zoea larvae and can develop normally. The maximumhatching rate was (80.7±2.4)% found in eggs at embryonized zoea stage, which was not significantly different from that observed in normal ovigerous females (79.1±4.9)%. The minimumhatching rate was (28.2±2.6)%, found in eggs at cleavage stage, which was significantly lower than that of normal ovigerous females. Water temperature had a marked effect on embryonic development usinghatching method. Incubation time gradually decreased with increasing temperature at a range from 15.0℃ to 32.5℃, i.e., where (436.8±124.8) h at 15.0℃, (228.0±88.8) h at 32.5℃. However, the metamorphosis rate from ZⅠ to ZⅡ began to decline when water temperature exceeded 29.0℃.
; Embryonic development;incubation; Temperature
S966.12
A
2095-9869(2020)01-0145-08
10.19663/j.issn2095-9869.20181019001
* 辽宁省高等学校海洋产业技术研究院项目、辽宁省海洋与渔业厅计划项目(2015013)、大连市杰出青年科技人才项目(2017RJ10)和大连海洋大学蔚蓝英才工程资助项目共同资助[This work was supported by Liaoning Provincial Institute of Marine Industry Technology Research Project, Liaoning Provincial Ministry of Oceans and Fisheries Plan Project (2015013), Dalian Outstanding Youth Science and Technology Talent Project (2017RJ10), and Blue Ocean Talent Project of Dalian Ocean University]. 曹林泉,E-mail: lqcao0225@163.com
姜玉声,副教授,E-mail: jys@dlou.edu.cn
2018-10-19,
2018-11-20
http://www.yykxjz.cn/
曹林泉, 秦政, 姜玉声, 刘鑫, 李晓东, 林源, 黄楷涛, 刘胥. 日本米虾胚胎发育及离体孵化. 渔业科学进展, 2020, 41(1): 145–152
Cao LQ, Qin Z, Jiang YS, Liu X, Li XD, Lin Y, Huang KT, Liu X. Embryonic development ofandincubation of its fertilized eggs. Progress in Fishery Sciences, 2020, 41(1): 145–152
JIANG Yusheng, E-mail: jys@dlou.edu.cn
(编辑 马璀艳)

