TRPV1受体参与脊髓电刺激对外周伤害性信息传递的抑制作用*
王培培 杨 菲,2
(1首都医科大学基础医学院神经生物学系,北京100069;2首都医科大学人脑保护高精尖中心,北京100069)
各种类型的神经病理性疼痛在慢性疼痛中占据了相当大的比例,但是很多情况下现有镇痛药物未能有效缓解神经病理性疼痛病人的症状。脊髓电刺激 (spinal cord stimulation, SCS) 作为一种非药物治疗手段,对于一些药物难于治疗的神经病理性疼痛,例如腰椎手术失败综合征等具有明显的治疗效果,从而受到国内外慢性痛治疗和研究领域专家学者的广泛关注[1~3]。尽管如此,SCS的镇痛疗效仍有很大的提升空间,其中部分原因是其镇痛机制尚未完全阐明。在临床前动物实验中,发现50 Hz 的SCS治疗可以缓解神经病理性疼痛模型大鼠的机械性痛觉过敏,并且其神经生理学机制包括抑制伤害性传入纤维 (C纤维)在脊髓背角的信息传递和整合,例如SCS可以抑制脊髓背角浅层C纤维诱发场电位的幅度和深层广动力范围神经元C成分的放电数量[4,5]。此外,有报道称SCS可以通过调控神经递质,例如胆碱能[6]、5-羟色胺能[7]和阿片系统[8]达到镇痛目的。最近有研究报道[4],CB1 (cannabinoid type 1) 受体的拮抗剂AM251可以阻断SCS对神经病理性疼痛大鼠机械性痛敏的缓解,并减弱SCS对脊髓背角浅层C纤维突触传递的抑制。但是,CB2受体拮抗剂没有对SCS产生的伤害性传递抑制产生明显影响。以上结果说明脊髓节段的内源性大麻素系统在SCS对神经病理性疼痛的镇痛中发挥作用。
内源性大麻素作为一类具有生物活性的脂质信号分子,可以参与调控伤害性信息传递和突触可塑性变化,从而影响痛觉抑制的维持时间[9]。内源性大麻素主要包括N-花生四烯酸氨基乙醇 (anandamide, AEA) 和2-花生四烯酸甘油 (2-arachidonoyl glycerol, 2-AG),相应的作用受体主要是大麻素1型 CB1和 2型 (cannabinoid type 2, CB2) 受体[10]。除了CB1和CB2受体,内源性大麻素特别是AEA还可以作用于瞬时受体电位香草酸亚型1 (transient receptor potential vanilloid type 1, TRPV1) 受体[11]。外周神经系统中的TRPV1受体主要作为伤害性感受器感知温度和化学刺激,但脊髓的TRPV1受体可以参与C纤维的长时程突触可塑性调节,而其是否参与SCS对C纤维突触传递的抑制作用尚不得而知。同时,SCS对脊髓背角浅层和深层伤害性信息传递的抑制是否具有不同机制也缺少报道。因此,本研究通过在体电生理技术分别记录脊髓背角浅层 (I-II层)的C纤维诱发场电位(C-fiber evoked local field potential, C-LFP) 和深层(III-V层)的广动力范围 (wide dynamic range, WDR) 神经元,使用TRPV1受体拮抗剂AMG9810研究脊髓TRPV1受体是否参与SCS引发的C纤维传递抑制。同时,通过背根神经节局部注射TRPV1激动剂树胶脂毒素(resiniferatoxin, RTX) 清除外周神经系统的TRPV1受体,进一步探究脊髓背角突触前TRPV1受体是否参与了SCS的抑制作用。
方 法
所有程序均由首都医科大学批准,实验过程中对动物的处置遵照中华人民共和国科学技术部 2006年颁布的《关于善待实验动物的指导意见》,以确保最小的动物使用量并减少其不适。大鼠自由进食进水,并在隔离笼中保持12 h/12 h昼夜循环。在实验结束时通过腹膜内注射戊巴比妥钠 (100~300 mg)处理所有动物。
1.实验对象
本实验中所使用的SPF级成年雄性250~300 g的Sprague-Dawley大鼠购自北京维通利华实验动物技术有限公司,均由首都医科大学实验动物中心购买和饲养。
2.仪器设备
电生理放大器 (World Precision Instruments,DAM80);钨丝电极 (FHC);刺激器 (A-M Systems,Model 2100);滤波器 (Krohn-hite, Model 3362);数据采集系统 (Cambridge Electronic Design Limited,Power1401-3A)。
3.主要药品
TRPV1受体拮抗剂AMG9810(Tocris,脊髓表面给药,50 mg/100 µl);TRPV1受体激动剂Resiniferatoxin (RTX, Sigma Aldrich,背根神经节注射,200 ng/10 µl)。
4.L5脊神经结扎 (spinal nerve ligation, SNL)模型
大鼠经1.5%~2%的异氟烷麻醉后,暴露并移除左侧椎骨L6节段的横突,使用6-0丝线对左侧L5脊神经进行紧结扎,并于结扎点远心端剪断神经。手术后监测动物是否有伤口感染、食物和水摄入不足或体重减轻症状,直至手术部位愈合。
5.背根神经节注射
大鼠经1.5%~2%的异氟烷麻醉后,于背部左侧中线切开皮肤约3 cm,钝性分离肌肉,暴露L4到L6节段椎骨。使用咬骨钳小心移除L4节段横突,暴露L4背根神经节。使用微量注射器缓慢注入10 µl RTX溶液或等量vehicle(1%乙醇溶液)。
6.在体电生理记录
(1)复合动作电位记录:使用异氟烷 (1.5%)麻醉大鼠,进行气管切开术和机械提供通气 (Kent Scientific Corporation, Litchfield, CT)。本实验中将单极银钩电极置于左侧坐骨神经上以记录复合动作电位 (compound action potential, CAP),通过硬膜外电极施加不同强度电刺激诱发逆行的坐骨神经CAP(0.1~5.0 mA,0.2 ms)。在线确定了导致第一个可检测A/波形 (Ab0) 和峰值A/波形 (Ab1),但不会产生A或C纤维成分的电流阈值,以此作为参照在接下来的实验中设定SCS的刺激强度。
(2)局部场电位记录:异氟烷麻醉下 (1.5%) 的大鼠暴露L4脊髓节段,去除硬脑膜,使用微电极推进器将钨丝电极下至左侧脊髓背角浅层200~500 µm。通过电刺激左侧坐骨神经诱发脊髓背角局部场电位 (local field potential, LFP),采样频率宽度设为1~300 Hz,根据不同的潜伏期和阈值区分A纤维和C纤维诱发 (90~130 ms,7~13 V) 成分。使用基于计算机的实时数据采集和处理系统 (CED Spike 2,UK) 来收集模拟数据。在SCS前15 min和SCS后0~30 min,使用坐骨神经上的测试电刺激 (25 V,0.5 ms,每分钟1个测试) 诱发C纤维诱发场电位(C-fiber evoked field potential, C-LFP)。
广动力范围神经元记录:手术过程与LFP记录相同,记录电极深入脊髓背角深层500~1 000 m,采样频率宽度为1~1 kHz。通过机械刺激左侧足底寻找广动力范围 (wide dynamic range, WDR) 神经元,确定后通过坐骨神经电刺激诱发WDR神经元反应,并通过兴奋阈值和潜伏期区分其中的A成分和C成分。在SCS前,SCS后15和30 min分别记录逐渐增加电刺激 (1~10 mA) 诱发的WDR神经元C成分放电数量,以观察SCS对WDR神经元伤害性反应的抑制作用。
7.实验分组
实验中共使用36只SD大鼠用于SNL造模,造模后分成两组各18只,分别用于C-LFP记录和WDR神经元记录。每组的18只大鼠在电生理实验前5天在背根神经节注射溶媒(SCS + vehicle和SCS + AMG9810组,各6只)或RTX(SCS + RTX组,6只)。在电生理记录当天,SCS + vehicle组和SCS + RTX组在脊髓表面给予AMG9810的溶媒。
8.统计学分析
实验数据采用GraphPad Prism 7软件进行统计分析。所有数据使用均数±标准误()呈现。统计方法采用双因素方差分析和Bonferroni多重比较检验,P< 0.05认为差异具有统计学意义。
结 果
1.在体电生理记录CAP, C-LFP和WDR神经元
为检测SCS对C-LFP和WDR神经元反应性的抑制作用,在SNL造模后3~4周对大鼠进行在体电生理记录(见图1A)。首先,通过双极电极刺激大鼠左侧T13至L1脊髓节段的背柱组织,可以在同侧坐骨神经记录到逆行的复合动作电位 (CAP)。根据潜伏期和刺激强度的不同,CAP可以被分成Aα/β和Aδ成分。将刚刚诱发出可检测的Aα/β成分的电流强度定义为Aβ阈值 (Ab0),而能够诱发出Aα/β成分最大值,同时没有激活Aδ和C纤维成分的电流强度被定义为Aβ峰值(Ab1)(见图1B)。在后续实验中的SCS都将使用5 min,50 Hz,Ab1强度的刺激模式。在确定了SCS刺激强度后,我们通过电刺激坐骨神经,在脊髓背角浅层或深层分别寻找LFP或者WDR神经元。根据潜伏期的不同,脊髓LFP(见图1C)和WDR(见图1D)神经元反应可以分为A纤维诱发的早成分 (A-component) 和C纤维诱发的晚成分 (C-component)。
2.阻断或清除TRPV1受体可以减弱或反转SCS对C-LFP的抑制作用。
在溶媒对照组中,当给予SCS (5 min, 0.2 ms,50 Hz, Ab1)后,C-LFP的曲线下面积出现了即刻的下降,并且在刺激后0~10 min内相比于基础值有统计学差异(见图2A, B)。而SCS对C-LFP的抑制作用维持时间较短,停止刺激15 min后回到了基线水平。而如果在脊髓表面给予AMG9810后15 min再给予相同参数的SCS,C-LFP曲线下面积的下降程度得以减弱,并且刺激后0~10 min内的统计值和基础值相比无统计学差异(见图2A, B)。
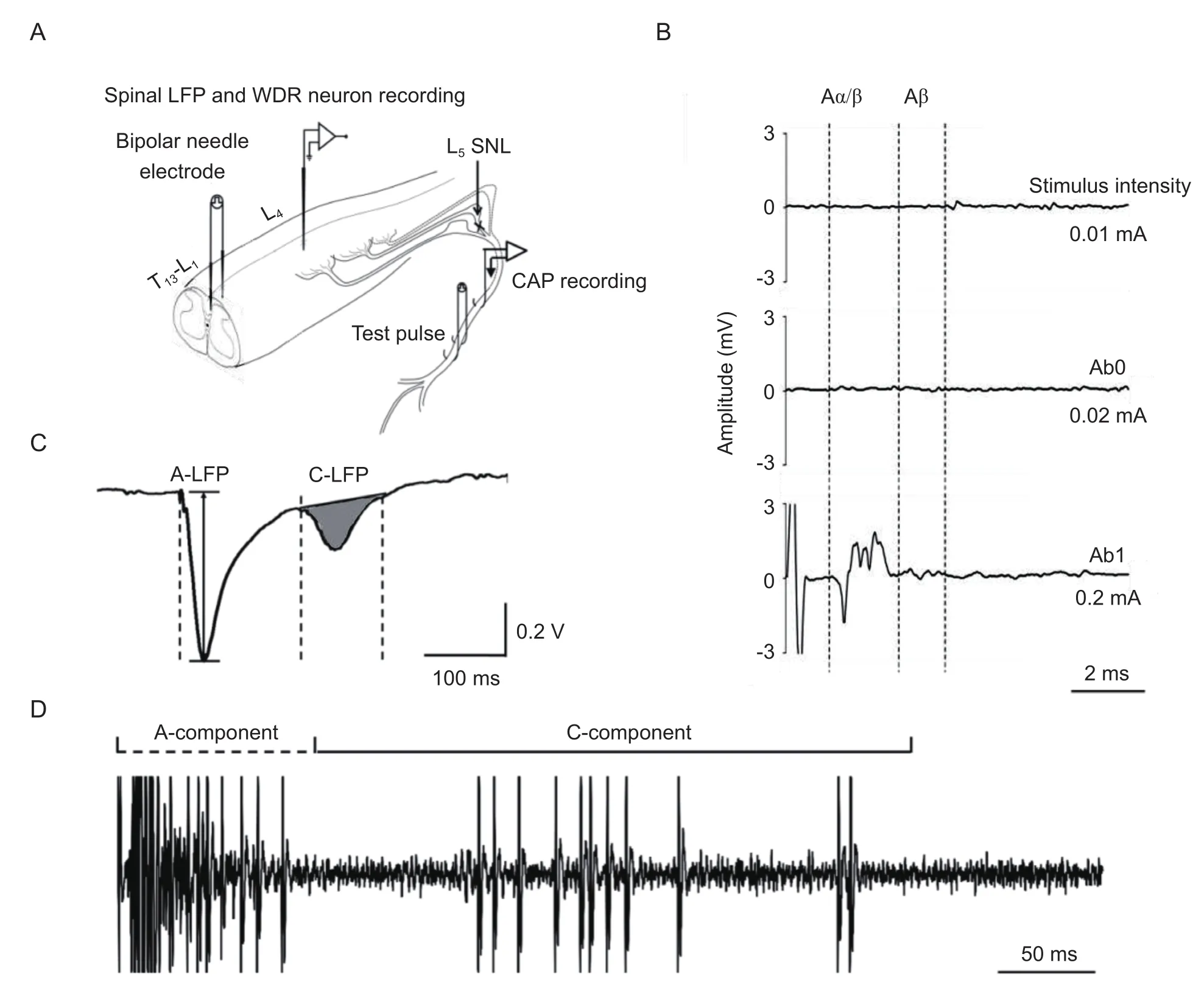
图1 电生理记录模式图和典型图Fig.1 Setup and represent figure of Electrophysiological recording
背根神经节局部注射RTX后5天,会造成外周TRPV1阳性神经元死亡,从而清除外周神经系统的TRPV1受体。相比于溶媒组(与图2A中相同),经RTX处理过的SNL大鼠在给予SCS后C-LFP的曲线下面积没有出现缩小,反而逐渐增大,并在10~30 min期间相比于基础值具有统计学差异(见图2C, D)。
3.清除外周TRPV1受体可以延长SCS对WDR神经元C成分的抑制。
通过在坐骨神经上施加电流强度 (0.1, 0.2, 0.3,0.4, 0.5, 1, 2, 3, 4, 5, 10 mA)逐渐增大的电刺激,WDR神经元的C纤维成分逐渐增多。在溶媒对照组中,给予SCS后0~15 min内,WDR神经元的C纤维反应受到抑制,并具有统计学差异 (见图3A, D)。而刺激后30~45 min内,C纤维反应逐渐恢复至基础值水平。在SCS刺激之前15 min脊髓表面给予AMG9810,并没有对SCS后WDR神经元C成分抑制的程度和时程产生显著影响(见图3B, D)。而在经RTX处理过的大鼠中,SCS的抑制作用甚至得以延长,表现为SCS后0~15和30~45 min时C纤维反应相比于基础值均有显著下降(见图3C, D)。
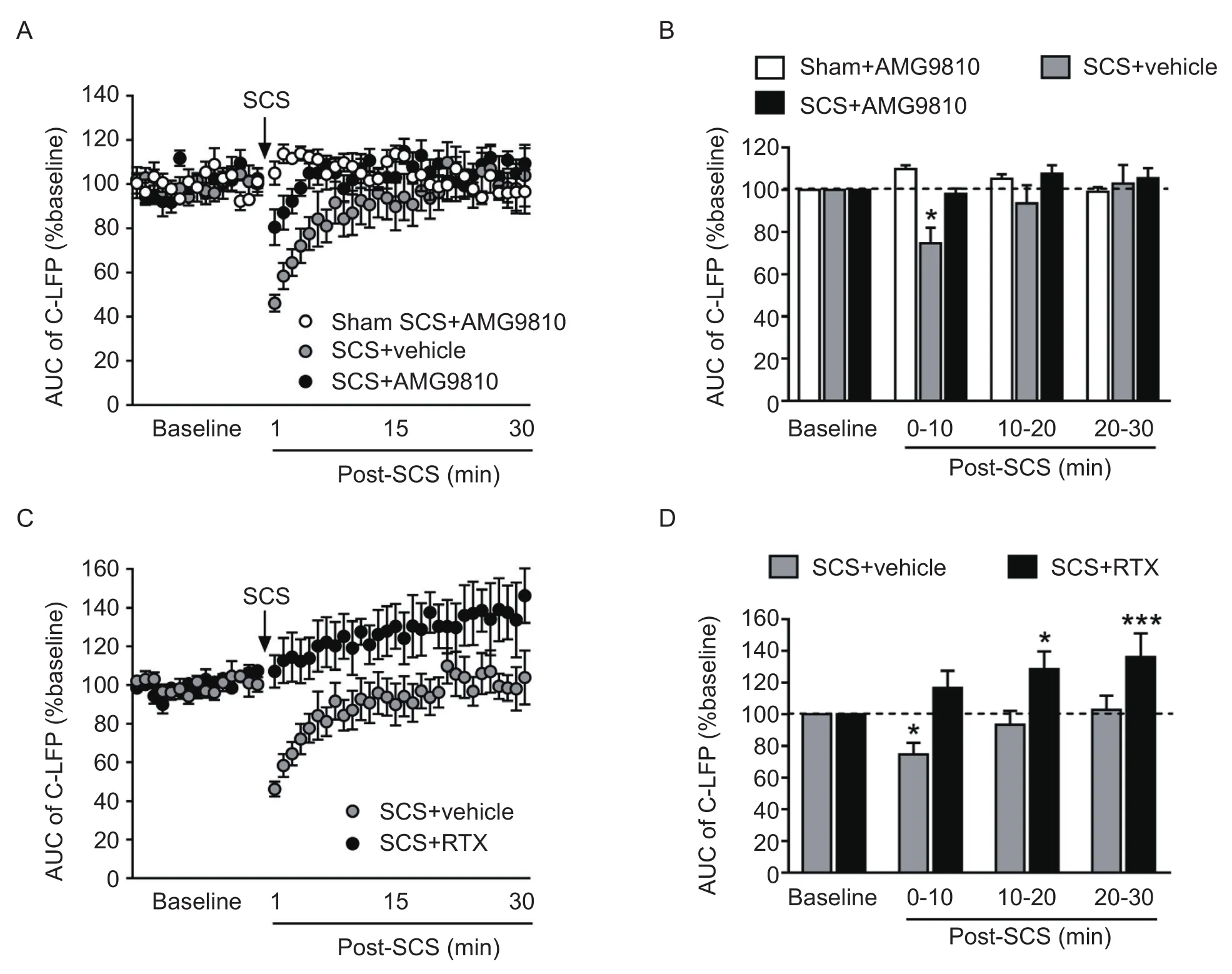
图2 TRPV1受体参与SCS对C-LFP的抑制作用 (n = 6,EM)Fig.2 TRPV1 receptors are involved in the inhibition of C-LFP by SCS (n = 6,EM)
讨 论
SCS作为一种行之有效的镇痛手段,其最初建立就是基于Wall和Melzack在1965年提出的疼痛门控理论(gate control theory, GCT)。因此,阐明脊髓节段的镇痛机制对于解释和改进SCS的镇痛效果具有重要的研究价值和意义。在之前的一系列研究中,作者已经在大鼠神经病理性疼痛模型中广泛证明了50 Hz的SCS可以缓解机械性痛觉过敏[4,12]。此外,利用在体电生理技术,我们发现SCS后神经病理性疼痛大鼠脊髓背角的C-LFP和WDR神经元C纤维成分的兴奋性都受到明显抑制[13,14]。同时,脊髓节段的内源性大麻素和CB1受体参与了SCS对C-LFP的抑制作用。在本研究中,作者针对内源性大麻素的潜在受体TRPV1在SCS对C-LFP和WDR神经元的伤害性传递抑制中的作用开展了进一步的探索。研究结果显示,脊髓节段局部给予TRPV1受体拮抗剂AMG9810可以减弱给予50 Hz SCS后C-LFP曲线下面积的缩小,但不影响SCS对WDR神经元C成分的抑制。利用TRPV1受体激动剂RTX,我们清除了外周的TRPV1受体及其阳性神经元。结果发现,在RTX处理的神经病理性疼痛大鼠中SCS不能抑制C-LFP,但是对WDR神经元C成分的抑制反而被延长。以上的结果提示,50 Hz SCS对脊髓背角浅层和深层伤害性信息传递抑制具有不同的潜在机制,而脊髓突触前TRPV1受体在其中发挥不同的功能。
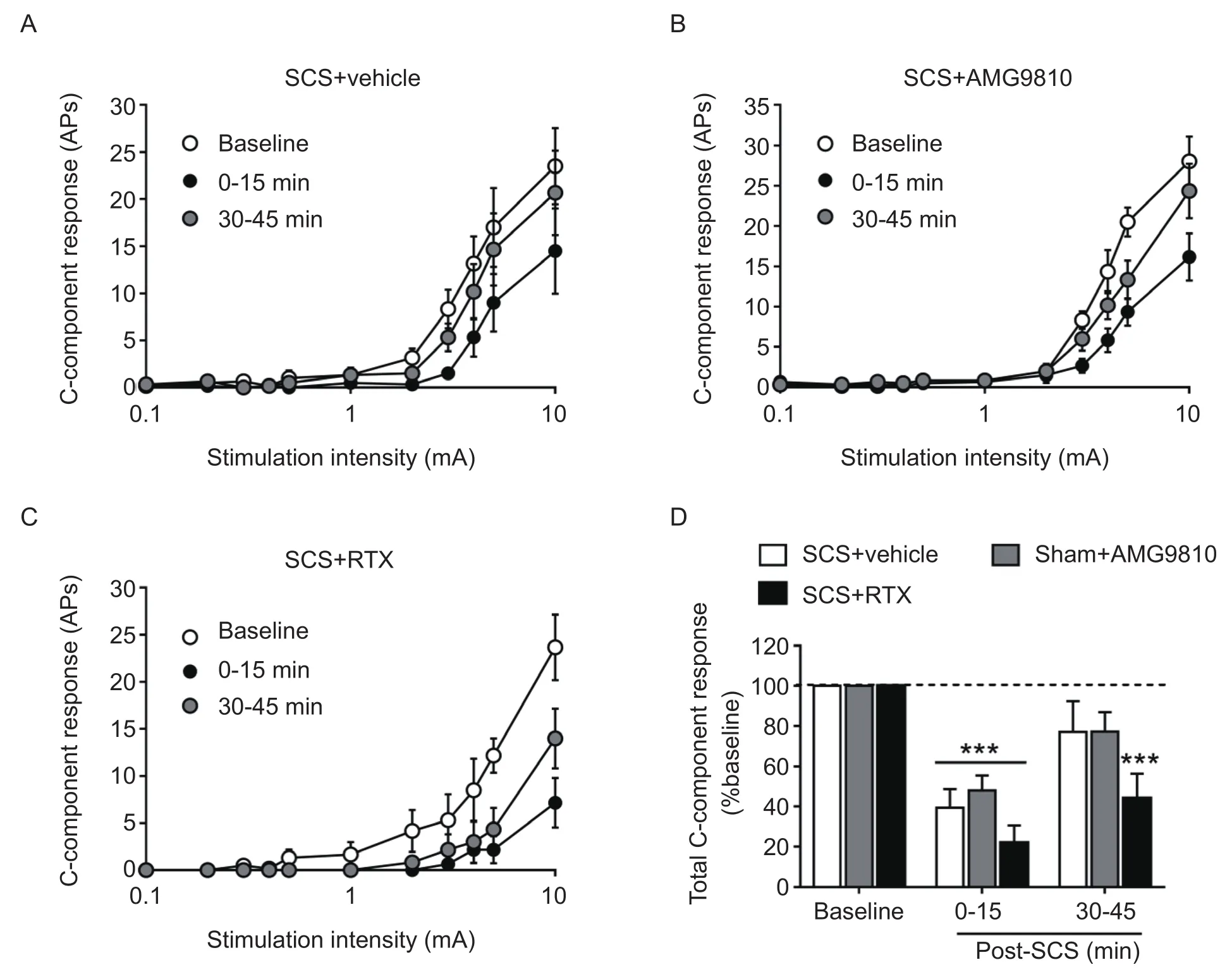
图3 SCS对WDR神经元C成分抑制作用中TRPV1受体的功能 (n = 6,EM)Fig.3 The role of TRPV1 receptors in SCS-induced inhibition of C-component of WDR neuronal responses (n = 6,EM)
TRPV1受体在神经系统中广泛表达,尤其是在外周背根神经节 (dorsal root ganglia, DRG) 神经元胞体和纤维上,脊髓中TRPV1受体也主要表达在DRG神经元传入纤维的末梢端,即突触前膜上。DRG神经元外周端上的TRPV1受体是一种非常重要的伤害性感受器,可以感受热、化学等伤害性刺激,并参与慢性痛的病理进程[15]。而脊髓突触前膜上的TRPV1则可以通过通透钙离子,参与神经递质的释放。作者之前的研究也显示,脊髓TRPV1可以参与突触可塑性,例如参与电刺激或伤害性刺激诱发的脊髓长时程增强(long term potentiation,LTP)[16]。而在本研究中发现,SCS可以诱发C-LFP和WDR神经元C成分反应的短时程抑制,即一种短时程的突触可塑性改变。本研究也首次发现脊髓的TRPV1受体参与这种短时程的突触可塑性变化,但这种参与具有脊髓层面的特异性,背后机制的差异还有待具体研究。
TRPV1受体激动剂RTX可以通过过度激活TRPV1受体,引起大量阳离子内流,从而杀死TRPV1阳性的外周神经元,进而清除外周TRPV1受体[17]。在本实验中,也利用这一方法,特异性的清除外周DRG神经元上的TRPV1受体,来研究脊髓背角突触前膜上TRPV1受体在SCS中的作用。但由于RTX注射后所剩下的C纤维均为TRPV1阴性,其生理特性与TRPV1阳性C纤维本就不同,例如TRPV1阴性C纤维多为非肽能,而TRPV1阳性纤维多为肽能。因此SCS在RTX处理后大鼠中对C纤维突触传递的抑制作用变化不能仅仅解释为TRPV1缺失,也有可能是因为C纤维构成的改变所导致的,这一点需要在未来的实验中加以鉴别。

