高脂饮食和丁酸钠干预对大鼠十二指肠线粒体能量代谢和肠钙吸收的影响
马淑华,唐 雪,张 凯,孙勇娟,李颖瑞,幸新干
(江南大学食品学院,食品营养与功能食品工程技术研究中心,江苏 无锡 214122)
高脂饮食(high-fat diet,HFD)是肥胖症发展的主要原因之一。而肥胖与代谢综合征如高血压、血脂异常、胰岛素抵抗以及骨质疏松密切相关。有研究表明,在相同HFD条件下,机体可能呈现出两种不同的体质量调节机制,倾向于增加体质量的个体称为肥胖易感(obesity prone,OP),能够抵抗肥胖发生的个体称为肥胖抵抗(obesity resistant,OR)。OP和OR两种表型在体质量调节、生理信号、蛋白表达和能量消耗等方面存在差异[1-3]。研究发现,肥胖会导致机体内活性氧(reactive oxygen species,ROS)生成增多,或使抗氧化防御系统作用减弱[4],过量的ROS还可通过破坏脂质和蛋白质等诱导氧化应激[5-6]。氧化应激在肥胖、糖尿病、高血压等慢性疾病的发病机制中起着至关重要的作用[7]。
研究表明,高脂饮食会导致机体氧化应激和ROS水平的增加,降低抗氧化能力,并改变消化系统(包括胃肠道)的氧化/还原状态[8]。十二指肠是消化系统最重要的部位,钙吸收率最高,同时也是钙离子跨膜转运的主要场所,其中钙吸收涉及3 个不同的步骤,包括钙流入胞内、被运送到基底缘以及钙通过交换蛋白转移入血液,整个过程属于主动转运[9-10],依赖线粒体ATP参与供能。因此,HFD诱导的十二指肠氧化还原失衡和线粒体功能异常可能影响肠钙吸收相关基因转录或蛋白质功能受损,导致钙吸收减少。已有研究表明,高脂日粮导致C57BL/6小鼠肠钙吸收减少,并且伴随着机体抗氧能力的降低和ROS的增加[11]。
线粒体是细胞能量生成、ROS来源及细胞凋亡的主要场所[12]。ROS过量会导致线粒体氧化应激,进而导致线粒体功能异常。线粒体功能障碍与肥胖、中风、心血管疾病、骨质疏松、神经退行性疾病等多种疾病相关。目前,线粒体已成为治疗疾病的一个新靶点[13-14]。
丁酸是经由肠道微生物发酵膳食纤维得到的短链脂肪酸,通常以钠盐的形式存在[15]。已有研究证实,丁酸钠(sodium butyrate,NaB)可降低体质量、改善机体氧化还原稳态、增强线粒体功能、改善胰岛素敏感性[16-17]。有研究报道丁酸可以改善肠道屏障功能,减轻胃肠道损伤[18-19];本课题组经体外研究亦发现NaB具有较好的抗氧化保护功能,但是其对高脂饮食条件下十二指肠氧化应激及线粒体能量代谢和钙吸收是否具有更好的改善作用鲜有报道。本实验以不同肥胖表型SD大鼠为实验对象,利用高脂饮食研究NaB干预对于OP和OR大鼠氧化还原状态、线粒体能量代谢和肠钙吸收的影响,为高脂饮食导致钙吸收减少和线粒体能量代谢紊乱提供营养学干预的参考。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性SD大鼠(生产许可证号:SCXK(沪)2012-0002) 上海斯莱克实验动物有限责任公司。
NaB(纯度>99%) 美国Sigma公司;组织线粒体分离试剂盒、线粒体膜电位检测试剂盒、ATP检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、Cu-Zn抑制SOD检测试剂盒、BCA法蛋白浓度测定试剂盒 碧云天生物技术研究所;总抗氧化能力(total antioxidant capacity,T-AOC)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、钙离子测定试剂盒 南京建成生物工程研究所;乙酰CoA、NADH、NAD+、降钙素(calcitonin,CT)、钙化醇(1,25(OH)2VD3)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 厦门慧嘉生物科技有限公司;TRizol提取RNA试剂盒 上海捷瑞生物工程有限公司;反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)相关试剂(Oligdt、dNTPs、RNA酶抑制剂(RNAse Inhibitor)、M-MLV逆转录酶、5×逆转录缓冲液)、Nrf2抗体 美国Thermo Scientific公司;QuantiTect SYBR Green PCR Kits 南京诺唯赞生物科技有限公司;引物由上海睿迪生物科技有限公司合成;其余试剂均为国产分析纯。
1.2 仪器与设备
NanoDrop分光光度计 上海采邑生物科技有限公司;7900HT实时荧光定量PCR仪 美国ABI 公司;5804R台式高速冷冻离心机、多功能酶标仪、MultiskanMK3酶标仪 美国Thermo Fisher公司;M5酶标仪 美国Molecular Devices公司;微量移液器 德国Eppendorf公司;MPI-B型化学发光检测仪、AB204-N电子天平、320 pH计 瑞士梅特勒-托利多仪器有限公司;恒温水浴锅 上海精宏实验设备有限公司。
1.3 方法
1.3.1 实验动物的选择分组
70 只4 周龄SPF级雄性SD大鼠饲养于江南大学实验动物中心SPF级别隔离屏障环境,饲养温度为(23f 2)℃、相对湿度(50f 10)%,昼夜循环光照12 h/12 h,自由进食相应的饲料和饮水,每周称量并记录体质量和采食量。所有实验操作均按照江南大学动物使用和福利协会要求进行。
实验动物适应性预饲养1 周后大鼠随机分组:正常组(CON,10 只)饲喂正常饲料(12.7%能量来源于脂肪);高脂组(HFD,60 只)饲喂高脂饲料(45.0%能量来源于脂肪)。持续饲喂至第8周,高脂组按体质量差异分为肥胖易感组(OP,体质量位于上1/3)和肥胖抵抗组(OR,体质量位于下1/3)[20]。OP和OR组随机分一半大鼠饲喂添加质量分数4% NaB[21]的高脂饲料,另外一半继续饲喂高脂饲料。第20周末注射水合氯醛麻醉后处死采样分析。正常日粮和高脂日粮配方见表1。
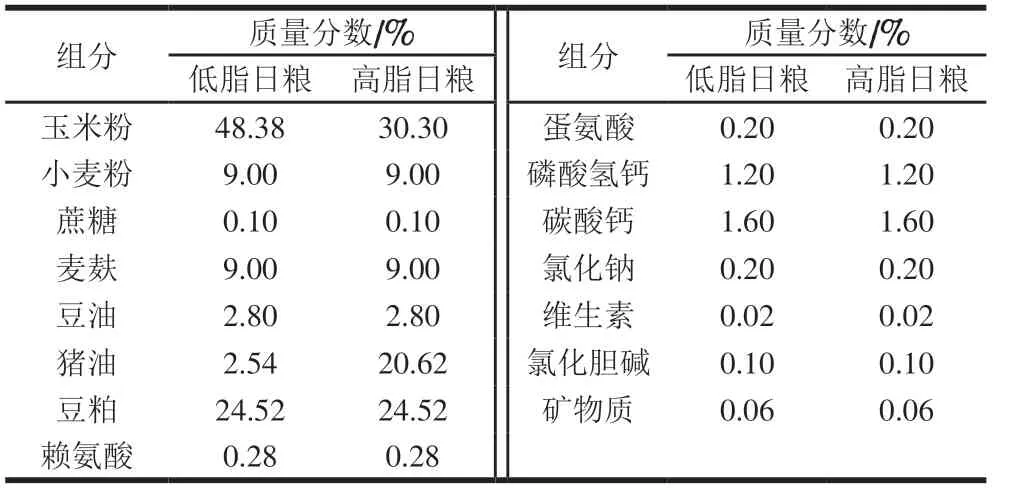
表 1 正常日粮和高脂日粮配方Table 1 Compositions of normal and high-fat diets
1.3.2 代谢平衡实验
第19周进行代谢平衡实验,预试3 d后,每天分别收集每笼大鼠的尿液和粪便,记录饲料消耗量,测定饲料钙、粪钙和尿钙含量。
1.3.3 组织样品的采集
大鼠饲喂至20 周,宰杀前禁食12 h,称体质量,麻醉后心脏取血,4 ℃、4 000 r/min离心10 min,分离血浆与血清。大鼠处死后,冰浴中迅速取出十二指肠,去除附着的黏膜,并在预冷的生理盐水中漂洗,滤纸擦干后准确称取50~100 mg十二指肠,2 h内进行线粒体提取;制备质量分数10%组织匀浆液,取上清液4 ℃、3 500 r/min 离心10 min用于ROS水平、氧化还原指标及蛋白质含量测定。其余组织液氮速冻后保存于-80 ℃待测。
1.3.4 十二指肠线粒体提取
新鲜十二指肠取出后称取100 mg于离心管中,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤后剪碎,加入1 000 μL线粒体分离缓冲液,冰浴匀浆。将匀浆液600hg、4 ℃离心5 min,小心收集上清液,11 000hg、4 ℃离心10 min,收集沉淀即为线粒体,加入40 μL线粒体存储液重悬后,使用BCA蛋白测定试剂盒测定蛋白质量浓度。
1.3.5 指标的测定
1.3.5.1 线粒体膜电位和ATP含量
将提取的线粒体加入线粒体存储液重悬后,严格按照试剂盒说明书进行线粒体膜电位(以对照组为100%)和ATP含量的测定。
1.3.5.2 线粒体NADH/NAD+和乙酰CoA含量
采用ELISA法测定十二指肠线粒体NADH/NAD+和乙酰CoA含量,按照试剂盒说明书进行操作。
1.3.5.3 ROS水平
取质量分数10%的十二指肠匀浆液,采用Luminol化学发光法测定,用Origin 7.0软件对实验峰面积进行积分,以1 mg蛋白的发光强度表示ROS水平。线粒体ROS水平以相对于CON组的含量表示。
1.3.5.4 氧化还原指标
T-AOC、MDA、SOD、Mn-SOD、还原型谷胱甘肽(reduced glutathione,GSH)、氧化型谷胱甘肽(oxidized glutathione disulfide,GSSG)、GSH-Px水平测定按照试剂盒说明书进行。
1.3.5.5 钙吸收指标
饲料和粪便中钙含量依据GB 5009.92ü 2016《食品安全国家标准 食品中钙的测定》中方法,经HNO3和HClO4(体积比20∶1)消化后测定,尿样中钙含量用钙测定试剂盒测定。钙净吸收量和钙贮留量分别按式(1)、(2)计算。

1.3.5.6 血清CT和1,25(OH)2VD3质量浓度
血清CT和1,25(OH)2VD3质量浓度采用ELISA试剂盒测定。
1.3.5.7 实时荧光定量PCR分析
采用TRizol试剂提取十二指肠总RNA。依据试剂盒说明书进行反转录。实时荧光定量PCR使用SYBR Green PCR Kits在7900HT实时荧光定量PCR仪中进行。数据通过2-ΔΔCt法进行相对定量计算,结果均为相对于对照组基因的改变量。引物序列如表2所示。
1.3.5.8 组织蛋白Western blot检测
取出20 mg组织加入200 μL含苯甲基磺酰氟的RIPA裂解液,冰浴下充分匀浆。充分裂解30 min后,4 ℃、12 000 r/min离心5 min,取上清液测定各组蛋白质量浓度并适当稀释至5 μg/μL。采用恒压80 V进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳30 min左右。设置每1 cm2电流为1~2 mA进行半干法转膜,时间1~2 h。转膜后用TBST洗涤3 次,加入含质量分数5%脱脂牛奶封闭液,将膜置于脱色摇床室温下摇动封闭2 h,封闭结束后用TBST洗涤3 次;加入一抗抗体(抗体稀释体积比为1∶1 000)于4 ℃孵育过夜;过夜后用TBST洗涤3 次;洗涤后将膜置于二抗中室温摇床摇动孵育2 h,孵育结束之后用TBST洗涤3 次。用化学发光法显色并成像,用凝胶成像系统进行扫描和拍照,在Image-Pro Plus软件中分析条带灰度。
1.4 数据统计与分析
结果均以平均值±标准误表示。采用SPSS 19软件对所有数据进行统计分析,运用单因素方差分析、Tukey检验进行组间差异比较,显著水平为P<0.05,极显著水平为P<0.01,高度显著水平为P<0.001。用GraphPad Prism 5.01软件作图。
2 结果与分析
2.1 NaB对高脂日粮诱导不同肥胖表型大鼠体质量增加量和采食量的影响
由图1A可知,第20周实验结束时,与CON组相比,OP组大鼠体质量增加量显著增加(P<0.05);OR组则与CON组无显著差异;与OP组相比,OP+4% NaB组大鼠体质量增加量显著降低(P<0.05);与OR组相比,OR+4% NaB组大鼠体质量增加量显著降低 (P<0.05)。由图1B可知,与CON组相比,OP组大鼠采食量升高;与OP组相比,OP+4% NaB组大鼠采食量降低;与OR组相比,OR+4% NaB组大鼠采食量略有降低,但各组均无显著性差异(P>0.05)。
2.2 NaB对高脂日粮诱导不同肥胖表型大鼠十二指肠 氧化还原稳态的影响
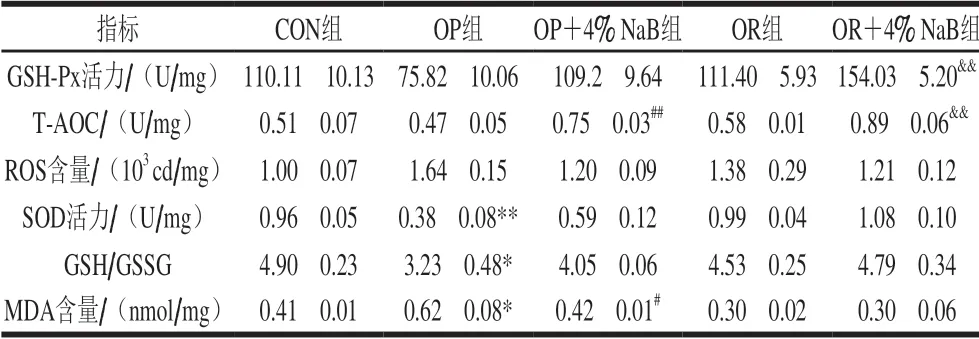
表 3 NaB对高脂日粮大鼠十二指肠抗氧化指标的影响Table 3 Effect of NaB on duodenum antioxidant indexes of high-fat diet fed rats
由表3可知,与CON组相比,OP组大鼠十二指肠SOD活力极显著降低(P<0.01),GSSH/GSSG显著降低(P<0.05),MDA含量显著升高(P<0.05);与OP组相比,OP+4% NaB组大鼠十二指肠T-AOC极显著增加(P<0.01),MDA含量显著降低(P<0.05);与OR组相比,OR+4% NaB组大鼠十二指肠T-AOC和GSH-Px活力极显著升高(P<0.01)。
2.3 NaB对高脂日粮诱导不同肥胖表型大鼠十二指肠抗氧化基因和蛋白表达水平的影响
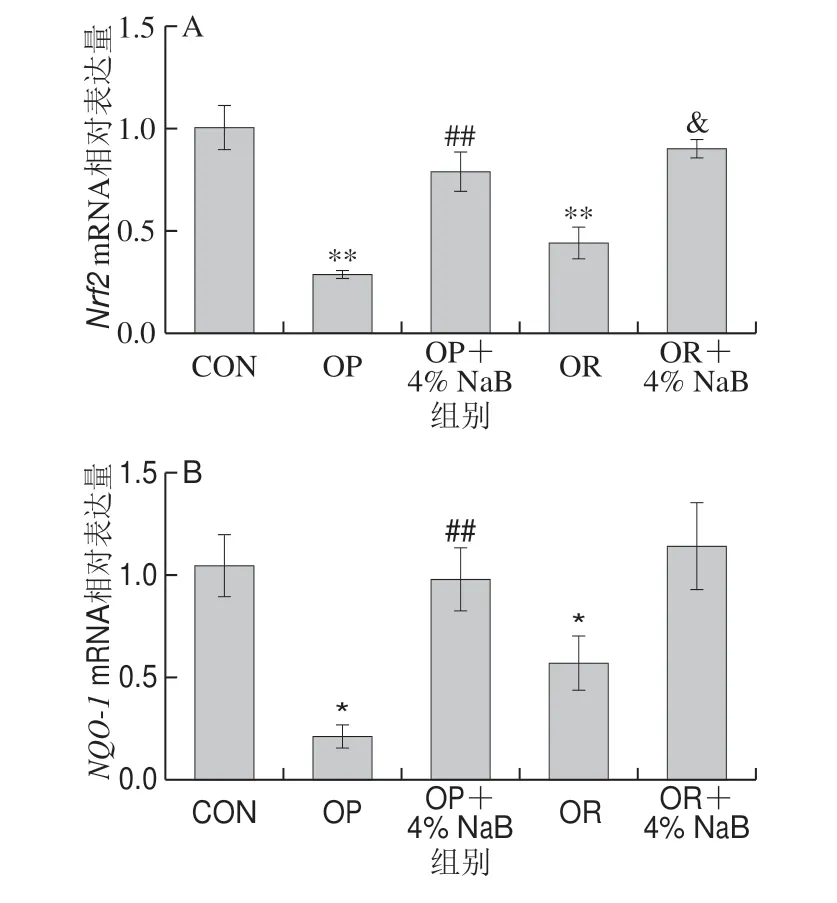
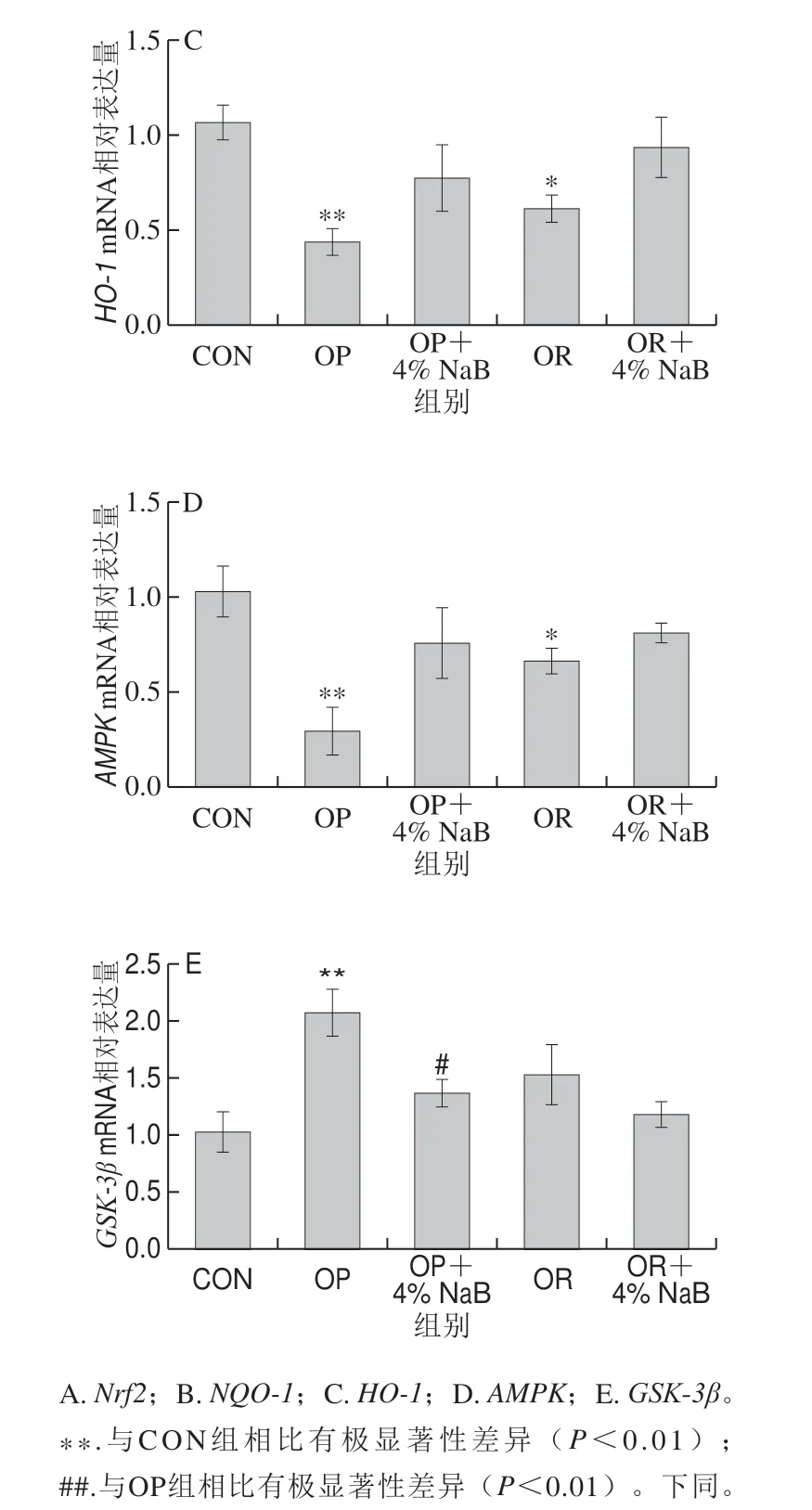
图 2 NaB对OP和OR组大鼠十二指肠抗氧化基因mRNA表达水平的影响Fig. 2 Effect of NaB on the expression of antioxidant-related genes in duodenum of OP and OR rats
由图2可知,与CON组相比,OP组大鼠十二指肠抗氧化相关基因Nrf2、HO-1和AMPKmRNA表达极显著下调(P<0.01),NQO-1mRNA表达显著下调 (P<0.05),GSK-3βmRNA表达极显著上调(P<0.01);与CON组相比,OR组Nrf2mRNA表达极显著下调 (P<0.01),HO-1、NQO-1和AMPKmRNA表达显著下调(P<0.05);与OP组相比,OP+4% NaB组大鼠十二指肠抗氧化相关基因Nrf2和NQO-1mRNA表达极显著上调(P<0.01),GSK-3βmRNA表达显著下调 (P<0.05);与OR组相比,OR+4% NaB组大鼠十二指肠抗氧化相关基因Nrf2mRNA表达显著上调(P<0.05);其他基因的mRNA表达无显著性差异(P>0.05)。
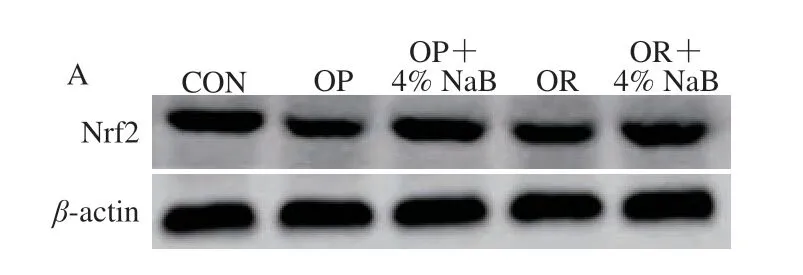

图 3 NaB对OP组和OR组大鼠十二指肠Nrf2蛋白表达水平的影响Fig. 3 Effect of NaB on the expression of Nrf2 protein in duodenum of OP and OR rats
由图3可知,与CON组相比,OP组大鼠十二指肠Nrf2蛋白表达显著下调(P<0.05);与OP组相比,OP+4% NaB组大鼠十二指肠Nrf2蛋白表达显著上调(P<0.05), 其他各组蛋白表达无显著性差异(P>0.05)。
2.4 NaB对高脂日粮诱导不同肥胖表型大鼠十二指肠线粒体能量代谢和内部抗氧化酶活力的影响
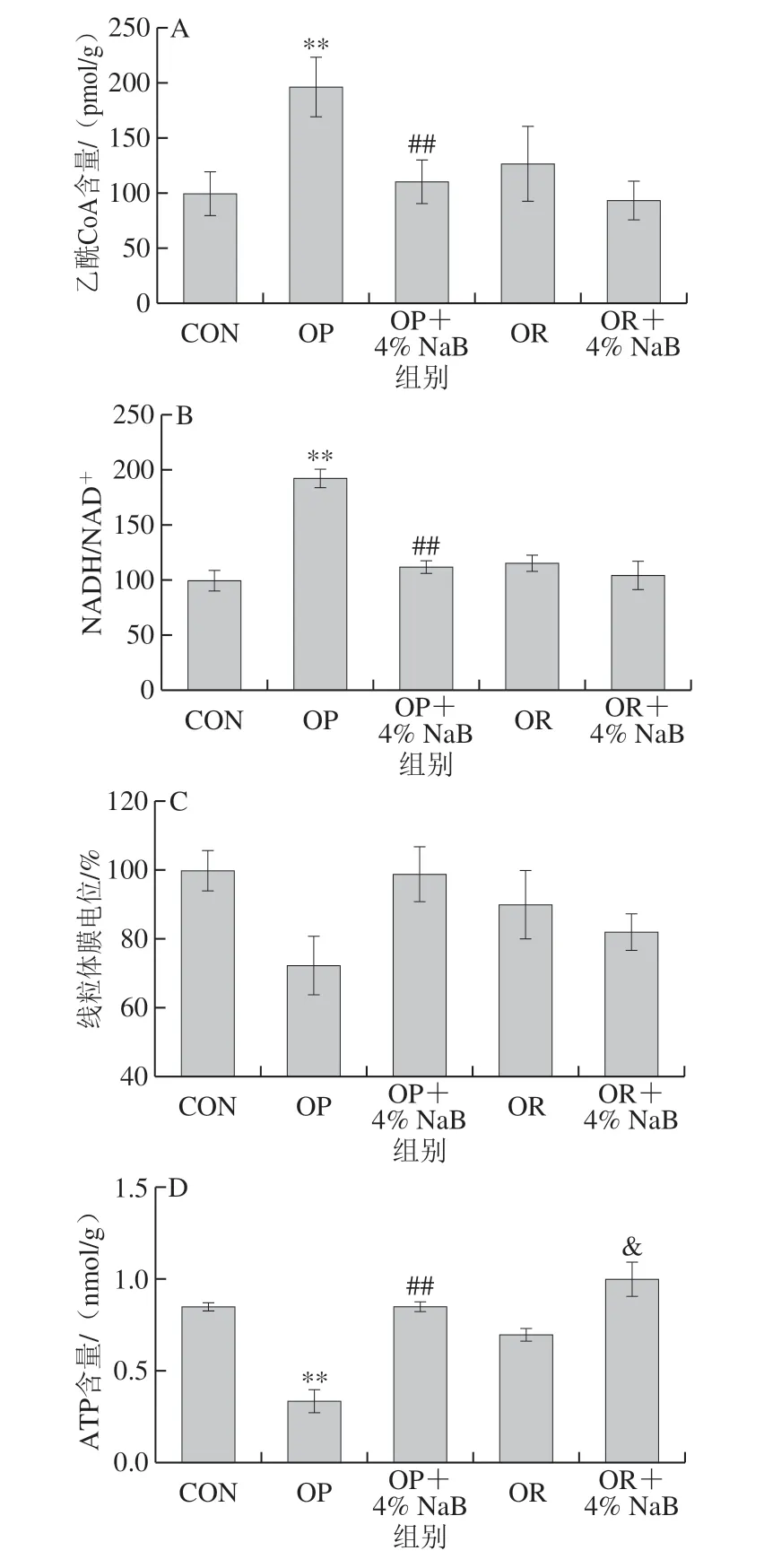

图 4 NaB对OP和OR组大鼠线粒体抗氧化酶活力和能量代谢的影响Fig. 4 Effect of NaB on mitochondrial antioxidant enzyme activities and energy metabolism in OP and OR rats
由图4可知,与CON组相比,OP组大鼠十二指肠线粒体能量代谢相关指标乙酰CoA含量、NADH/NAD+极显著升高(P<0.0 1),A T P 含量极显著降低 (P<0.01),线粒体抗氧化酶相关指标ROS相对含量极显著升高(P<0.01),Mn-SOD活力极显著降低 (P<0.01),GSH-Px活力显著降低(P<0.05);与CON组相比,OR组大鼠十二指肠线粒体能量代谢相关指标和线粒体抗氧化酶相关指标无显著性差异;与OP组相比,OP+4% NaB组大鼠十二指肠线粒体能量代谢指标乙酰CoA含量、NADH/NAD+极显著降低 (P<0.01),ATP含量极显著升高(P<0.01),线粒体抗氧化酶相关指标ROS相对含量极显著降低(P<0.01),Mn-SOD活力极显著升高(P<0.01),GSH-Px活力显著升高(P<0.05);与OR组相比,OR+4% NaB组大鼠十二指肠线粒体能量代谢相关指标ATP含量显著升高 (P<0.05),其他指标无显著性差异(P>0.05)。
2.5 NaB干预对高脂日粮诱导不同肥胖表型大鼠肠钙吸收的影响
由表4可知,与CON组相比,OP组大鼠钙平衡实验相关指标粪钙和尿钙含量显著升高(P<0.05),钙净吸收和贮留量极显著降低(P<0.01);与CON组相比,OR组大鼠钙平衡相关指标无显著性差异;与OP组相比,OP+4% NaB组大鼠钙平衡相关指标尿钙含量显著降低(P<0.05),钙贮留量显著升高(P<0.05);与OR组相比,OR+4% NaB组鼠钙平衡相关指标无显著性差异(P>0.05)。
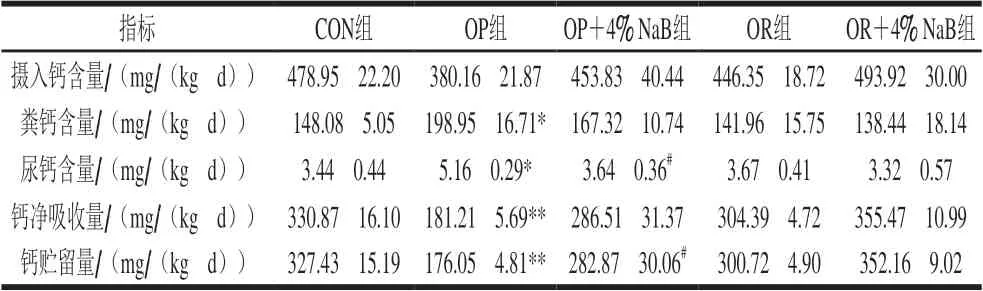
表 4 NaB对高脂日粮大鼠钙代谢平衡的影响Table 4 Effect of NaB on calcium metabolism balance in high-fat diet fed rats
2.6 NaB干预对高脂日粮诱导不同肥胖表型大鼠钙稳态及钙离子转运基因mRNA表达水平的影响
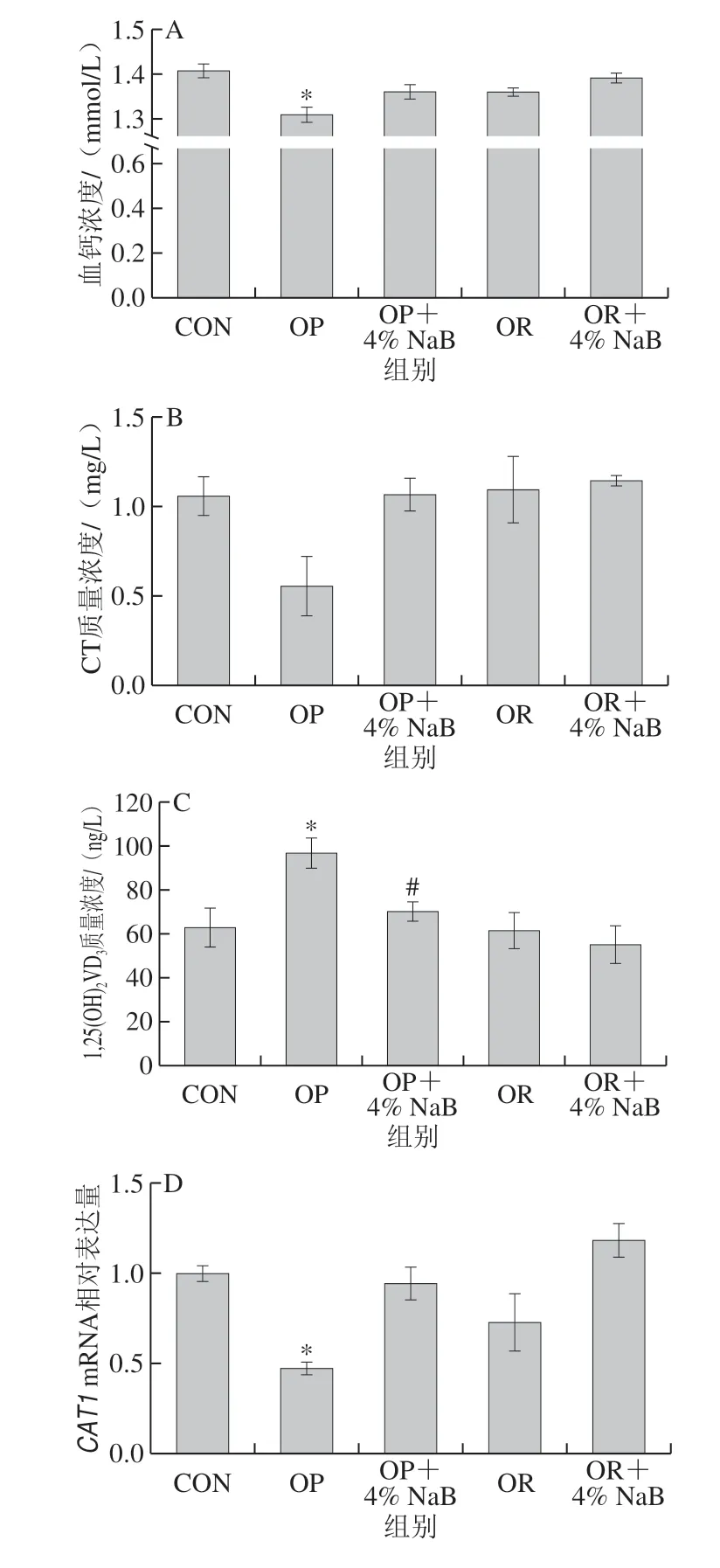
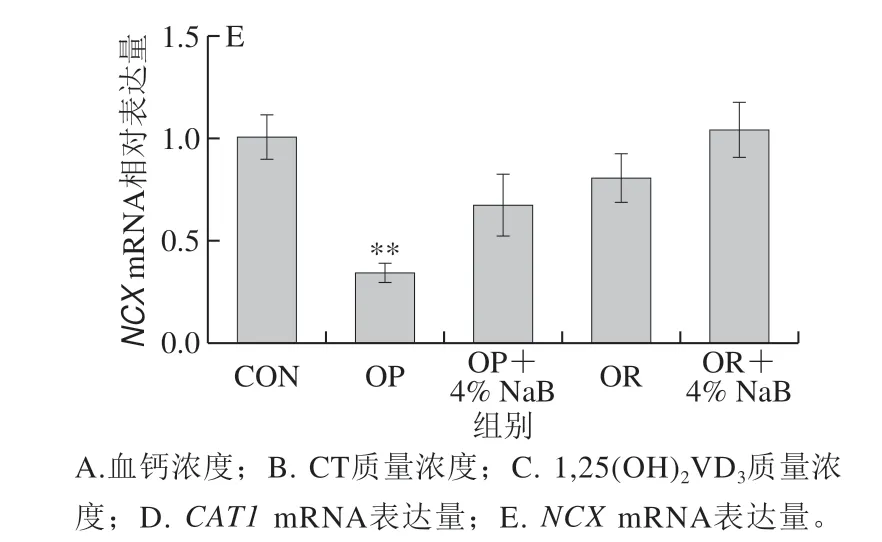
图 5 NaB对OP和OR组大鼠血液钙稳态指标和十二指肠钙离子转运相关基因mRNA表达水平的影响Fig. 5 Effect of NaB on the expression of blood calcium homeostasisrelated genes and duodenum Ca2+ transport-related genes in OP and OR rats
由图5可知,与CON组相比,OP组大鼠血液钙稳态相关指标血钙浓度、CT质量浓度显著降低(P<0.05),钙内稳态的调控激素1,25(OH)2VD3质量浓度显著升高 (P<0.05),十二指肠钙离子转运相关指标CAT1mRNA相对表达量显著降低(P<0.05),NCXmRNA相对表达量极显著降低(P<0.01);其他各组大鼠血液钙稳态和十二指肠钙离子转运相关指标均无显著性差异(P>0.05)。
3 讨 论
本研究显示,NaB干预显著降低了OP组和OR组大鼠的体质量增加量,但采食量没有显著性差异,说明NaB可以防止饮食引起的肥胖,此结果与Matheus[19]和 Gao Zhanguo[21]等的研究结果一致。机体在健康状态下氧化和抗氧化作用之间保持动态平衡,正常细胞代谢产生ROS,其在细胞信号传导途径中起关键作用[22]。当机体遭到攻击(如癌症、应激、营养过剩或缺失等)时,体内产生过量ROS,ROS和抗氧化防御之间的平衡被打破,容易引发氧化应激[23]。氧化应激可引起组织氧化损伤,改变胞内信号通路,是多种慢性疾病发生发展的核心 环节[24-26]。机体抗氧化酶(如SOD、GSH-Px、CAT)和非酶抗氧化物(如GSH和GSSG)共同参与ROS清除和氧化还原稳态的维持[27]。MDA是体内羟自由基等ROS攻击细胞内脂质的主要产物之一,上述几种抗氧化物质活力或含量可在一定程度上反映机体的氧化应激状态[28-29]。本研究结果显示,高脂饮食下,OP组和OR组大鼠MDA水平显著上升,SOD活力和GSH/GSSG显著降低。表明高脂日粮可能促进十二指肠脂质过氧化反应,降低抗氧化酶活力,介导组织氧化应激。饲喂NaB后,OP组大鼠T-AOC显著提高,OR组大鼠GSH-Px活力、T-AOC显著上升,且OP组和OR组大鼠SOD活力和GSH/GSSG均有一定程度提高,MDA、ROS水平基本恢复正常,表明NaB干预可调节十二指肠氧化还原状态稳态,提高组织抗氧化能力,具有抗氧化保护作用。Xing Xingan等[30]研究也发现0.3 mmol/L NaB孵育氧化损伤细胞可显著提高T-AOC、抗氧化酶(SOD、CAT、GSH-Px)活力和GSH/GSSG,降低MDA含量,与本研究结果相似。
Nrf2/ARE途径是调节氧化应激的重要信号传导途径。Nrf2控制几种抗氧化酶的表达,如CAT、GSH-Px和SOD[31]。研究发现,肥胖个体组织中Nrf2/ARE通路关键因子表达量降低,ROS水平升高,抗氧化应激能力减弱,线粒体功能异常[32-33]。抗氧化剂处理氧化损伤细胞MC3T3-E1可通过激活PI3K/Akt介导的Nrf2/HO-1途径来保护细胞免受氧化损伤[34]。AMPK是一种保守的丝 氨酸/苏氨酸激酶,是调节细胞能量稳态和代谢应激的关键传感器,包括神经变性、炎症和氧化应激等[35]。AMPK介导的GSK-3β失活可以增加Nrf2的核积累[36]。本研究结果显示,NaB干预可显著上调OP组和OR组大鼠十二指肠Nrf2、NQO-1、HO-1、AMPKmRNA表达,下调GSK-3βmRNA表达水平。Western blot结果也显示NaB显著上调OP组大鼠组Nrf2蛋白表达水平。Gessner等[37]发现抗氧化剂多酚物质可通过提高Nrf2及下游相关抗氧化基因的表达减轻十二指肠炎反应;Xing Xingan等[30]发现,NaB孵育氧化损伤细胞可显著上调Nrf2、NQO-1mRNA表达水平,增强细胞抗氧化能力,这与本研究结果一致。表明NaB可能调节十二指肠Nrf2/ARE氧化应激信号通路相关抗氧化基因的表达,提高细胞抗氧化能力,维持氧化还原稳态。
线粒体是机体进行能量代谢的主要部位,同时也是ROS产生和攻击的主要靶点,过量ROS极易对线粒体膜、蛋白以及线粒体DNA造成损伤,引起线粒体功能异常,主要表现为线粒体DNA及线粒体内含物的减少、氧化磷酸化等能量代谢过程受损、ATP合成减少[38]。NADH和NAD+的氧化还原状态是连接分解代谢途径、线粒体氧化磷酸化以及产生ATP的关键节点[39]。乙酰CoA是主要的二碳单位代谢物,可通过三羧酸循环和氧化磷酸化产生ATP。研究表明,鱼藤酮处理可导致细胞线粒体产生氧化损伤,电子呼吸链受到抑制,显著增加NADH/NAD+, 升高乙酰CoA水平[40]。当机体线粒体功能受损时,能量供给不足,NADH过量且NAD+缺乏,造成线粒体氧化还原状态失衡、电子泄漏和氧化应激增强,膜电位降低,ROS产生增加,ATP生成异常[41-43]。Mn-SOD和GSH-Px主要存在于线粒体基质中,是线粒体内重要的抗氧化酶,对清除线粒体ROS、维护线粒体氧化还原稳态具有重要意义[44]。本研究发现,饲喂NaB可增强OP组和OR组大鼠十二指肠能量代谢ATP生成量,平衡乙酰CoA含量和NADH/NAD+,降低ROS含量,提高线粒体内部抗氧化酶Mn-SOD、GSH-Px活力,其中OP组效果最好,OR组无显著性影响。已有研究发现抗氧化剂白藜芦醇可通过提高AF小鼠Mn-SOD、GSH-Px活力恢复线粒体能量代谢功能[45],与本研究结果基本一致,表明NaB可提高十二指肠线粒体ATP生成和相关抗氧化酶活力,有效清除过量ROS,进而维持线粒体功能,具体作用机制还有待进一步研究。
钙占成年人体质量的1%~2%。在牙齿和骨骼中有超过全身99%的钙。膳食钙摄入量对维持机体骨骼健康有重要影响。由摄入不足或肠道吸收不良引起的慢性缺钙是骨量减少的重要原因之一[46]。肠道微生物发酵产 生短链脂肪酸降低肠道pH值,可增加结肠中钙的生物利用度[47]。钙代谢平衡实验结果显示,与CON组相比,OP组大鼠钙吸收和贮留量显著降低,添加4% NaB饲喂OP组大鼠可在一定程度上恢复肠钙吸收。此外,高脂饲喂和NaB干预对OR大鼠均无显著性影响。表明高脂日粮减少肥胖个体肠钙吸收,NaB可增加肠道钙吸收水平。
VDR和CAT1是钙吸收(跨膜转运)重要基因[48],为了进一步探究NaB干预对十二指肠钙吸收和钙代谢的影响,本研究测定了血钙浓度、钙稳态指标(1,25(OH)2VD3、CT质量浓度)和钙离子转运关键基因(CAT1、NCX)mRNA表达水平。已有结果证实ROS的产生和去除起到调节线粒体功能的重要作用,ROS可以调节细胞凋亡、信号转导通路途径以及调控基因表达[49]。过量的ROS会导致机体氧化还原状态失衡,半胱氨酸残基-巯基形成二硫键[50]。因此,钙通道会受到ROS或活性氮物质的影响[51-52]。研究显示,ROS调节NCX的活性,并受NADH/NAD+氧化还原电位的影响[53]。本研究结果证实CAT1、NCX在OP组大鼠十二指肠中表达量显著降低。VD3调控钙吸收[54],本研究结果显示高脂饲喂可导致血浆1,25(OH)2VD3质量浓度升高,这表明机体处于缺钙状态,但是肠钙吸收受到抑制并不是因为1,25(OH)2VD3的调控机制受损。由于十二指肠氧化应激导致胞内钙离子转运和血钙浓度减少,因此高脂饲喂大鼠可能引起其小肠钙吸收减少、排出量增加,这与钙代谢平衡实验的结果一致。通过NaB干预可在一定程度上恢复OR大鼠钙代谢水平并提高OP大鼠钙净吸收量和血钙浓度。由于钙吸收减少与ROS产生密切相关,且钙离子转运受机体线粒体能量代谢和抗氧化状态的调控,推测NaB可通过增强机体抗氧化能力、维护线粒体稳态成为预防肥胖引起钙吸收减少的重要靶点。
本研究对NaB干预不同肥胖表型SD大鼠的十二指肠抗氧化保护作用、线粒体能量代谢和钙调节机制进行了探究。实验结果表明高脂饮食可导致十二指肠产生氧化应激,线粒体功能受损,血钙浓度减少,钙吸收能力减弱,日粮中添加4% NaB可能具有缓解HFD引起的十二指肠线粒体损伤、增强十二指肠抗氧化能力、维护血液钙稳态,增加钙离子吸收量的潜力,且OP大鼠对高脂饮食和NaB干预敏感性高于OR大鼠。本研究结果对于肥胖的预防及肥胖导致钙吸收减少和线粒体能量代谢紊乱具有重要价值。

