源自轻腌大黄鱼的特定腐败菌特性及腐败能力
郭全友,单 珂,,姜朝军,李保国
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海理工大学医疗器械与食品学院,上海 200093)
大黄鱼(Pseudosciaena crocea)是我国重要的经济鱼类,其体色金黄、味道鲜美、蛋白丰富,深受消费者喜爱[1]。盐制大黄鱼是以大黄鱼为原料,经剖片、清洗、盐渍(调味)、干燥或不干燥和包装等工艺制成,分为盐渍(水分质量分数不低于60%,盐分质量分数不高于6%)、半干(水分质量分数40~60%,盐分质量分数不高于6%)和干(水分质量分数不高于40%,盐分质量分数不高于11%)大黄鱼,其中盐渍和半干大黄鱼符合轻腌加工的消费要求[2],避免了传统腌制加工高盐、色泽易氧化和口感不佳等问题,满足人们对低盐和健康饮食的需求,但由于其高水分和高蛋白等特点,在贮藏过程中易腐败变质,产品货架期缩短,造成经济损失。
研究表明微生物活动是导致水产品腐败的最主要因素[3],鱼类刚死亡时鱼体菌群复杂多样,不同种类的细菌具有不同的耐受能力,在鱼体内在和外在因子的影响下,鱼体中只有部分适合生存和繁殖的菌群参与腐败过程,并产生腐败臭味和异味代谢产物,最终成为该产品的特定腐败菌(specific spoilage organism,SSO)[4-5]。水产品种类、栖息环境、包装及贮藏方式等差异导致SSO亦不相同,如假单胞菌是有氧冷藏淡水鱼的SSO[6-7],葡萄球菌属是高盐加工水产品的SSO[8]。轻腌大黄鱼低温(5 ℃)贮藏货架期终点的SSO为普通变形杆菌和蜂房哈弗尼菌[9],研究显示两者多源于土壤和水体,是冷藏及真空包装水产品和肉制品的主要腐败菌[10-11],易导致肉制品腐败及造成食物中毒,因此对于腐败菌的监控、保障产品质量及减少经济损失具有重要意义。
每种水产品SSO的腐败范围和腐败能力不同,通常将菌株接回无菌鱼块或鱼汁中,测定菌落总数、总挥发性盐基氮(total volatile base nitrogen,TVB-N)含量、生物胺含量和腐败代谢产物产量因子等作为其腐败能力的评价指标。许振伟等[12]以感官评价、TVB-N含量、三甲胺(trimethylamine,TMA)含量及腐败代谢产物产量因子YTVB-N/CFU和YTMA/CFU等为指标,定量分析冷藏大黄鱼优势菌(腐败希瓦氏菌和假单胞菌等)的腐败能力,发现腐败希瓦氏菌的腐败能力强于假单胞菌及其复合菌。Wang Hang等[13]把嗜水气单胞菌、杜氏假单胞菌和腐败希瓦氏菌等接种于鱼块中,测定4 ℃贮藏中的TVB-N含量、硫代巴比妥酸反应产物值、生物胺和挥发性物质含量等变化,分析比较草鱼中这3 种腐败菌的腐败能力。
目前,研究者对轻腌大黄鱼低温和常温贮藏下的货架期及腐败菌进行了研究[9],但鲜有针对该产品优势腐败菌的腐败能力进行探究,因此本实验以轻腌大黄鱼优势腐败菌(普通变形杆菌和蜂房哈弗尼菌)为对象,分别将其接种到无菌鱼块中,分析低温(5 ℃)贮藏中接种鱼块感官品质、微生物和理化(pH值、TVB-N含量、生物胺含量和挥发性成分)特征等变化,评价和比较两者的腐败能力,为轻腌大黄鱼的工艺优化及靶向抑菌、延长产品货架期等提供参考依据。
1 材料与方法
1.1 菌株、材料与试剂
菌株分离自5 ℃贮藏货架期终点的轻腌大黄鱼,经Sherlock MIS微生物鉴定系统鉴定后,采用16S rRNA测序确认普通变形杆菌(Proteus vulgaris,序列号:KY684257)和蜂房哈弗尼菌(Hafnia alvei,序列号:KY684258)为优势菌,菌相比例分别为58.9%和35.9%[9]。
轻腌大黄鱼(真空包装)购自宁德市蔡氏水产有限公司,其盐分质量分数为(2.00f 0.12)%,水分质量分数为(60.79f 2.24)%,水分活度为0.96f 0.02,pH值为6.20f 0.04,冷藏运到实验室,-18 ℃冷冻备用。
高氯酸、硼酸、氢氧化钠、酚酞、营养肉汤培养基、营养琼脂培养基、氯化钠 国药集团化学试剂有限公司;M035-硫化氢细菌微量生化鉴定管 北京 陆桥技术股份有限公司;GEN III板、BUG培养基 美国BIOLOG公司。
1.2 仪器与设备
ZM-100全自动不锈钢反压高温蒸煮锅 广州标际包装设备有限公司;MIR-153型高精密度低温培养箱 上海一恒科学仪器有限公司;SW-CJ-1FB超净台 上海博迅实业有限公司医疗设备厂;KDN-103F自动定氮仪 上海纤检仪器有限公司;微生物半自动鉴定仪 美国BIOLOG公司;Sherlock MIS微生物鉴定系统 美国MIDI公司;7890A气相色谱(gas chromatography,GC)仪、1200型高效液相色谱仪 美国Agilent公司;漩涡混合器QT-2 上海琪特分析仪器有限公司;HI2216 pH计 哈纳沃德仪器(北京)有限公司;DVB-PDMS 65 μm萃取头 美国Supelco公司;GC-MS-QP2010气相色谱-质谱(GC-mass spectrometer,GC-MS)联用仪 日本岛津公司;YO2G-03微波杀菌器 深圳市兰博特科技有限公司。
1.3 方法
1.3.1 细菌特性测定
1.3.1.1 菌悬液制备
普通变形杆菌和蜂房哈弗尼菌保藏于-80 ℃冰箱中。用时将普通变形杆菌和蜂房哈弗尼菌接种于营养肉汤培养基中,25 ℃培养24 h,活化后在营养琼脂培养基表面划线,25 ℃培养24~48 h得到单菌落,挑取单菌落于10 mL无菌营养肉汤培养基中,25 ℃培养24~48 h,菌落数约108CFU/mL,备用。
1.3.1.2 生理生化特性分析
根据GEN III板操作说明进行,两株菌在BUG培养基上划线25 ℃培养24 h,用棉签挑取单一菌落,接种到IF-A接种液中,逐步调整菌悬液浓度,依据浊度仪使用说明,透光率为90%~98%即为合适的接种量,将调整好的菌悬液加至微孔板中,每孔100 μL,25 ℃恒温培养,使用OmniLog读数仪读取数据,以显色反应的剧烈程度(阴/阳性)表示菌株对该底物的耐受性和敏感程度。
GEN III微孔板中包含71 种碳源,参照郑华等[14]的方法将其分为6 类,分别为糖类(25 种)、羧酸类(17 种)、氨基酸类(10 种)、胺/酰胺类(6 种)、脂肪酸/脂类(6 种)和其他类(7 种);微孔板包含pH值(为5和6)和NaCl(质量分数为1%、4%和8%)耐受性测试孔。另外进行pH 7耐受性测试,配制pH 7的无菌营养肉汤,分别接种两种菌,25 ℃培养24~48 h,菌液混浊即为阳性。
硫化氢测试:使用细菌微量生化鉴定管,根据说明书挑取单菌落接种于安瓿瓶中,置于25 ℃培养24 h,瓶内出现黑色沉淀,说明菌株能够产生硫化氢。
1.3.1.3 磷脂脂肪酸组成分析
采用Sherlock MIS微生物鉴定系统进行细胞磷脂脂肪酸分析,依据使用手册,将两种菌分别进行破壁、皂化、脂肪酸甲基化、萃取和碱洗等步骤,获取细菌磷脂脂肪酸萃取液,置于GC仪进行测定。色谱条件如下:气路设置H2流速30 mL/min,空气流速400 mL/min, N2流速25 mL/min;19091B-102毛细管柱(25 mh 200 μm,0.33 μm),柱温250 ℃,流量4 mL/min,进样量为1 μL,分流比1 0∶1;检测器为火焰离子化检测仪,温度 为250 ℃。
1.3.2 两种菌的腐败能力测定
1.3.2.1 无菌鱼块制备及鱼块接种
无菌鱼块制备:参照许振伟等[15]的方法并做一定的修改,即取冷冻轻腌大黄鱼,平放于覆有保鲜膜的无菌不锈钢台面上,用剪刀从鱼鳃处切开,剥去鱼皮,取背脊处鱼肉,修整鱼块至大小形状一致,每块25~30 g,放入无菌包装袋中,置于微波杀菌器中杀菌即至无菌状态。
鱼块接种:取菌悬液,稀释至106~107CFU/mL,将无菌鱼块浸入菌液中20 s,鱼块菌数达到约104CFU/mL, 即为初始接种量,未接种的无菌鱼块作为空白对照。分别放入无菌袋中封口,低温(5 ℃)贮藏,每隔2 d,进行感官评价、菌落总数、pH值和TVB-N含量等测定;取初始点(0 d)、中间点和腐败终点,测定鱼块生物胺种类和含量;另取初始点和近腐败终点鱼块测定挥发性成分。
1.3.2.2 感官评价
挑选5 名专业人员,组成感官评价小组,以新鲜轻腌大黄鱼产品为标准,结合轻腌大黄鱼的外观、质构、气味和滋味等指标进行综合评价。评价标准采取5 分制,1 分为最高分,5 分为感官拒绝点,即腐败终点,取平均值。表1为感官评分标准。

表 1 感官评分标准Table 1 Criteria for sensory evaluation
1.3.2.3 菌株生长动力学建模与评价
参照GB 4789.2ü 2016《食品安全国家标准 食品微生物学检验菌落总数测定》测定菌落总数,取接种鱼块10 g到无菌研钵中,加90 mL无菌生理盐水,充分研匀,10 倍梯度稀释,选择合适梯度,涂布于营养琼脂培养基平板,每个稀释度涂2 块平板,25 ℃培养24~48 h后计数。模型建立采用修正的Gompertz方程拟合菌株生长动力学曲线[16],具体见式(1)。
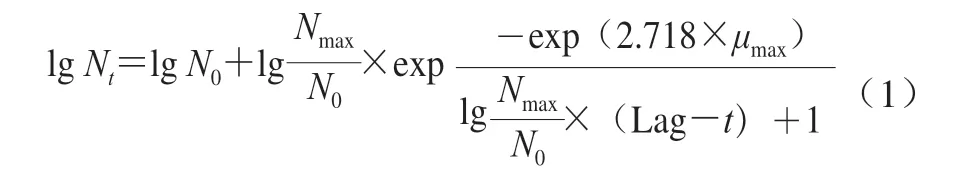
式中:t表示贮藏时间/h;Nt表示t时刻对应的菌 数/(CFU/g);N0表示初始菌数/(CFU/g);Nmax表示最大菌落数/(CFU/g);μmax表示最大比生长速率/h-1;Lag表示延滞期/h。
模型评价采用决定系数R2、准确度Af、偏差度Bf和均方根误差(root mean squared error,RMSE)等对模型拟合优度进行评价,其中R2、Af和Bf越接近于1,RMSE越接近于0,表明预测效果越好,评价方程见公 式(2)~(4)。其中Xcal为菌落总数预测值,Xobs为菌落总数实测值,n为实验次数。

1.3.2.4 鱼块pH值测定
取10 g鱼肉于研钵中,加入90 mL无菌生理盐水,充分研磨均匀,使用pH计进行测定,重复两次,取平均值。
1.3.2.5 鱼块TVB-N含量和腐败能力定量分析
TVB-N含量的测定参照GB 5009.228ü 2016《食品安全国家标准 食品中挥发性盐基氮的测定》进行。
《形形色色的植物》这一篇课文,学生们只是通过课文的介绍,知道植物世界是一个庞大的、复杂的世界。但是只是通过简单的文字介绍还远远不够,可以通过让学生亲自去植物园中去观察各种各样的植物,让学生切实的感受到植物世界的纷繁。让学生通过观察,去感受这个世界,进而进一步的理解课文上所讲解的内容。
腐败能力以腐败代谢产物产量因子YTVB-N/CFU作为腐败能力定量指标,具体见式(5),每组平行测定2 次,取平均值。

1.3.2.6 生物胺含量测定
生物胺含量参考GB 5009.208ü 2016《食品安全国家标准 食品中生物胺的测定》高效液相色谱法进行,测定接种两株菌株的鱼块和空白对照鱼块的生物胺组成及含量,每组平行两次,取平均值。
1.3.2.7 挥发性成分测定
取初始和近腐败终点的接种鱼块,空白鱼块作为对照,按料液比1∶3(m/V)加入饱和食盐水,冰水浴匀浆,倒入样品瓶中,在萃取温度60 ℃下平衡20 min,将65 μm DVB/PDMS萃取头插入样品瓶顶空部位,萃取温度60 ℃,平衡10 min,顶空萃取40 min后取出萃取头,迅速用GC-MS联用仪进行分析。
G C 条 件: 色 谱 柱: D B - 5 M S 毛 细 管 柱(30 mh 0.25 mm,0.25 μm);升温程序:毛细管柱初温40 ℃,保持2 min,以6 ℃/min升高到200 ℃保持3 min,再以10 ℃/min上升到250 ℃保持3 min;载气:氦气,流速1.0 mL/min;不分流进样;采用恒线速率,分流比1∶20;进样口温度250 ℃。
MS条件:电子电离源;离子源温度230 ℃;电子能量70 eV;质量扫描范围50~400m/z;溶剂切除时间2 min;传输线温度270 ℃。
定性和定量:与NIST Library(10.7万 种化合物)和Wiley Library(32万 种化合物,Version 6.0)进行匹配,取匹配度85%以上物质,结合保留时间对实验中检测到的物质进行定性,按峰面积归一化法,计算化合物相对含量。
1.4 数据处理与分析
2 结果与分析
2.1 菌株表型、生理生化与碳源利用特征

表 2 普通变形杆菌和蜂房哈弗尼菌生理生化和碳源利用特性Table 2 Physiological and biochemical characteristics and carbon source utilization profiles of Proteus vulgaris and Hafnia alvei
普通变形杆菌和蜂房哈弗尼菌为革兰氏阴性、短杆菌、兼性厌氧,均属肠杆菌科,多存在于人和动物的肠道、水和土壤中,皆为条件致病菌,可造成食物中 毒[17-18]。菌株生理生化和碳源利用特征见表2。普通变形杆菌和蜂房哈弗尼菌分别在pH 5、6、7时均能生长,表明两株菌对低酸性环境具有一定耐受性;NaCl耐受性结果表明在质量分数1%和4%时两株菌生长良好,8%时生长受到抑制,而轻腌大黄鱼盐分质量分数不高于6%,说明两株菌在轻腌大黄鱼中均能正常生长。普通变形杆菌产硫化氢,蜂房哈弗尼菌不产硫化氢,硫化氢是细菌分解含硫氨基酸如半胱氨酸和蛋氨酸后产生的,会导致水产品产生令人难以接受的腐败气味。
碳源是微生物生长的主要能源,鱼类腐败初期碳水化合物被腐败微生物氧化成CO2和H2O,当简单的和可利用的碳水化合物被消耗完后,才会发生腐败[19],腐败产物和代谢速率与菌种、环境(如盐分、温度)和能源等差异性有关。由表2可知,普通变形杆菌能利用糖类7 种、氨基酸4 种、羧酸类3 种以及酯类1 种;蜂房哈弗尼菌能够利用糖类7 种、氨基酸类4 种、羧酸类5 种以及酯类1 种。两株菌利用的碳源物质种类较为相似,具体物质略有差异。微生物对碳源的利用与其代谢能力相关,研究显示,添加0.5%的NaCl能够提高普通变形杆菌对葡萄糖的利用程度[20];微生物能够代谢氨基酸,在食品中会生成氨和含硫物质等,如谷氨酸的氧化/还原可以产生乙酸、丁酸、二氧化碳、氨和氢,导致食物产生令人讨厌的腐臭气味[19]。
2.2 细菌磷脂脂肪酸组成特征
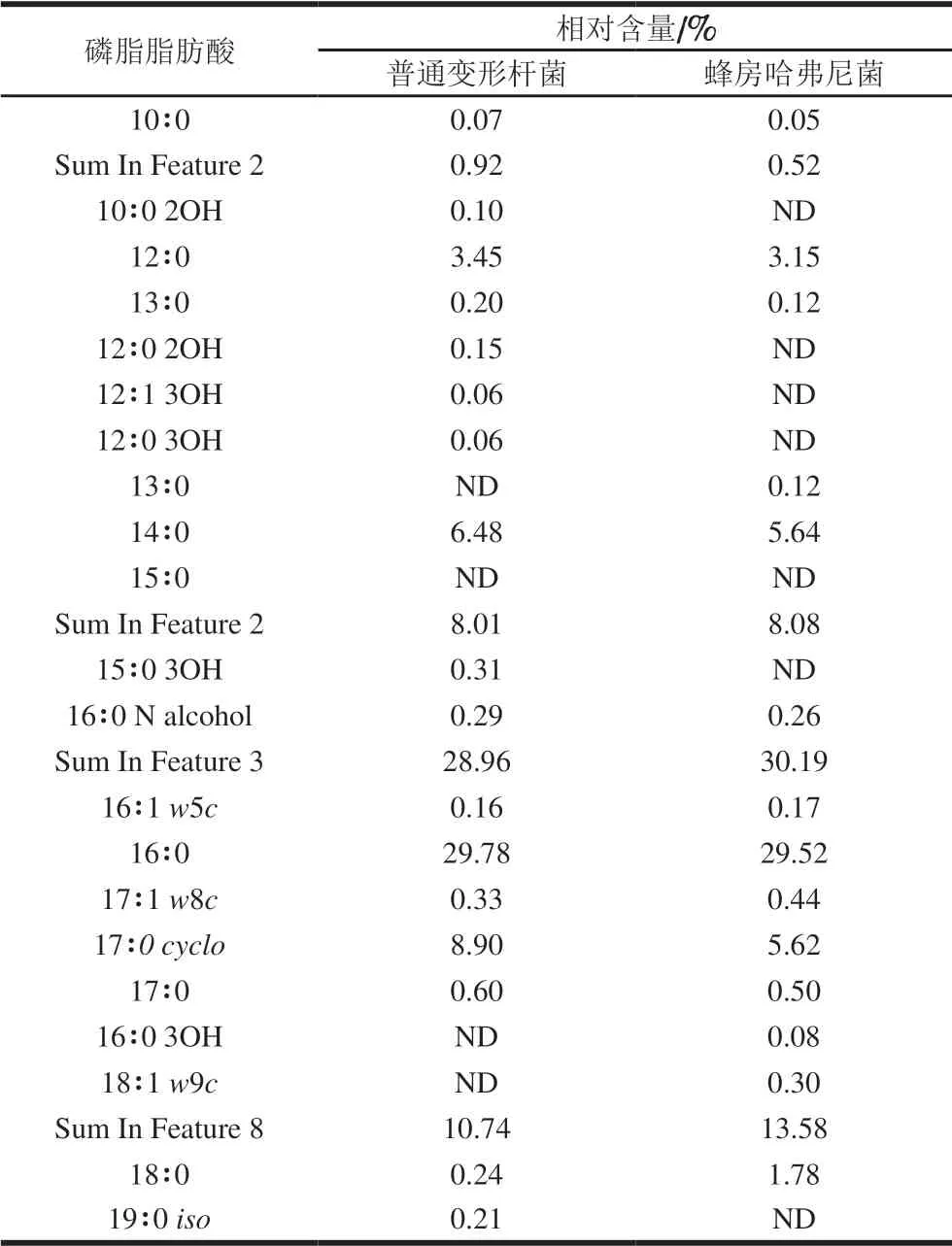
表 3 普通变形杆菌与蜂房哈弗尼菌磷脂脂肪酸组成Table 3 PLFA compositions of Proteus vulgaris and Hafnia alvei
磷脂脂肪酸是生物体的基本构成成分之一,在细胞中绝大部分脂肪酸以结合形式存在,构成生物膜的重要成分,与细胞识别和种族特异性密切相关,具有结构多样性和高生物学特异性[21],例如郭全友等[22]对大黄鱼腐败菌进行磷脂脂肪酸分析,将16∶0、16∶1ω6c和16∶1ω7c作为大黄鱼腐败细菌的生物标记物。由表3可知,普通变形杆菌含有21 种磷脂脂肪酸成分,主要包括16∶0(29.78%)、Sum In Feature 3(28.96%)、Sum In Feature 8(10.74%)、Sum In Feature 2(8.93%)、17∶0 cyclo(8.90%)、14∶0(6.48%)和12∶0(3.45%)。蜂房哈弗尼菌含有18 种磷脂脂肪酸成分,主要包括Sum In Feature 3(30.19%)、16∶0(29.52%)、Sum In Feature 8(13.58%)、Sum In Feature 2(8.08%)、14∶0(5.64%)、17∶0cyclo(5.62%)、12∶0(3.15%)。可见,两株菌的优势磷脂脂肪酸成分较为相似,均为16:0和Sum In Feature 3。
2.3 腐败能力分析结果
2.3.1 冷藏过程中接种鱼块感官评分变化

图 1 冷藏过程中接种鱼块感官评分变化Fig. 1 Sensory quality changes of fish pieces isolated with different bacteria during storage
由图1可知,初始贮藏时,接种鱼块具有轻腌大黄鱼的咸香和清香、质地紧实、富有弹性;冷藏2 d内,感官良好,之后随着菌数总数增加和代谢加快,蛋白质、氨基酸等物质降解,鱼肉产生腐败异味,鱼肉表面出现黑色斑点、肉质松散、色泽暗淡发灰、有汁液流出,感官品质急剧下降。接种普通变形杆菌和蜂房哈弗尼菌的鱼块分别在贮藏的第12天和14天,感官评分达到5 分,分别达到贮藏终点,此时鱼块肉质松软、具有强烈异臭和腐败气味,表明普通变形杆菌腐败速率快于蜂房哈弗尼菌。
2.3.2 菌株生长动力学比较结果
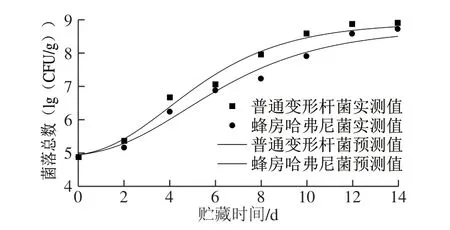
图 2 冷藏过程中接种鱼块菌落总数生长曲线Fig. 2 Change in total bacterial count of fish fillets inoculated with different bacteria during storage
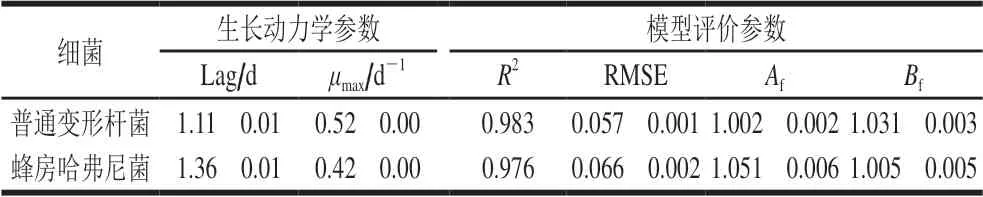
表 4 鱼块冷藏过程中细菌生长动力学参数及模型评价Table 4 Kinetic parameters and model evaluation of spoilage bacterial growth during storage
图2和表4分别为5 ℃贮藏过程中接种鱼块菌落总数生长曲线和生长动力学参数。普通变形杆菌和蜂房哈弗尼菌生长曲线整体呈典型“S”形持续上升趋势,模型评价中R2均大于0.975,Af在1.000~1.060之间,Bf皆在1.000~1.080之间,RMSE在0.000~0.100之间,表明模型拟合度良好。
普通变形杆菌和蜂房哈弗尼菌的延滞期分别为(1.11f 0.01)d和(1.36f 0.01)d,表明1~2 d内菌株生长缓慢,µmax分别为(0.52f 0.00)d-1和(0.42f 0.00)d-1, 表明普通变形杆菌生长快于蜂房哈弗尼菌。至稳定期时,普通变形杆菌Nmax为(8.90f 0.73)(lg(CFU/g)), 蜂房哈弗尼菌Nmax为(8.70f 0.92)(lg(CFU/g)),两者差异不明显。轻腌大黄鱼货架期终点分离出的优势腐败菌中,普通变形杆菌(58.9%)比例要高于蜂房哈弗尼菌(35.9%)[9],同时生长速率亦大于蜂房哈弗尼菌,可能是由于两株菌共存时,两者间会存在相互作用,但对两者之间具体的拮抗或促进作用仍需深入研究。
2.3.3 冷藏过程中接种鱼块pH值变化
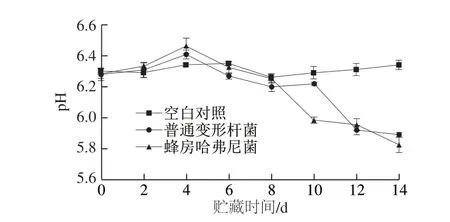
图 3 冷藏过程中接种鱼块pH值变化Fig. 3 Change in pH of fish pieces inoculated with different bacteria during storage
由图3可知,接种普通变形杆菌和蜂房哈弗尼菌的鱼块在贮藏过程中pH值呈先升后降趋势,鱼块初始pH值为6.35f 0.03,接种普通变形杆菌和蜂房哈弗尼菌的鱼块pH值在第4天达到最高,分别为6.41f 0.01和6.46f 0.04,这可能是由于腐败菌生长引起了蛋白质的分解以及碱性物质的生成[23],随后逐渐下降,腐败终点时,pH值分别为5.89f 0.05和5.82f 0.03,可能是随着贮藏时间延长,两种菌数量急剧上升,且由前面两种菌对糖类碳源的利用结果可知,普通变形杆菌和蜂房哈弗尼菌都能利用葡萄糖和甘露糖等发酵产酸,从而引起pH值下降,与其他关于腌制水产品贮藏过程中观察到的趋势[24-25]相一致。
2.3.4 冷藏过程中接种鱼块TVB-N含量和产量因子
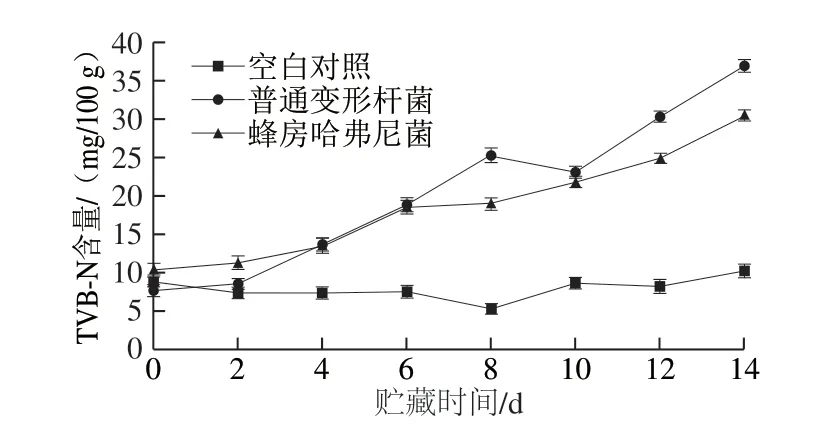
图 4 冷藏过程中接种鱼块TVB-N含量变化Fig. 4 Change in TVB-N content of fish pieces inoculated with different bacteria during storage
TVB-N的产生是由于蛋白质的腐败降解形成盐基氮积聚在制品中,是鱼体腐败变质的重要特征产物,其含量变化与水产品腐败程度明显相关[26]。通常TVB-N含量达到30.00 mg/100 g时即为水产品货架期终点。 由图4可知,冷藏过程中,未接种鱼块的TVB-N含量几乎未发生变化,维持在5.50~10.30 mg/100 g之间。接种普通变形杆菌和蜂房哈弗尼菌的鱼块初始TVB-N含量分别为(7.70f 0.65)mg/100 g和(10.50f 0.78)mg/100 g, 冷藏前2 d 变化不大,之后随着菌落总数的增加,T V B-N 含量迅速增加,在腐败终点分别达到 (30.38f 0.89)mg/100 g(12 d)和(30.52f 0.93)mg/100 g (14 d),接种普通变形杆菌的鱼块TVB-N含量增长快于蜂房哈弗尼菌,可能由于蜂房哈弗尼菌在数量较多时才开始产生腐败代谢产物[27]。
水产品TVB-N含量与菌落总数、感官评分有良好的相关性[28],能很好地反映其腐败程度,常用产量因子YTVB-N/CFU作为腐败菌致腐能力评价指标。贮藏终点时,普通变形杆菌组的YTVB-N/CFU为3.61h 10-8mg/CFU,蜂房哈弗尼菌组的YTVB-N/CFU为3.71h 10-8mg/CFU,两者差异不大。李学英等[29]将腐败希瓦氏菌和假单胞菌接种于无菌大黄鱼鱼块中,在5 ℃贮藏终点时,接种这两株菌的鱼块YTVB-N/CFU分别为1.38h 10-10mg/CFU和 1.18h 10-10mg/CFU,确定腐败希瓦氏菌为大黄鱼低温贮藏中的SSO,由此可知本实验中两株菌的腐败能力相同,均为轻腌大黄鱼的SSO。
2.3.5 冷藏过程中接种鱼块生物胺含量变化
水产品中腐败微生物能够使游离氨基酸发生脱羧作用,产生大量具有生物活性的生物胺,因此生物胺含量与水产品品质密切相关[30]。腐胺和尸胺是腌制水产品中的常见生物胺,也是腐败鱼肉的优势生物胺[31],其含量常作为确定鱼类安全性和质量的指标[32]。虽然与组胺相比,腐胺和尸胺没有明显的毒副作用,但是它们能够与食品中的亚硝酸盐反应生成致癌物亚硝基胺[33],且当其与组胺同时存在时能够增强组胺的毒性[34],因此对水产品腐胺、尸胺和组胺等生物胺的监控非常重要。
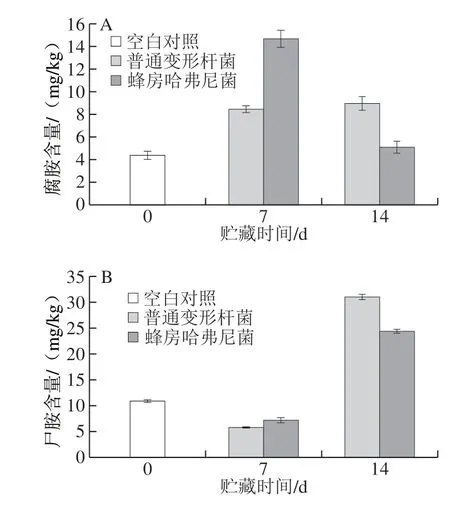
图 5 冷藏过程中接种鱼块腐胺(A)和尸胺(B)含量变化Fig. 5 Changes in putrescine (A) and cadaverine (B) contents in fish pieces during storage
由图5可知,初始、冷藏过程和终点均检出腐胺和尸胺。由图5A可知,接种普通变形杆菌的鱼块,第7天腐胺含量增长到(8.47f 1.33)mg/kg,与第14天含量差异不明显;而接种蜂房哈弗尼菌的鱼块,呈先升后降趋势,第7天增至(14.70f 4.95)mg/kg,第14天时仅为(5.08f 0.53)mg/kg。由图5B可知,接种普通变形杆菌和蜂房哈弗尼菌鱼块,尸胺含量均呈现先降后升趋势,第14天时,前者约后者的1.28 倍。第14天时,接种普通变形杆菌的鱼块腐胺和尸胺含量均高于接种蜂房哈弗尼菌鱼块,其中腐胺含量与空白对照组相比略有上升,但尸胺含量则分别升至(31.00f 5.94)mg/kg和(24.3f 1.71)mg/kg,说明尸胺为主要生物胺成分,对轻腌大黄鱼的腐败贡献更大。冯杰等[35]研究得出腐胺和尸胺为4 ℃和25 ℃贮藏大黄鱼的主要生物胺成分,其他生物胺含量在贮藏中变化不大,与本研究结果相似,同时有研究显示这两株菌具有较强的产尸胺能力[36]。
2.3.6 冷藏过程中接种鱼块挥发性物质分析结果
挥发性物质多由醇、醛、酮类等挥发性物质构成,能影响鱼肉的气味,其含量是影响消费者评价食品品质的重要指标之一。接种不同菌株的鱼块在初始和近腐败终点(第14天)的挥发性物质相对含量和种类见表5。 共检出18 种挥发性物质,包括醇类(7 种)、醛类(6 种)、酮类(1 种)、酯类(1 种)、其他(烷烃和烯烃等,共3 种),其中醇类物质是主要的挥发性成分。鱼肉在内源酶、脂肪氧化以及微生物的作用下产生挥发性物质,受产品类型、自身性质和外界条件等影响产生自身特征性挥发性物质[37]。初始时,空白对照组鱼块中相对含量最高的是醇类(63.03%),其次是醛类、烷烃和酮类,而翁丽萍[38]对养殖和野生大黄鱼的风味物质比较分析中得出风味物质均以醛类为主,此差异可能是原料、腌制、加工和贮藏条件等差异造成的。腐败终点与初试的空白鱼块相比,接种了普通变形杆菌和蜂房哈弗尼菌的鱼块的醇类物质相对含量增加,分别为78.84%和81.34%,醛类物质与空白对照组相比有所下降,接种两种菌的鱼块挥发性物质成分比例差异不明显,说明两者代谢产物代谢能力相似。
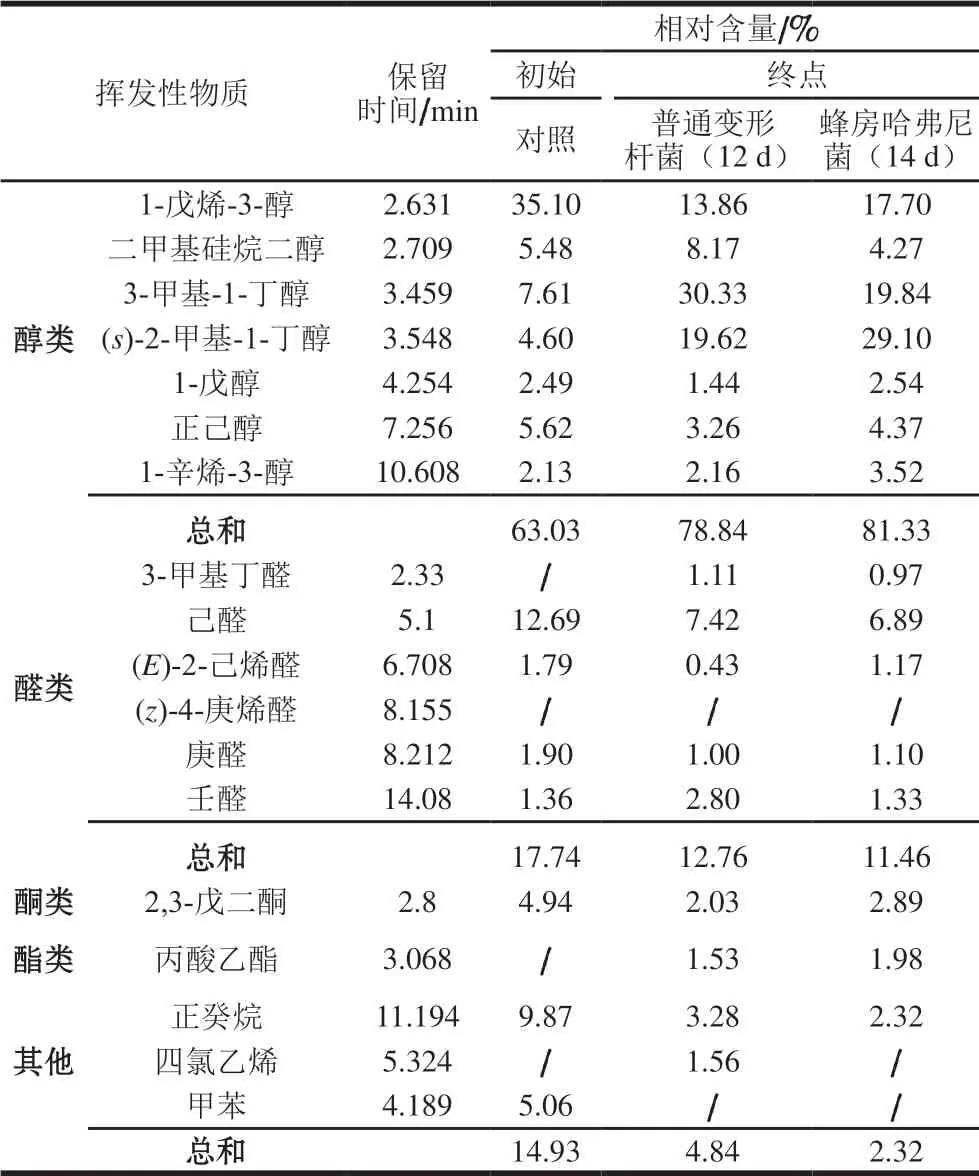
表 5 冷藏过程中接种不同菌株鱼块挥发性物质及其相对含量Table 5 Changes in types and contents of volatile compounds in fish pieces inoculated with different bacteria during storage
由表5可知,腐败终点时,两组鱼块醇类物质种类与对照组相同,接种两株菌的鱼块之间醇类物质相对含量差异不大。3-甲基-1-丁醇是重要的醇类物质,其在接种普通变形杆菌和蜂房哈弗尼菌的鱼块中的相对含量分别为30.33%和19.84%,主要源于亮氨酸和异亮氨酸的氧化分解,具有坚果的气味;1-戊烯-3-醇是盐腌鱼有效的风味物质,与鱼腥味的产生有关[39];1-辛烯-3-醇来自不饱和脂肪酸氧化,是淡水鱼和海水鱼中普遍存在的挥发性气味成分[40]。醇类物质多来源于脂肪氧化分解及醛类物质的还原,其阈值较高,对食品风味贡献较大。醛类物质的阈值较低,且能够与其他许多物质产生重叠风味效应,对食品的风味影响较大[41]。到腐败终点时,接种普通变形杆菌和蜂房哈弗尼菌的鱼块,均能检测到己醛、壬醛、庚醛、3-甲基丁醛和(E)-2-己烯醛,己醛已被证明是鱼腥味的主要物质[42],壬醛则具有较强的类似柑橘或油脂的气味,庚醛具有鱼腥味、脂肪味和刺激性气味,接种两种菌鱼块的醛类物质相对含量基本相同。
腐败期终点还检测到酮类、酯类和烷烃类,酮类由多不饱和脂肪酸的热降解、氨基酸降解或微生物氧化产生[41],可与醛类物质相互作用,增强鱼肉的腥味[43]。酯类化合物一般由酸和醇酯化作用缩合而成,是肉类香味的重要来源。烃类物质来源于脂肪酸烷氧自由基的自氧化,阈值较高,对鱼肉气味贡献较小。
3 结 论
以源自冷藏轻腌大黄鱼的普通变形杆菌和蜂房哈弗尼菌为对象,分析两种菌的表型、生理生化、碳源代谢和细胞磷脂脂肪酸等特征,并将两种菌分别接回到无菌鱼块中,测定接种鱼块冷藏(5 ℃)过程中感官、微生物和理化(pH值、TVB-N含量、生物胺含量和挥发性成分)等指标,评价和比较两种菌的腐败能力。两种菌在低盐(NaCl质量分数不高于4%)和pH 5~7条件下均能生长。
接种普通变形杆菌和蜂房哈弗尼菌的鱼块在冷藏过程中分别在第12、14天到达腐败终点,此时TVB-N含量均超过30 mg/100 g;YTVB-N/CFU分别为3.61h 10-8、3.71h 10-8mg/CFU;接种鱼块中共检测到尸胺和腐胺两种生物胺,其中尸胺是导致腐败的主要生物胺成分;贮藏初期初始鱼块挥发性物质主要成分为醇类,腐败终点时接种两种菌的鱼块挥发性成分主要为醇类和醛类,且其相对含量无明显差异。

