烟熏时间对培根杂环胺含量及产品品质的影响
杜洪振,张 品,田兴垒,张 浪,刘 骞,孔保华,
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.岛津企业管理(中国)有限公司,辽宁 沈阳 110016)
培根是世界上消费量最大的猪肉产品之一,因具有良好的烟熏风味和诱人的色泽而深受消费者喜爱。烟熏过程是培根加工中最重要的阶段之一。烟熏不但赋予培根良好的烟熏风味及色泽,还能够降低水分活度以及增大盐浓度[1],从而确保其生物安全性[2]。传统烟熏是一定温度下通过木屑燃烧发烟对食品进行加工,其中烟熏过程中所产生的酚类物质决定了产品的风味,而羰基类物质则决定了产品的色泽[3]。
烟熏肉制品在加工时无论是采用传统烟熏还是液熏法均需要经过一定时间的热处理,从而达到赋予产品烟熏风味的目的,而热处理会在一定程度上引起肉制品脂质和蛋白质氧化。肌肉蛋白由于受到活性氧自由基(reactive oxygen species,ROS)的攻击会发生一定程度的氧化,使其天然结构和完整性发生变化,这些变化会影响肉的品质及功能性,包括肉的质构、颜色、风味、保水性等[4-5]。据报道,热处理不仅可以促进脂质的氧化,还可以加速蛋白质中的氧化过程,因为它们对自由基的产生有促进的作用,并且还能够抑制食品的抗氧化作用[6]。唐静等[7]报道称烟熏加工温度会影响美拉德反应速率和提高脂酶、蛋白质水解酶等的活力,从而促进产品风味物质的形成。Santé-Lhoutellier等[6]报道称热处理促进自由基的产生从而加速脂质和蛋白质氧化。烟熏时熏烟成分中许多有机化合物附着在肉制品上,赋予肉制品特有的烟熏香味,如酚类和烯烃类物质[7]。 而肉制品经过烟熏也会产生致癌化合物如多环芳烃(polycyclic aromatic hydrocarbons,PAH)[8]和杂环芳香胺(heterocyclic aromatic amines,HAAs)[9]等。其中烟熏肉制品中PAH含量已经有大量的研究,而关于烟熏肉制品中HAAs的研究却鲜有报道。根据HAAs化学结构式,可将HAAs分为两类——氨基咪唑和氨基咔啉,其中氨基咪唑类HAAs一般形成于100~300 ℃之间,而氨基咔啉一般形成于300 ℃以上。Hou Chengli等[9]研究表明烟熏不同品种绵羊肉其HAAs的含量不同,但没有确定数量级的差异。Yang Diaodiao等[10]发现烟熏时烟气中的某些成分能够在香肠生产过程中诱导产生HAAs。
本实验在培根制备过程中采用不同的熏烟时间,通过测定羰基含量、硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)值、水分含量、水分活度、水分分布、pH值以及HAAs的含量,研究不同时间烟熏处理对培根品质及杂环胺含量的影响,为开发高品质且较低杂环胺含量的培根提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜猪肋腹肉购于哈尔滨市好又多超市。
食盐(食品级) 中盐集团;亚硝酸钠(食品级) 哈尔滨亿人食品添加剂公司;2-氨基-1-甲基-6-苯基咪唑并[4,5-b]-吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]- pyridine,PhIP)、2-氨基-3-甲基-咪唑并[4,5-f]-喹啉(2-amino-3-methyl-imidazo[4,5-f]-quinoline,IQ)、 2-氨基-3-甲基-咪唑并[4,5-f]-喹喔啉(2-amino-3-methylimidazo[4,5-f]-quinoxaline,IQx)、2-氨基-3,4-二甲基-咪 唑并[4,5-f]-喹啉(2-amino-3,4-dimethyl-imidazo[4,5-f]- quinoline,MeIQ)、2-氨基-3,4,8-三甲基-咪唑并[4,5-f]- 喹喔啉(2-amino-3,4,8-trimethyl-imidazo[4,5-f]-quinoxaline,4,8-DiMeIQx)、2-氨基-3,7,8-三甲基-咪唑并[4,5-f]-喹喔啉(2-amino-3,7,8-trimethyl-imidazo[4,5-f]-quinoxaline,7,8-DiMeIQx)、2-氨基-9H-吡啶并[2,3-b] 吲哚(2-amino-9H-pyrido[2,3-b]indole,AαC)、2-氨基-3-甲基-9H-吡啶并[2,3-b]吲哚(2-amino-3-methyl-9H-pyrido[2,3-b]indole,MeAαC)、1-甲基-9H-吡啶并[3,4-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole,Harman)、9H-吡啶并[3,4-b]吲哚(9H-pyrido[3,4-b]indole,Norharman)、2-氨基-5-苯基吡啶(2-amino-5-phenylpyridine,Phe-P-I)及内标工作液2-氨基-3,4,7,8-四 甲基-咪唑并[4,5-f]-喹喔啉(2-a m i n o-3,4,7,8-tetramethylimidazo[4,5-f]-quinoxaline,TriMeIQx) 加拿大多伦多化学研究所;乙醇、二氯甲烷、正己烷、甲醇、乙腈(均为色谱纯) 美国Fisher Scientific公司;Oasis MCX固相萃取小柱(3 cm3/60 mg) 美国Waters公司;乙酸铵 美国Sigma公司;三氯乙酸、磷酸氢二钠、磷酸二氢钠、盐酸、丙酮、乙酸乙酯、乙醇、氯仿、硫代巴比妥酸(均为化学分析纯) 国药集团化学试剂沈阳有限公司。
1.2 仪器与设备
烟熏炉 嘉兴市瑞邦机械工程有限公司;培根模具 嘉兴艾博实业有限公司;ZE6000色差计 日本色电工业株式会社;GL-21M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;TU-1800紫外-可见光分光光度计 北京普析通用仪器有限公司;AQUALAB Pre台式水活度仪 美国Decagon Devices公司;mq-20低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)分析仪 德国布鲁克公司;722-2000分光光度计 山东高密彩虹仪器有限公司;LC-30A超高效液相色谱仪与LCMS-8050三重四极杆质谱仪联用系统 日本岛津公司;Milli Q超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 培根制作
工艺流程:肋腹肉→清洗1~2 次→修整(长25 cm、宽15 cm、高2 cm)→盐水注射(盐水包含质量分数9%食盐和质量分数0.05%亚硝酸钠,注射量为肉质量的10%)→ 腌制18~20 h(4 ℃)→沥干水分→装入培根模具→放入烟熏箱→烘干(温度45~50 ℃、时间30 min)→ 烟熏(温度45~50 ℃,时间0、0.5、1.0、1.5、2.0、2.5、3.0 h)→4 ℃冷却3~5 h→-18 ℃冷冻8~10 h→切片(1.5 mm)→真空包装→存放(-40 ℃)
1.3.2 实验取样
每组实验均取5 片培根(大约100~120 g),切碎混匀后按照实验要求称取样品,其中色差测定取培根表层瘦肉部分。
1.3.3 杂环芳香胺的提取及净化
提取:培根中HAAs的提取方法参照GB 5009.243ü 2016 《高温烹调食品中杂环胺类物质的测定》[11]的方法并稍作修改。称取试样2.00 g(精确到0.01 g)于50 mL离心管中,加入200 μL内标工作液(200 μg/L),再加入9.8 mL 40 g/L氢氧化钠-甲醇混合溶液(7∶3,V/V), 均质1 min。均质器刀头分别用5.0 mL 40 g/L氢氧化钠-甲醇混合溶液(7∶3,V/V)各洗涤2 次,洗涤液合并至样品提取离心管中。试样在10 750hg条件下离心10 min,待净化。
净化:固相萃取柱(Oasis MCX)预先依次用2 mL甲醇、3 mL 4 g/L氢氧化钠溶液活化。量取10 mL提取液加入固相萃取柱中,弃去流出液后,依次用3 mL质量浓度为4 g/L氢氧化钠-甲醇混合溶液(45∶55,V/V)、2 mL正己烷洗淋,每次淋洗完后都需要将柱体内淋洗溶液抽干,最后用1.5 mL乙醇-二氯甲烷溶液(1∶9,V/V)洗脱,洗脱流速小于1 mL/min。洗脱液于30 ℃下氮气浓缩至近干后,加入1.0 mL乙酸缓冲液-乙腈混合溶液(1∶1,V/V),漩涡混匀,微孔滤膜(0.2 μm,有机系)过滤至进样小瓶,待上机分析测定。
1.3.4 杂环芳香胺含量的测定
采用超高效液相色谱-电喷雾-串联三重四极杆质谱测定样品中HAAs的含量[11]。液相色谱条件为色谱柱Shim-pack XR-ODS III(150 mmh 2.0 mm,2.2 μm),柱温40 ℃,色谱流动相为乙睛(A相)、10 mmol/L乙酸铵(B相),流速为0.3 mL/min,单次进样体积为2.0 μL,洗脱方式为梯度洗脱,B相初始比例为10%,洗脱程序如 表1所示。

表 1 梯度洗脱程序Table 1 Gradient elution program
采用LCMS-8050三重四极杆质谱仪进行质谱分析,离子源ESI+,雾化气流速3.0 L/min,加热气流量10.0 L/min, 干燥气流速10.0 L/min,接口温度300 ℃,DL管温度250 ℃,加热块温度400 ℃,毛细管电压4.0 kV,离子源温度90 ℃,脱溶剂气温度350 ℃,脱溶剂气流量 800 L/h,扫描模式多反应监测。
1.3.5 颜色测定
通过ZE-6000色差计测定解冻后肌肉的颜色。根据Park[12]的描述,仪器参数使用D65光源和一个10°观测器,测量区域为直径为8 mm的圆形范围;光照区域为直径50 mm的圆形范围。标准白板(L*=95.26,a*=-0.89,b*=1.18)用于仪器校准,校准完毕后,将肉样平铺满圆形比色杯进行测量,并记录样品的亮度(L*值)、红度(a*值)和黄度(b*值)。
1.3.6 水分含量和水分活度
水分含量采用直接干燥法,参照GB 5009.3—2010《食品安全国家标准 食品中水分的测定》[13],用智能型水分活度仪测定水分活度。
1.3.7 LF-NMR测定水分的动态分布(T2的测定)
LF-NMR弛豫时间根据Zhang Mingcheng等[14]的方法进行测定。mq-20低频核磁共振分析仪器的磁场强度为0.47 T,对应的质子共振频率为20 MHz,当培根肉解冻达到4 ℃后,将装有肉条(1 cmh 1 cmh 2 cm)的核磁管(直径18 mm)放入仪器中进行测量,横向弛豫时间(T2)使用Carr-Purcell-Meiboom-Gill脉冲序列测量。对每一个样本,在2 s的时间间隔内得到16 次扫描,总共有3 000 次回波。不同培根样品中的水分分布相关的连续分布指数通过CONTIN算法对Carr-Purcell-Meiboom-Gill 得到的原始数据进行归一。并记录样品的T2弛豫时 间变化。
1.3.8 pH值的测定
pH值的测定方法参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[15]。将10 g解冻后的培根放入100 mL 0.1 mol/L KCl(室温)溶液中进行破碎、均质,然后插入校正完毕的pH计电极,读取pH值读数,即为培根的pH值。
1.3.9 TBARS值的测定
TBARS值的测定参考Wang等[16]的方法,并作适当的修改。将2.0 g左右的样品放入试管中,加入3 mL的硫代巴比妥酸溶液,17 mL的三氯乙酸-盐酸溶液,将其混合摇匀后,沸水浴加热30 min,冷却后取4 mL溶液加入4 mL氯仿混匀,然后以3 000 r/min离心10 min,取上清液在532 nm波长处测定吸光度。TBARS值以每千克氧化后的油脂样品溶液中含有的丙二醛质量计,根据式(1)计算。
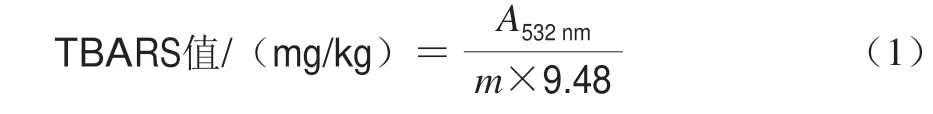
其中:A532nm为溶液的吸光度;m为样品的质量/g;9.48为常数。
1.3.10 羰基含量的测定
参照Fagan等[17]的方法。取3.0 g肉样与15 mL磷酸盐缓冲液(20 mmol/L、pH 7.4)均质,过滤后取0.5 mL滤液,加0.5 mL 10%三氯乙酸离心(3 338hg、5~8 min),弃上清液后再用0.5 mL盐酸-丙酮溶液(3∶100,V/V)洗涤沉淀2 次。随后在每管中加入1 mL 10 mmol/L DNPH,空白加1 mL 2 mol/L HCl溶液,室温下放置1 h(每15 min漩涡振荡一次),添加1 mL 20%三氯乙酸,11 127hg离心5 min,弃上清液,用1 mL乙酸乙酯-乙醇(1∶1,V/V)洗沉淀3 次,除去没有反应的试剂。而后用3 mL 6 mol/L盐酸呱溶解沉淀并在37 ℃条件下放置15 min,10 748hg离心3 min,除去不溶物质,上清液在370 nm波长处测吸光度。羰基含量按 式(2)计算。

式中:A370nm为溶液的吸光度;ε为吸光系数, 22 000 L/(molg cm);ρ为蛋白质量浓度/(g/L)。
1.4 数据统计分析
所得数据均为3 次重复的平均值,结果表示为平均值±标准差。采用Statistix 8.1软件包中Linear Models程序进行数据统计分析,平均值之间显著性差异(P<0.05)分析使用Tukey HSD程序,采用SigmaPlot 12.5软件作图。
2 结果与分析
2.1 烟熏时间对培根肉HAAs含量的影响
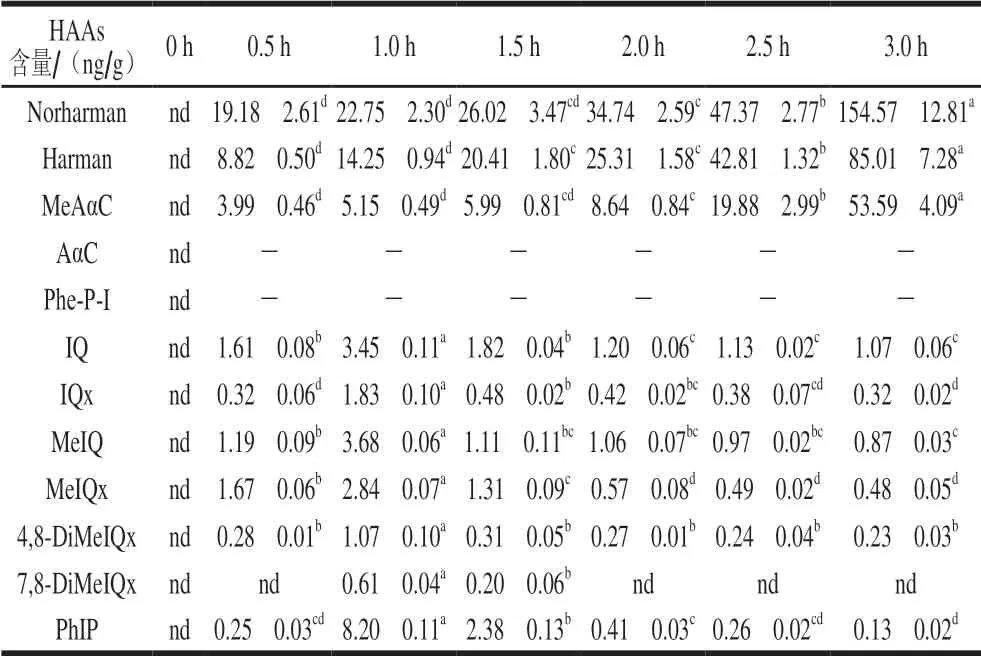
表 2 烟熏时间对培根中HAAs含量的影响Table 2 Effects of smoking time on HAAs content in bacon
从表2中可知,培根在干燥后即烟熏0 h并未检测到HAAs。这说明肉制品在短时间低温干燥过程(45~50 ℃、30 min)中无法形成HAAs。随着烟熏时间的延长,培根中非极性HAAs中的Norharman含量从19.18 ng/g增加到154.57 ng/g,Harman含量从8.82 ng/g 增加到85.01 ng/g,MeAαC含量从3.99 ng/g增加到53.59 ng/g。而无论烟熏多长时间,培根中均未检测到AαC和Phe-P-I。这可能是因为随着烟熏时间的延长,培根中的脂肪不断外渗到肉的表面,而木屑燃烧产生的Norharman、Harman及MeAαC等非极性HAAs[18]更易与非极性的油脂亲和,从而吸附到培根上。而产品的脂肪含量影响致突变物质的形成,但尚不清楚是由于物理还是化学作用的影响[19]。Persson等[20]研究发现当脂肪含量超过一定的比例以后,会降低HAAs含量。另一方面烟熏过程中脂肪氧化产生的醛类及蛋白氧化产生的羰基类化合物不断增加,这些物质作为前体物质促进了HAAs的形成。这一点可从2.6节中丙二醛及羰基含量的增多得到验证。Randel等[21]向菜籽油中加入脂肪氧化产物己醛,加热30 min后发现,与对照组相比Norharman和Harman含量均升高。而Hou Chengli等[9]认为在烟熏时羊肉中游离的色氨酸作为前体物质促进了非极性HAAs的形成而非木屑燃烧。此外Yang Diaodiao等[10]研究也发现烟熏香肠中Norharman及Harman的含量最高,且主要以和蛋白结合的形式存在于肉制品中。而Yang Diaodiao等[10]认为熏烟中存在的醛类作为前体物质促进了非极性HAAs的形成。同样,Pfau等[22]也发现Norharman和Harman之间具有同步性,即二者含量均增加或均减少。
从表2中可知,随着烟熏时间延长,IQ、IQx、MeIQ、MeIQx、4,8-DiMeIQx、7,8-DiMeIQx及PhIP等极性HAAs的含量先增大后减小,且均在1 h时达到最大值。这可能是因为烟熏前期肉制品中含有很多水分,极性HAAs与水更易亲和,随着烟熏时间的延长,水分不断蒸发导致与水亲和作用较强的极性HAAs随汁液的流失而减少;另一方面,虽然熏烟中某些成分可能参与HAAs的形成[19],但也可能存在某些成分协同脂肪氧化产生的某些醛类物质与极性HAAs反应生成其他物质[21],从而降低了极性HAAs的含量。Randel等[21]向菜籽油中加入脂肪氧化产物己醛,130 ℃加热30 min后发现,与对照组相比IQx、MeIQx及4,8-DiMeIQx的含量分别降低了50.08%、42.50%、46.86%。Kondjoyan等[23-24]研究表明较低的水分活度能够显著降低IQx、MeIQx及4,8-DiMeIQx的含量。Gibis等[25]研究发现培根中MeIQx的含量随着加工时间的延长而增大。对此作者认为质量损失和水分活度的降低造成了MeIQx含量的增加。从2.3节可知,随着烟熏时间延长,培根的水分含量和水分活度不断降低,而MeIQx的含量却不断减少。这也进一步说明MeIQx等极性HAAs与水分子间具有较强的亲和力,随着烟熏时间延长,极性HAAs随样品汁液流失而不断降低。
2.2 烟熏时间对培根颜色的影响
烟熏肉制品的颜色是反映食品感官品质的一个重要参数,直接决定了消费者的购买欲望。从表3可以看出,在烟熏时间1.5 h以内,随着烟熏时间的延长,L*值显著降低(P<0.05),这可能是由于随着烟熏时间的延长肉中的水分不断蒸发,从而导致L*值降低。此外熏烟中的某些成分附着在肉制品表面,也是造成L*值降低的原因。赵冰等[26]采用苹果木在50 ℃条件下烟熏牛肉香肠,烟熏时间分别为20、25、30、35 min或40 min,结果发现随着烟熏时间的延长L*值显著降低。当1.5 h以后,随着烟熏时间的持续增加,L*值显著增大(P<0.05),这是因为肌肉蛋白质变性导致肉中游离水含量的增加[27],从而造成解冻肉的光反射增强。这一点也可以从2.4节自由水强度增大中得到证实;另一方面,烟熏后期培根表面有油脂渗出也会导致L*值增大。

表 3 烟熏时间对培根颜色的影响Table 3 Effects of smoking time on L*, a* and b* values of bacon
从表3中可以看出,随着烟熏时间的延长,a*值和b*值均先增大后减小,在1.5 h时分别达到最大值16.06和14.15。烟熏前期a*值增大,可能是由于随着肉中水分的蒸发,色素物质不断积累造成[28];当烟熏时间不断延长,肉中蛋白氧化导致羰基含量增多,而羰基等化合物是发生焦糖化和美拉德反应的重要底物[29],导致烟熏后期培根表面颜色变红褐色,从而降低了产品a*值。这可以从2.7节中羰基含量增多得到证实。而Xia Xiufang等[30]认为a*值的降低是由肌红蛋白氧化生成高铁肌红蛋白造成的。b*值增大可能是烟熏前期,随着肉温的升高一氧化氮血色原成色的速率加快,从而导致肉色黄度加深。此外脂肪氧化也可能造成b*值升高。而随着烟熏时间的延长,羰氨反应生成的褐色沉淀不断积累导致b*值降低。此外烟熏后期脂肪渗出也会对b*值产生影响。赵冰等[26]对烟熏牛肉香肠的研究中也得到了类似的结果。
2.3 烟熏时间对水分含量及水分活度的影响
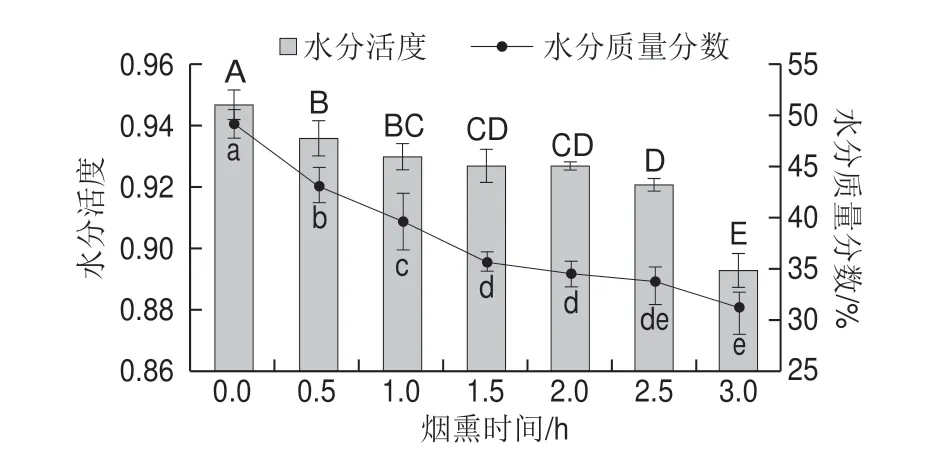
图 1 烟熏时间对培根中水分含量及水分活度的影响Fig. 1 Effect of smoking time on water content and water activity of bacon
水分含量对于食品形成良好风味、口感以及食品的储藏期起着重要作用。烟熏过程中培根水分质量分数及水分活度的变化如图1所示,在1.5 h以前,随着烟熏时间的延长,培根中的水分质量分数急剧降低(P<0.05),而在1.5 h以后开始缓慢降低。这可能是因为烟熏前期肉中自由水含量较高从而导致水分蒸发较快;随着烟熏时间的延长,自由水含量降低且在肉的表面形成硬壳阻碍了水分快速挥发。Martinez等[31]报道称烟熏可以降低食品水分活度进而延长食品货架期。
水分活度是指食品中水的蒸气压与同温下纯水的饱和蒸气压的比值[32]。由图1所示,随着烟熏时间从0.5 h延长到3.0 h,培根的水分活度显著降低(P<0.05)。这可能是随着烟熏时间的延长,培根表面游离水先蒸发掉,然后其组织内部的游离水继续蒸发,到后期肉品中游离水几乎全部蒸发掉,结合水与不易流动水占主导地位,所以后期水分活度变化较小。这可以从2.4节中水分分布得到证实。而在整个培根加工过程中,肉品的水分活度均低于0.95,远低于鲜肉的水分活度。研究表明,多数细菌生长繁殖所需要的最低水分活度高于0.94,最适合生长繁殖的水分活度为0.995以上[32]。
2.4 烟熏时间对水分分布的影响
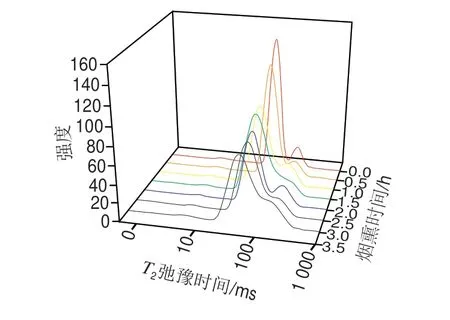
图 2 烟熏时间对培根低场核磁共振T2弛豫时间的影响Fig. 2 Effect of smoking time on T2 relaxation time of bacon
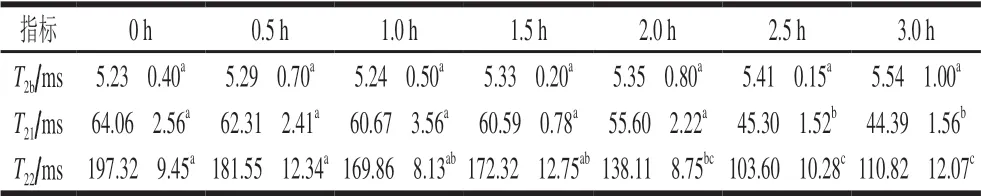
表 4 烟熏时间对培根水分分布的影响Table 4 Effect of smoking time on water distribution of bacon
LF-NMR被用于有效地评价加工肉制品中水分分布变化情况。肉制品中水分常以3 种形式存在,即结合水、不易流动水以及自由水,其在低场核磁中的弛豫时间分别为T2b(1~10 ms)、T21(30~60 ms)、T22(100~400 ms)[33]。烟熏时间对培根水分分布(T2)的影响如图2及表4所示。从表4中可以看出随着烟熏时间的延长,弛豫时间T2b并没有显著变化(P>0.05)。这主要是由于结合水是依靠氢键与蛋白质的极性基(羧基和氨基)相结合形成的水胶体,即使受到机械压力、肌肉结构改变等因素的影响,也很难发生改变。此外结合水的量很少,而且很难受到加热或冷冻处理而发生 变化[34]。Li Miaoyun等[35]研究也发现鸡胸肉在50 ℃干燥过程中弛豫时间T2b无显著性差异。
烟熏过程中弛豫时间T21和T22变化如图2及表4所示。随着烟熏时间的延长,弛豫时间T21和T22逐渐减小 (P<0.05)。这说明随着烟熏时间的延长,水分不断蒸发,T21和T22的自由度逐渐降低。结合水分含量及2.7节中羰基含量分析结果可知,在烟熏过程中,一方面加热导致水分不断蒸发;另一方面导致肌肉蛋白氧化变性,蛋白间形成的凝胶网络结构被破坏导致样品蛋白的持水力减弱。此外,在烟熏时间达到2.5 h以后T21和T22的变化不显著(P>0.05)。这说明在烟熏后期肌肉中水分子自由度与外界环境达到平衡。此外,随着烟熏时间的延长,培根表面的水分子快速蒸发形成致密坚硬的表层,起到了水分传输屏障的作用[36]。这一点也可以从2.3节中水分含量在烟熏后期差异不显著得到验证。姜秀丽等[37]研究不同烘干时间对猪肉脯水分分布影响发现,随着烘干时间的延长T21和T22均有不同程度的降低。
2.5 烟熏时间对培根肉pH值的影响
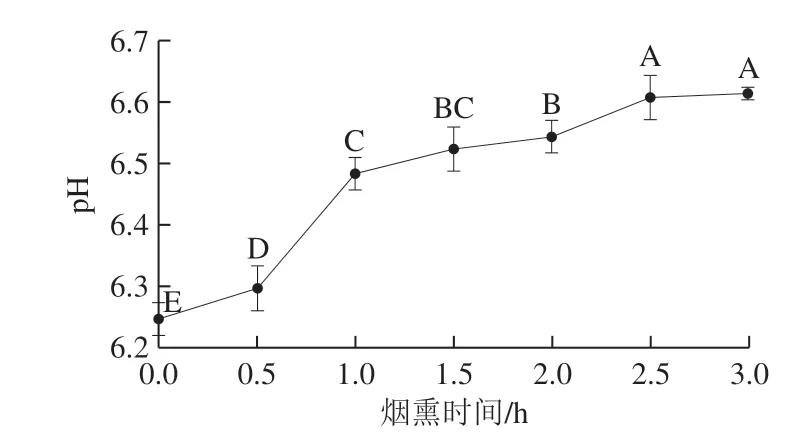
图 3 烟熏时间对培根pH值的影响Fig. 3 Effect of smoking time on pH of bacon
从图3可以看出,随着烟熏时间从0.5 h延长到2.5 h,样品pH值显著增大(P<0.05)。这可能是因为50 ℃是许多酶的最适反应温度,造成脂肪及蛋白质的分解产生胺类及氨类物质[38],从而导致pH值的升高。此外,木屑燃烧产生的胺类物质吸附在肉的表面,也会引起pH值的升高。这一点可从2.1节培根中HAAs含量的升高得到验证。另一方面,在烟熏时间达到2.5 h以后,样品pH值趋于平缓(P>0.05)。这可能是因为在烟熏后期脂肪及蛋白氧化产生的酸类物质不断增多,如羰基类化合物和游离脂肪酸类化合物,使得样品pH值的增加速率减缓。这一点从2.7节中羰基含量的增多得到验证。此外烟熏后期培根中的水分含量及水分分布均趋于平衡,使得培根表面吸附的极性胺类物质含量达到最大。这一点可从 2.1节中极性HAAs含量在烟熏后期趋于平衡得到验证。
2.6 烟熏时间对TBARS值的影响
脂肪次级氧化产物之一为丙二醛,在酸性和高温条件下,丙二醛和硫代巴比妥酸能够发生反应生成红棕色产物。因此TBARS值可以反映脂肪的氧化程度。从图4中可以看出,在烟熏初期(0.5 h)样品TBARS值为0.198 mg/kg,略高于对照组组的TBARS值 (0.158 mg/kg),但差异不显著(P>0.05)。随着烟熏时间的延长,样品TBARS值显著增大(P<0.05),这说明随着烟熏时间延长,丙二醛不断积累从而导致TBARS值增大;另一方面也说明在烟熏初期熏烟成分能够控制脂肪氧化,而随着烟熏时间延长蛋白质发生氧化进一步促进了脂肪氧化。这一点也可以从2.7节中羰基含量增大得到验证。Estévez等[39-40]报道称肉类系统中脂质氧化和蛋白氧化存在一定的相互作用。脂质氧化是降低肉制品品质和可接受性的主要因素。据报道人体可接受的TBARS值的阈值约为1 mg/kg[41],超过该阈值,肉类产品的不良氧化味和风味便可以通过感官预知。本研究测定的TBARS值均低于该阈值,因此产品的风味特性在感官可接受的范围内。

图 4 烟熏时间对培根中羰基含量及TBARS值的影响Fig. 4 Effect of smoking time on protein carbonyl content and TBARS value of bacon
2.7 烟熏时间对羰基含量的影响
羰基化是蛋白质的不可逆、非酶化修饰,涉及氧化应激和其他诱导机制从而形成羰基部分[42],如醛类和酮类[43]。 其中侧链氨基酸直接氧化是蛋白质羰基化的主要途径,也是直接氧化攻击蛋白质最有效和最主要的来源[44]。 从图4中可以看出随着烟熏时间的延长,蛋白羰基含量均显著增大(P<0.05)。这可能是由于随着加热时间的延长,肌肉中的肌原纤维蛋白发生氧化反应形成羰基基团。此外,烟熏后期羰基含量增大可能是由于脂肪氧化产物促进了蛋白进一步氧化形成羰基[45]。 Santé-Lhoutellier等[46]报道,随着加工温度的升高和时间的延长,蛋白羰基含量也随之增大。而关于烟熏成分是否能够增加羰基含量鲜见相关报道。
蛋白质作为肌肉食品的主要成分,在肌肉食品的感官、营养等方面起着决定性作用。其中碱性氨基酸(赖氨酸、组氨酸和精氨酸)特别容易受到烹饪过程中产生的自由基的攻击,从而更容易转化为羰基衍生物[47]。Hou Chengli等[9]研究表明烟熏能够增加羊肉中的自由氨基酸含量。由于蛋白质羰基化的形成涉及赖氨酸、精氨酸和苏氨酸等必需氨基酸的不可逆氧化修饰,因此蛋白质羰基化显著影响食品蛋白质营养价值[48]。另一方面,特定蛋白羰基化合物,如α-氨基己二醛和γ-谷氨酸半醛,对亮氨酸和异亮氨酸形成Strecker醛具有潜在影响[49],从而影响产品的风味。然而,目前尚不清楚在何种程度上,肉类蛋白质中羰基化合物的形成会对肉制品产生显著的有害影响。
3 结 论
综上可知,烟熏时间对培根品质和HAAs的含量均有影响。随着烟熏时间的延长羰基含量、TBARS值及pH值逐渐增大,而水分含量及水分活度逐渐降低。色差结果表明,随着烟熏时间的延长,L*值先减小后增大,而a*和b*值先增大后减小。LF-NMR研究发现烟熏过程中T2b弛豫时间未发生变化,而T21和T22弛豫时间逐渐减小。HAAs含量结果表明,随着烟熏时间的延长,非极性HAAs的含量逐渐增大,而极性HAAs的含量先增大后减少。综合上述前人研究观察到的结果发现,目前关于烟熏肉制品中HAAs的来源共有3 种解释:一是本实验提出木屑燃烧产生的极性和非极性HAAs与肉中的水分以及脂类等具有亲和作用从而吸附到肉制品中;二是肉制品中游离氨基酸作为前体物质参与形成HAAs;三是熏烟中的某些成分促进了肉制品中HAAs的形成。总之,本研究表明烟熏时间能显著影响培根HAAs含量及食用品质,关于烟熏肉制品中杂环胺的具体来源,将会进一步深入研究。

