空化微射流对生物酶法豆渣蛋白结构影响的 拉曼光谱分析
李 杨,和铭钰,吴长玲,高 悦,王中江,李 萌,江连洲,滕 飞,
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.哈尔滨市食品产业研究院,黑龙江 哈尔滨 150000)
大豆种植现已遍布我国各个地区,主要种植区域位于东北、华北及长江下游地区,其中黑龙江为大豆主产区,产品品质较佳[1-2]。与传统制油工艺相比,生物酶法制油技术可同时提取油及蛋白,且处理条件温和,所得产品品质较高;同时,生物酶法制油技术现已实现产业化,其加工副产物产量可观但未充分利用,造成严重的环境污染,极大地限制了生物酶法技术的经济可行性[3-6]。多年来,国内外对豆渣的研究主要集中在多糖、膳食纤维、大豆异黄酮等方面,对豆渣蛋白的研究鲜少[7-8]。因此,生物酶法制油豆渣作为一种营养丰富、天然、低热量、低脂肪、低糖的食品原料具有很大的发展潜力[9]。
空化微射流技术是一种新型物理改性技术,它集高速冲击、高频振动、高速剪切、超微粉碎、瞬时降压等多种处理技术于一体,从而改变生物大分子物质的物理、化学及结构特性,并提高物质功能活性。近几年,有研究指出空化微射流处理对于改善蛋白结构具有显著功效[10-12]。同时,Shen Lan等[13]研究发现经微射流处理后,热聚集大豆分离蛋白(soy protein isolate,SPI)的溶解度及表面疏水性显著提高,分子间二硫键构型改变,并有效改善蛋白乳化特性。Oliete等[12]研究了空化微射流调节豌豆球蛋白可溶性聚集体的乳化性质,发现微射流加工过程的空穴效应导致球蛋白聚集体内的结构重排,从而提高了蛋白聚集体的乳液稳定性。综上所述,空化微射流技术能够对植物蛋白质的理化性质和构象等产生显著影响,与其他处理技术相比具有操作简单、处理时间短、温度低和效果独特的优点,故本研究选用空化微射流技术处理生物酶法制油豆渣。
拉曼光谱是一种基于光散射效应的分子分析技术,具有检测快速、样品需要量少且无需预处理及光谱清晰度高等优点,已在石油生产、生物医药、环境污染检测、宝石鉴定和文物鉴定等领域广泛应用。与其他光谱相比,拉曼光谱可获得关于蛋白质二级和三级结构变化的直接信息及其芳香族氨基酸的信息,并且对样品无破坏性[14-15]。故本研究运用拉曼光谱来分析豆渣蛋白结构。
综上所述,本研究以生物酶法制油豆渣为原料,运用新型空化微射流技术处理豆渣,探讨空化微射流技术对豆渣蛋白结构特性的影响,通过拉曼光谱分析技术深入解析不同处理时间下豆渣蛋白主碳链结构及其侧链基团构象变化,从豆渣蛋白二级结构的变化探讨其影响机制。研究旨在充分发挥空化微射流加工技术的优势,高效回收豆渣蛋白,并改善其功能特性,为豆渣的开发应用提供技术支持,并为推动大豆副产物高值化进程提供参考。
1 材料与方法
1.1 材料与试剂
生物酶法制油豆渣,实验室自制;碱性蛋白酶Protex-6L(酶活力不小于10 000 U/g) 丹麦丹尼斯克有限公司;其他试剂均为分析纯。
1.2 仪器与设备
S22-2型恒温磁力搅拌器 上海司乐仪器有限公司; AL204型分析天平、PL303型电子天平 梅特勒-托利多仪器(上海)有限公司;DC-500A型高速多功能粉碎机 浙江武义鼎藏日用金属制品厂;HH-4数显恒温水浴锅、JJ-1精密增力电动搅拌器 常州丹瑞实验仪器设备有限公司;PHS-3C型雷磁pH计 上海精科仪器有限公司; TDL-408型台式离心机 上海安亭科学仪器厂; DHG-9146型鼓风干燥箱 上海一恒科学仪器有限 公司;空化微射流均质机 东北农业大学食品学院实验室;Raman Station 400激光显微拉曼光谱仪 美国PerkinElmer公司。
1.3 方法
1.3.1 生物酶法制油豆渣的制备
根据Li Yang等[16]的方法进行适当修改,将市售大豆经粉碎机粉碎过60 目筛,取200 g过筛后的豆粉,按料液比1∶6(m/V)加入蒸馏水,搅拌均匀后放入55 ℃水浴锅内按照水酶法进行酶解。酶解条件为:酶解温度55 ℃、酶解时间2 h、pH值维持在9.0、碱性蛋白酶Protex-6L(8 900 U/mL)添加量为0.5%。用搅拌器边搅拌边酶解,酶解结束后,取出并用1 mol/L HCl溶液调节溶液pH值至7.0,之后在100 ℃沸水中灭酶5 min,灭酶后冷却至室温,在4 500 r/min、4 ℃条件下离心20 min,去除上层液体,仅保留下层豆渣,并在相同离心条件下按料液比1∶3(m/V)用去离子水将豆渣水洗3 遍,之后将豆渣在平板铺平后置入55 ℃鼓风烘箱,待质量恒定后取出研磨,即得所需生物酶法制油豆渣。
1.3.2 空化微射流技术处理豆渣
称取一定量研磨后的豆渣,按料液比1∶8(m/V)溶于去离子水中,采用空化微射流均质机,对其进行均质处理,处理时间分别为5、10 min和15 min,处理温度25 ℃,压力0.1 MPa,同时以未经过空化微射流处理(0 min)的样品作为对照,离心(4 500 r/min、20 min、4 ℃)后沉淀干燥即可。
1.3.3 生物酶法制油豆渣蛋白等电点的确定
根据马秀婷[17]的方法进行测定,取过100 目筛的豆渣粉50 g,按料液比1∶22(m/V)加入蒸馏水,45 ℃下用1 mol/L NaOH溶液调pH值至9.5,水浴锅搅拌提取1 h,pH值维持在9.5。在8 000 r/min、4 ℃条件下离心10 min,取上清液平均分为10 份,用1 mol/L HCl溶液分别调pH值至4.2、4.4、4.6、4.8、5.0、5.2、5.4、5.6、5.8、6.0,静置2 h后在4 ℃、8 000 r/min离心10 min,弃上清液后称质量,重复一次,以pH值为横坐标、以沉淀蛋白质量/原液质量为纵坐标绘制曲线图,沉淀量最大时的pH值为豆渣蛋白等电点,从而确定其等电点为4.6。
1.3.4 豆渣蛋白的提取工艺
根据Tao Xia等[18]的方法进行提取,取100 g豆粉用正己烷以1∶6(m/V)的比例混合搅拌1 h,4 ℃、 4 500 r/min离心20 min,脱脂,得到脱脂豆粕[19],将脱脂豆粕按1∶20(m/m)的比例与水混合,用2 mol/L NaOH溶液调节pH值至9.0,常温搅拌2 h后,将其悬浮液在4 ℃条件下9 000 r/min离心30 min,取上清液。再用2 mol/L HCl溶液调节pH值至豆渣蛋白等电点4.6。静置2 h后在4 ℃条件下7 000 r/min离心30 min,得蛋白沉淀用去离子水洗3 次,最后取沉淀溶解于水中并用2 mol/L NaOH溶液调节pH值至7.0。再在4 ℃条件下9 000 r/min离心30 min,取上清液,将此蛋白溶液冷冻干燥后研磨即得粉末状豆渣蛋白。
种什么树,开什么花,结什么果。百雀羚在天猫“双11”大促中备货8万套,当天售罄。目前,百雀羚电子商务在化妆品类目的排名稳定在12名左右,佐证了百雀羚进军电商渠道的正确性和前瞻性。
1.3.5 空化微射流技术处理前后豆渣蛋白的拉曼光谱分析
运用Raman Station 400拉曼光谱仪进行测定。激发光波长7 8 5 n m,激光功率8 0 mW,扫描范围400~2 000 cm-1,每次扫描时间60 s,积分10 次,4 次扫描进行累加。以苯丙氨酸((1 003±1)cm-1)作为归一化因子,作豆渣蛋白的拉曼谱图。谱图基线校正、谱峰归属查找采用ACD Labs V12软件。
1.4 数据统计分析
所有的实验至少进行3 次实验,利用SPSS Statistics 22 软件,采用方差分析对数据进行差异显著性比较,P<0.05为显著性差异。采用Origin 9.5软件、PeakFit 4.12软件进行数据分析、图表处理及图谱分析处理。
2 结果与分析
2.1 豆渣蛋白拉曼光谱分析结果
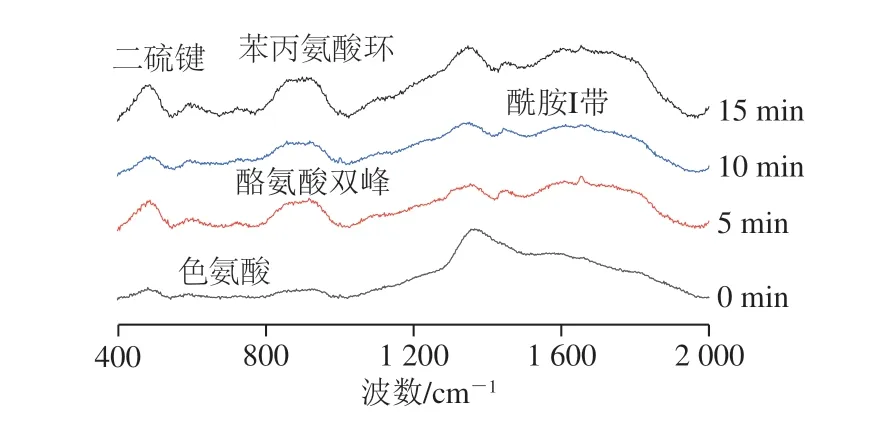
图 1 不同空化微射流处理时间下豆渣蛋白拉曼光谱图Fig. 1 Raman spectra of soybean dreg protein subjected to different durations of cavitation microjet treatment
为了有效分析经空化微射流处理生物酶法制油豆渣中蛋白组分结构特征,采用拉曼光谱技术在400~2 000 cm-1范围内进行分析研究,结果如图1所示。依据已有研究进行各峰位归属,分别列于表1中[20]。由于拉曼谱带的强度与散射中心的数目成正比,谱带强度的变化即意味着散射中心(包括基团和化学键)数目的变化。强度变小说明相应谱带所属的基团或化学键受到损伤。如果谱带位移,则可能是相应的基团或化学键受到影响而发生变化的缘故。拉曼光谱中谱峰位置及强度的变化主要用于研究豆渣蛋白的二级结构和疏水微环境的变化。
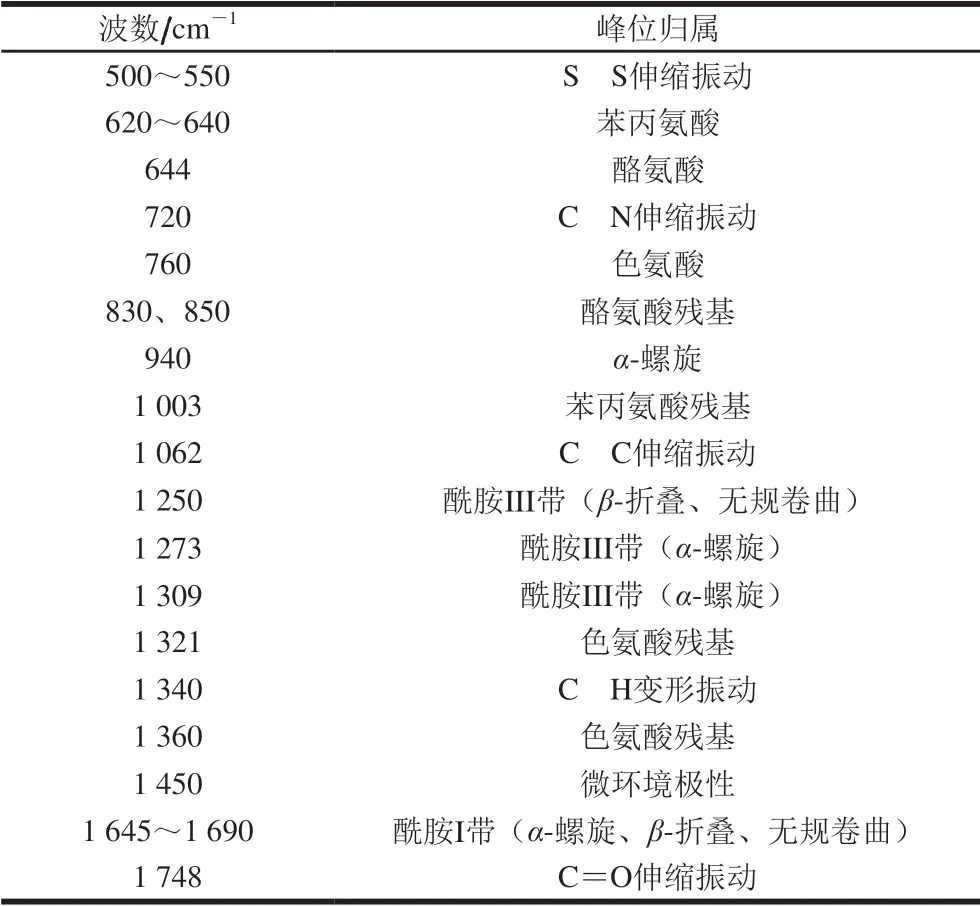
表 1 豆渣蛋白拉曼光谱特征频率归属Table 1 Raman spectral characteristic frequency attribution of soybean dreg protein
2.2 豆渣蛋白主链结构特征拉曼光谱分析结果
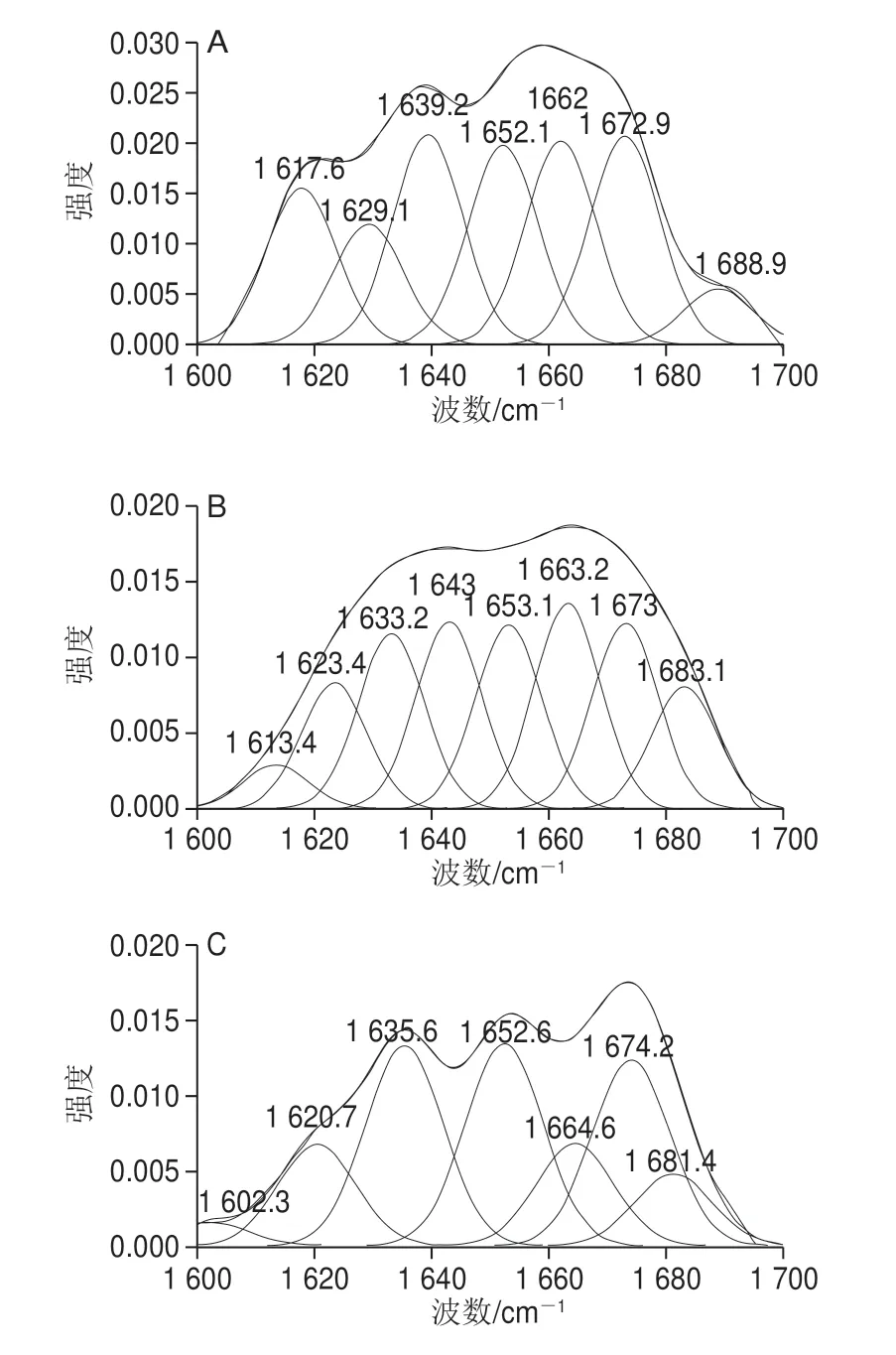
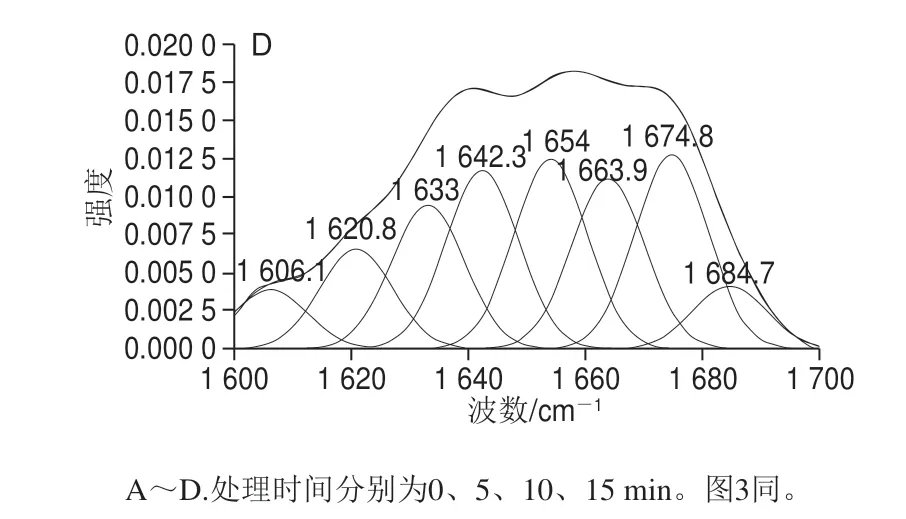
图 2 豆渣蛋白酰胺I区分峰和迭代拟合曲线Fig. 2 Segregated and iterative curve-fitted Raman bands of soybean dreg protein in amide I region
豆渣蛋白酰胺I带拉曼特征峰位置为:α-螺旋结构,1 645~1 660 cm-1;β-折叠结构,1 670~1 680 cm-1;β-转角结构,1 680~1 690 cm-1;无规卷曲结构,1 660~1 670 cm-1。将1 003 cm-1波段作为归一化因子,此波段的苯丙氨酸结构稳定,不易被外界环境干扰。各谱中以它的强度作为1,在此基础上计算了不同空化微射流豆渣蛋白溶液中各个基团的谱带强度变化率[21-22]。本实验中豆渣蛋白的拉曼图谱二级结构的定量计算由PeakFit 4.12软件完成,图2所示为豆渣蛋白拉曼谱带在1 600~1 700 cm-1区域内的拟合图谱。
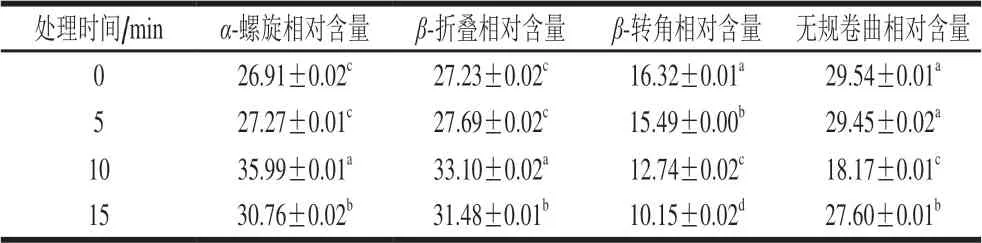
表 2 空化微射流处理豆渣蛋白二级结构组分相对含量Table 2 Relative contents of secondary structure components of soybean dreg protein treated by cavitation microjet %
不同空化微射流处理时间对酰胺I带豆渣蛋白二级结构相对含量变化情况如表2所示。研究发现,与未处理豆渣蛋白相比,经空化微射流处理后豆渣蛋白的α-螺旋及β-折叠结构相对含量显著增加(P<0.05)。另外,随空化微射流处理时间延长,豆渣蛋白α-螺旋及β-折叠结构相对含量呈现先增加再降低的变化趋势,当处理时间达到10 min时,α-螺旋及β-折叠结构相对含量达到最大为69.09%,β-转角相对含量呈下降趋势,而无规卷曲结构相对含量呈先下降再上升的变化趋势。
上述结果表明空化微射流处理可以破坏蛋白质二级结构中氨基酸局部序列、氢键及其他分子间及分子内相互作用基团,从而导致二级结构变化。与未处理豆渣蛋白相比,空化微射流的高速冲击、振动、剪切作用使分子间相互作用减弱,非极性基团暴露,导致分子间疏水作用减弱并破坏分子间氢键,使得豆渣蛋白α-螺旋和β-折叠结构相对含量增加,β-转角及无规卷曲结构相对含量下降;另一方面,空化微射流处理使豆渣蛋白分子间有序结构增加,蛋白质聚集,故α-螺旋和β-折叠构象比例升高[23-25]。Sun Cuixia等[10]分析玉米醇溶蛋白在动态高压微射流技术处理下分子链缠结和聚集,结果表明α-螺旋、β-折叠相对含量分别从57.1%、16.8%增加到59.4%、17.9%,β-转角相对含量从8.6%下降至5.0%,印证了本研究中α-螺旋和β-折叠相对含量增加,β-转角相对含量下降的结果。
处理时间达到10 min后,豆渣蛋白α-螺旋及β-折叠结构相对含量降低,无规卷曲结构相对含量增加。随着空化微射流时间的延长,豆渣蛋白分子间碰撞停止,继续处理,氢键作用反而增大,导致α-螺旋和β-折叠结构相对含量下降。同时,豆渣蛋白分子链解折叠,导致无规卷曲这种无序结构相对含量增加。
2.3 豆渣蛋白侧链结构特征拉曼光谱分析结果

表 3 空化微射流处理豆渣蛋白侧链基团谱带强度Table 3 Side chain group band strength of soybean dreg protein treated by cavitation microjet
拉曼光谱中760 cm-1附近的区域表征色氨酸残基的微环境及氢键的变化规律[26-28]。由表3所示,随着空化微射流作用时间的延长,色氨酸谱带强度表现出先降低后增加的趋势。与未处理豆渣蛋白相比,经空化微射流处理后豆渣蛋白拉曼光谱峰强度在760 cm-1附近区域显著降低(P<0.05),表明色氨酸残基由包埋的疏水环境转变为暴露在极性环境中,豆渣蛋白分子间疏水作用 减弱[29-30]。然而,当作用时间超过10 min时,色氨酸谱带强度显著增加(P<0.05),表明色氨酸又变为包埋状态,豆渣蛋白分子间疏水作用增强。Yang Feng等[31]研究了旋转空化对SPI功能特性的影响,通过测定表面疏水性发现,旋转空化可以减少分子间缔合,导致SPI结构的展开,疏水区域的暴露,表面疏水性显著升高。表明空化作用会使豆渣蛋白分子展开,疏水基团暴露,疏水性氨基酸呈“暴露态”。
2.3.2 酪氨酸残基
酪氨酸残基上对位取代苯环的呼吸振动和面外弯曲倍频之间能在830 cm-1和850 cm-1附近形成费米共振双峰,R值(R=I850/I830,In表示谱带在波数为n时的强度)反映了蛋白质分子中的酪氨酸残基的暴露与埋藏,是监测酪氨酸残基微环境的有效探针。当R值在0.7~1.0时,酪氨酸残基埋藏在分子内部;当R值小于0.3时,表明酪氨酸残基中存在强氢键;当R值大于1.0时,表明酪氨酸残基暴露在水相或者极性环境中[32-33]。在本研究中,R值分布在1.10~1.20范围内,表明豆渣蛋白的酪氨酸残基暴露于极性环境中,环上的羟基氧原子作为中性强度氢键的供体和受体。
由表3可知,R值呈现先降低后升高的趋势,表明空化微射流处理可以破坏维持蛋白质三级结构的主要作用力,使豆渣蛋白酪氨酸残基充分暴露,但随着处理时间的延长,又会导致酪氨酸残基暴露程度降低。
2.3.3 脂肪族氨基酸
1 450 cm-1可以表征CH2或CH3从蛋白质侧链和脂质产生的振动弯曲,是脂肪族氨基酸的拉曼归属谱带[34-35]。由表3可以看出,拉曼光谱中1 450 cm-1的谱带强度随着空化微射流时间的延长呈先下降后增加的趋势。在本研究中,经过5 min的空化微射流处理的、豆渣蛋白拉曼归属峰在1 450 cm-1附近区域显著降低(P<0.05),脂肪族氨基酸趋于“暴露态”,这与豆渣蛋白结构的解折叠及二级结构转变有关。然而,当作用时间超过10 min时,脂肪族氨基酸谱带强度显著增加(P<0.05),表明脂肪族氨基酸又埋藏在分子内部。
2.4 豆渣蛋白二硫键拉曼光谱分析结果
二硫键的特征谱带在500~550 cm-1范围内,并且与分子内和分子间的巯基/二硫键相互转化有关。二硫键在不同振动模式下所反映出来的拉曼位移有所不同,其中,500~515 cm-1处为gauche-gauche-gauche(g-g-g)模式,515~525 cm-1为gauche-gauche-trans(g-g-t)模式,525~545 cm-1为trans-gauche-trans(t-g-t)模式[36-37]。 为了探究空化微射流对豆渣蛋白二硫键的影响,运用Peak Analyzer软件进行多峰值Guassian拟合。
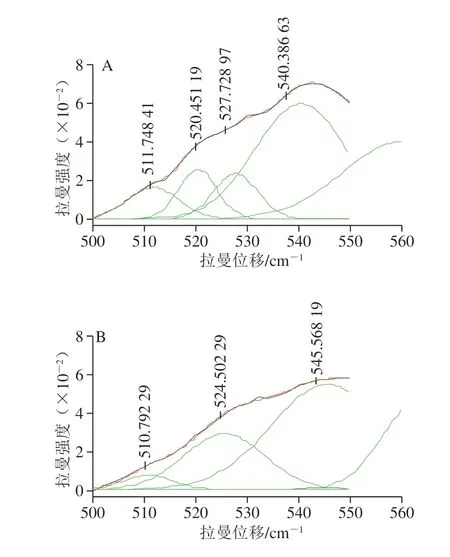
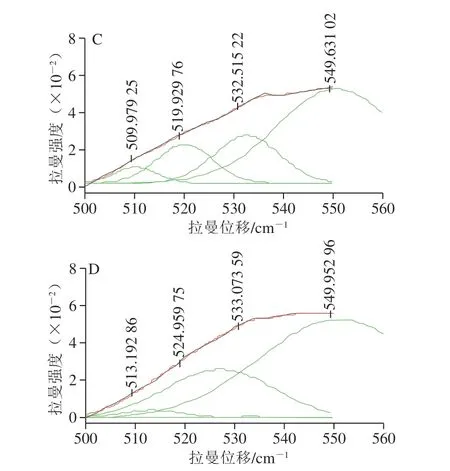
图 3 豆渣蛋白拉曼谱带在490~560 cm-1区域内的高斯拟合图Fig. 3 Fitted Gaussian peaks of soybean dreg protein in the region of 490–560 cm-1
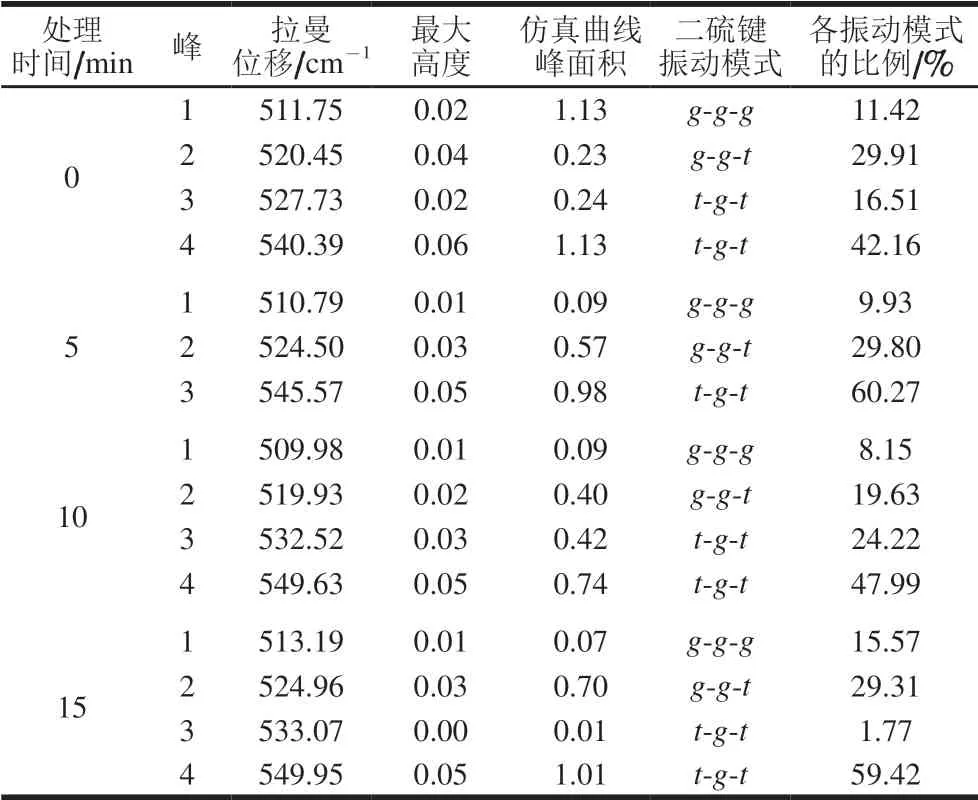
表 4 空化微射流处理豆渣蛋白在 500~550 cm-1区域拟合结果Table 4 Fitting results for soybean dreg protein subjected to cavitation microjet treatment in the 500–550 cm-1 region
从图3可以看出,重新合成的拟合谱带与实验数据贴近,证明拟合结果是准确的。对拟合的各个高斯峰值进行归属,不同空化微射流处理时间豆渣蛋白二硫键的振动模式归属如表4所示。经空化微射流处理后,g-g-g和g-g-t模式比例呈现先下降后上升趋势,而t-g-t模式比例先增加后下降。随着空化微射流时间的延长,二硫键变化明显,原因是豆渣蛋白颗粒被破坏,使得包埋在内部的游离巯基被氧化生成二硫键,造成蛋白质三级结构变化。这与Oliete等[12]利用动态高压流化技术调节豌豆球蛋白可溶性聚集体,使得游离巯基含量减少,二硫键增多结果相似。同时t-g-t模式比例增加,当处理时间达到10 min时,达到最大72.21%,表明豆渣蛋白分子间作用力增强,进而形成一种趋于更稳定的结构。随着时间的延长,t-g-t模式比例降低,表明蛋白质稳定性降低,豆渣蛋白分子间作用力减弱。
3 结 论
以生物酶法制油豆渣蛋白为原料,经过不同时间的空化微射流处理,利用拉曼光谱分析豆渣蛋白的各种功能键与蛋白质二级结构的变化,发现空化微射流处理10 min时豆渣蛋白效果最好。结果表明,空化微射流处理提高了豆渣蛋白的α-螺旋及β-折叠结构含量,并降低了β-转角和无规卷曲结构;I760、I1450和I850/I830变化表明,疏水性氨基酸残基暴露程度加深;空化微射流处理改变了豆渣蛋白的二硫键构型,g-g-g和g-g-t模式比例降低,以及t-g-t模式比例增加。综上,空化微射流技术可以改变生物酶法制油豆渣蛋白的二级结构,对其有一定的积极作用,使豆渣蛋白无序结构趋于有序化,提高其稳定性,为豆渣蛋白在食品加工过程中的应用提供了一定的理论依据。

