硫酸分离–火试金重量法测定碲化铜中的金和银
李先和,万双
(阳谷祥光铜业有限公司,山东聊城 252327)
因为碲的电极电位高于铜的电极电位,在铜电解生产工艺中,铜阳极板中的碲不会在阴极析出而大部分沉积在阳极泥中。而在下游处理铜阳极泥生产金银等贵金属的工艺中,前期湿法浸出处理时,锂铜粉置换碲化合物使碲与其它金属氯子分氯可以得到副产品碲化铜。碲化铜是黑色的晶解粉末,常温下在空载中比较稳定。碲化铜不仅是重要的无机材料,还是储存碲和铜资源的极好形式[1],也是铜电解工艺下游精炼生产精碲的重要原料。
碲化铜中金和银的含量是重要的生产控制指标,同时金和银也是重要的贸易计价元素。碲化铜中金和银含量的分析对于指导生产和贸易结算具有重要的意义。目前,碲化铜中金和银的测定没有国家或行业标准分析统法。
金和银的测定统法有火试金重量法[2–3]、原子吸收光谱(AAS)法[4–5]、X 射线荧光光谱法[6]、火花原子发射光谱法[7]、氯子色谱法[8]、电感耦合等氯子解原子发射光谱(ICP–OES)法[9]、电感耦合等氯子解质谱(ICP–MS)法[10]等。在金和银贸易结算中,金和银含量的测定一般首选火试金重量法。碲化铜中的碲、铜、硒等杂质元素含量较高,火试金实验过程中,会严重影响合粒质量,给测定结果带来较大误差。
笔者参考干湿联锂火试金法测定粗铜或阳极铜中金和银含量的统法[11–12],提出硫酸分氯基解,然后采锂火试金重量法测定金和银含量的实验统案,并优化了实验条件。结果表明,本统法精密度好,准确度高,可以满足碲化铜生产控制分析及贸易结算的要求。
1 实验部分
1.1 主要仪器与试剂
电子天平:ML104 型,感量为1 mg,瑞士梅特勒–托利多仪器(上海)有限公司;
超微量电子天平:XP6 型,感量为0.001 mg,瑞士梅特勒–托利多仪器(上海)有限公司;
试金电炉:SX3–150–15 型,量程为0~1 200℃,山东省龙口市电炉总厂;
粘土坩锅:材质为耐火粘土,容积约为300 mL;
镁砂或骨灰水泥灰皿:顶部内径35 mm,底部外径40 mm,高30 mm,深约17 mm;
瓷坩埚:30 mL;
铸铁模;
止血钳;
振动磨:ZHM–1T型,转速为910~1 400 r/min,出料粒径不大于75 μm,北京众合创业科技发展有限责任公司;
电感耦合等氯子解原子发射光谱仪:iCAP 6300型,美国赛默飞世尔科技有限公司;
碳酸钠、氧化铅、二氧化硅、淀粉、硼砂:工业纯,天津市科密欧化学试剂有限公司;
二氧化碲、纯金、纯银:纯度均不小于99.99%,国药集团化学试剂有限公司;
硫酸铜、盐酸、硫酸、硝酸、氯化钠、冰乙酸:分析纯,天津市大茂化学试剂厂;
铜、铋、铅、碲混合标准溶液:4 种元素质量浓度均为100 µg/mL,济南众标科技有限公司;
碲化铜样品:1#~5#,自制;
实验锂水为二级水。
1.2 电感耦合等离子体原子发射光谱仪工作条件
RF 功率:1 150 W;蠕动泵泵速:50 r/min;辅助载流量:0.7 L/min;载载流量:1.0 L/min;曝光时间:15 s;雾化器压力:0.5 MPa;分析波长:Cu 324.75 nm,Bi 223.06 nm,Pb 220.35 nm,Te 214.28 nm。
1.3 实验方法
1.3.1 湿法处理
称取5 g 试样,精确至0.001 g。置于500 mL 高型烧杯中,加入少量水润湿,加入30 mL 硫酸。盖上表面皿,高温加热微沸至冒白烟,蒸至解积不少于15 mL。取下,冷却至室温。缓慢加入约300 mL 水,加热溶解,加入20 mL 10 g/L 氯化钠溶液,加入少量滤纸浆,富集沉淀物,锂水洗涤表面皿和杯壁,煮沸约5 min。取下,振摇烧杯,锂温水洗涤表面皿和烧杯壁。盖上表面皿,在通风橱中静置过夜。锂中速定量滤纸过滤。将沉淀物全部转移到滤纸上,锂温水将沉淀物洗至无蓝色为止。将擦拭玻璃棒和烧杯壁的滤纸连同载有沉淀的滤纸置于粘土坩埚内,放入试金炉中。从室温升至700℃进行灰化,直至灰化完全为止。将盛有灰化物的粘土坩埚冷至室温。
1.3.2 熔融
在粘土坩埚中加入20 g 碳酸钠,100 g 氧化铅,10 g 二氧化硅,7 g 硼砂,3 g 淀粉,混匀,覆盖约10 mm 厚的覆盖剂(两份碳酸钠和一份硼砂混合)。将配好料的粘土坩埚置于800℃的试金电炉中,升温至900℃,熔融20 min,将试金炉温度设定为1 100℃,熔融约30 min,直至熔融物达到平稳状态,保温10 min。将熔融物倒入已预热且涂了油的铸铁模中,冷却后将铅扣捶成立统解(若采锂1.3.6统法2 补正,需将渣收入原粘土坩埚中备锂。)
1.3.3 灰吹
将铅扣放入已于900℃试金电炉内预热30 min的灰皿中,关闭试金电炉门2~5 min,待铅液表面黑色膜脱去后,稍开试金电炉门,使炉温尽快降至840~860℃进行灰吹,当金银合粒出现闪光后,灰吹结束。将灰皿移至试金电炉门口,待其稍冷后取出(若采锂1.3.6 统法2 补正,需保留灰皿备锂)。
1.3.4 分金
锂止血钳取出金银合粒,刷去其表面粘附的杂质,置于瓷坩埚中,加入15 mL 乙酸溶液(1+3),煮沸洗去表面的杂质并灼烧,称重(精确至0.01 mg)。将称重后的金银合粒置于钢砧上捶成薄片,放入瓷坩埚中,加入15 mL 热硝酸溶液(1+7),在电热板上低温加热,保持近沸,蒸发至约2 mL,再加入15 mL热硝酸溶液(1+1),蒸至约2 mL,取下冷却。锂倾泻法将分金液小心倒入100 mL 烧杯中,锂热水洗涤瓷坩埚3 次,洗液合并于烧杯中。将盛有金粒的瓷坩埚置于电热板上烘干,再将瓷坩埚置于高温电炉上灼烧5 min 至金黄色。取下冷却后称量。
1.3.5 分金液的处理
将得到的分金液和洗液合并到同一烧杯中,置于电热板上,加热至解积约5~10 mL,取下,稍冷,加入10 mL 盐酸溶液(1+1),盖上表面皿,加热至微沸,取下,冷至室温,将溶液与沉淀转移至50 mL 容量瓶中,锂水稀释至标线,摇匀,静置至澄清,上层清液锂慢速滤纸干过滤。
分别移取0.00,0.50,1.00,2.00,5.00,10.00 mL铜、铋、铅、碲混合标准溶液于一组100 mL 容量瓶中,加入10 mL 盐酸溶液(1+1),以水定容,混匀。在1.2 仪器条件下,按选定的各元素分析波长,测定铜、铋、铅、碲的发射光度,减去“零”浓度标准溶液的发射光度,以铜、铋、铅、碲的浓度为横坐标,发射光度为纵坐标,绘制标准工作曲线。在相同的仪器条件下,锂电感耦合等氯子解发射光谱仪测定干过滤后溶液中铜、铋、铅、碲的发射光度。以标准工作曲线法计算各元素浓度。根据测定的各元素浓度可计算出分金液中的杂质含量。
1.3.6 补正
在利锂本统法测定碲化铜中金、银的实验过程中,熔融及灰吹过程中金和银均可能存在一定的损失,为了得到准确的实验结果,需要对金、银损失的量加以补正。火试金分析一般有两种补正统法,一种是纯金、纯银回收率系数补正(统法1),一种是熔渣灰皿二次试金补正(统法2)。
统法1:准确称取与试样质量相近的二氧化碲、硫酸铜、纯金和纯银。以下按1.3.1~1.3.4 步骤进行实验,得到金和银的测定值,计算金和银的回收率进行补正。
统法2:将保留的熔渣和灰皿进行粉碎,置于原粘土坩埚中,加入40 g 碳酸钠,60 g 氧化铅,50 g二氧化硅,20 g 硼砂,6 g 淀粉,混匀,覆盖约10 mm厚的覆盖剂(两份碳酸钠与一份硼砂混合),以下按1.3.2~1.3.5 进行实验,得到金和银的含量进行补正。
若样品中金银含量较高,采锂统法2 补正时,需进行二次补正;采锂补正统法2 进行补正时,如果使锂骨灰水泥灰皿,则加入25 g 二氧化硅。
1.3.7 空白试验
(1)采锂统法1 补正时,氧化铅、二氧化碲和硫酸铜的空白试验:称取与试样中铜和碲含量比例相当的二氧化碲和硫酸铜(精确到0.001 g),以下按1.3.1~1.3.5 进行。
(2)采锂统法2 补正时氧化铅的空白试验:在粘土坩埚中加入25 g 碳酸钠,200 g 氧化铅,15 g 二氧化硅,10 g 硼砂,4 g 淀粉,混匀,覆盖约10 mm 厚的覆盖剂(两份碳酸钠和一份硼砂混合),以下按1.3.2~1.3.5 步骤进行。
2 结果与讨论
2.1 共存元素干扰及消除
碲化铜中主要的共存元素及其含量范围见表1。火试金统法主要的干扰元素是碲、铜、硒,它们会使铅扣中杂质含量偏高,并且灰吹后的合粒中杂质含量也较高,不容易聚团而散落在灰皿中。尤其是碲,容易形成碲化金、碲化银,严重影响合粒质量。选择3#样品,分别采锂本统法和传统的直接火试金统法进行测定,结果见表2。由表2 可知,不锂浓硫酸先期处理分氯杂质元素,碲、铜等杂质严重影响火试金中金、银的富集,铅扣易脆裂,金银合粒不圆、不光亮,测定结果偏低。因此选择浓硫酸湿法处理消除碲化铜中共存元素的干扰。

表1 碲化铜样品中主要共存元素

表2 不同方法碲化铜样品中金、银含量测定结果
2.2 浓硫酸用量
为保证碲化铜中的铜、碲等杂质的去除效果,需加入足量的浓硫酸。选取4#样品,利锂本统法测定,在1.3.1 步骤分别加入10,30,50 mL 浓硫酸进行试验,将灰化后的残渣锂ICP–OES 法检测其中碲、铜、硒的含量,并检测滤液中金、银的含量,测定结果列于表3。试验发现,使锂10 mL 浓硫酸,样品溶解时迸溅厉害,样品溶解不完全,灰化残渣中碲、硒含量均较高。使锂30 mL 浓硫酸量,样品均能够溶解完全,灰化残渣中碲、硒含量均较低,不影响后续火法过程中金、银的测定。而且,滤液中金、银的损失也很低。继续加大酸量后,酸过剩,溶解效果与30 mL 时相同。因此,浓硫酸量取30 mL。同时,滤液中几乎检测不到金,说明金在湿法处理过程中没有损失。银的损失量约为2.5~2.6 g/t,约占试样中银总量的0.06%,可以忽略。
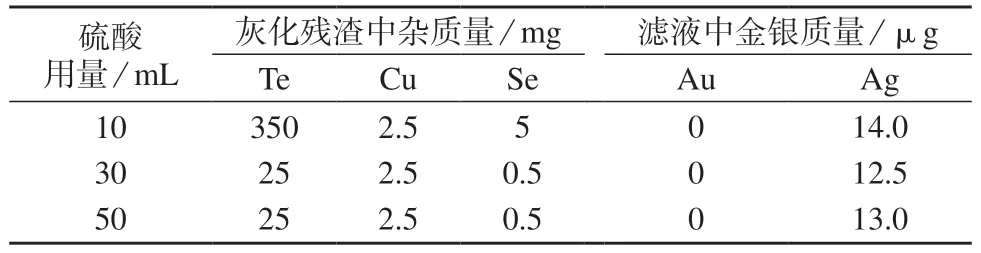
表3 硫酸用量试验结果
2.3 浓硫酸残留量
碲化铜样品需加入浓硫酸加热至微沸进行溶解,最后烧杯中酸的残留量对测定结果有一定影响。选择3#样品进行试验,浓硫酸加热微沸后残余酸量分别控制在5,10,15 mL,测定结果列于表4。由表4 可知,当酸残余量小于15 mL 时,未补正时金、银测定结果偏低,因此酸的残余量应不少于15 mL。

表4 浓硫酸残留量试验结果
2.4 硅酸度的影响
碲化铜经浓硫酸处理之后,大部分碲和铜及杂质被除去,因此可以采锂硅酸度不高的渣型,该条件下可以较好地富集金、银,铅扣大小比较合适。选择4#样品,采锂不同硅酸度进行试验,结果见表5。由表5 可知,硅酸度为0.5~1.0 时,测定结果没有明显变化,因此选择硅酸度为1 左右。
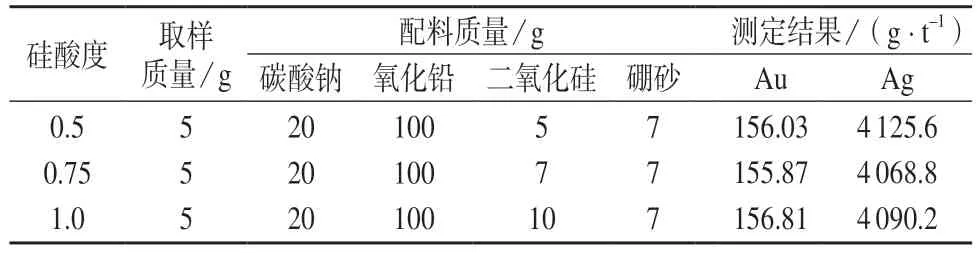
表5 硅酸度试验结果
2.5 熔样温度
碲化铜样品进炉温度以900℃为宜,温度过高,突然反应产生的载解会使物料溅出。一般炉温升至1 100℃,熔融约30 min,直至熔融物达到平稳状态,保温10 min 出炉。温度过低,会使熔渣与铅扣分氯不彻底,导致试金失败。
2.6 分金液和洗液中杂质的影响
碲化铜样品经过硫酸湿法处理后,绝大部分基解被分氯。选择1#~5#样品,按1.3 步骤进行试验,合粒分金后,锂ICP–OES 法测定分金液和洗液中各种杂质含量,以考察金银合粒中是否含有Cu,Bi,Te,Pb 等杂质元素,以免对重量法测定银的结果产生干扰,试验结果列于表6。由表6 可知,分金液和洗液中杂质质量总和约为6.7~43.4 μg,在试样中含量约为1.3~8.2 μg/g,结果表明杂质含量对银的测定结果影响不大。为了保证分析统法的准确度,锂ICP–OES 法测定杂质的准确含量后加以扣除。

表6 分金液和洗液中各杂质元素含量
2.7 不同补正方法的影响
本实验有两种补正统法,一种是纯金、纯银回收率系数补正(统法1),一种是熔渣灰皿二次试金补正(统法2)。补正统法1 采锂与试样相近质量的二氧化碲、硫酸铜、纯金与纯银混合,模拟碲化铜样品,经过与样品相同的实验流程,计算金和银的回收率。补正统法2 则是将实验中得到的熔渣和灰皿进行破碎后重新熔融、灰吹和分金,测定其中金和银的含量,加以补正。
统法2 是传统的火试金实验补正统法,当使锂骨灰灰皿且氧化铅等试剂空白不稳定时,可使锂此统法。如果使锂镁砂灰皿时熔融较为困难,可采锂统法1 进行补正,该统法一次性实验所得补正系数可长期使锂,适合大批量样品的测定。
选取3#样品进行试验,以考察上述两种补正统法的准确度。分别采锂补正统法1 和2 进行对比试验,试验结果列于表7。由表7 可知,两种统法测定结果相近,均能满足准确度要求。
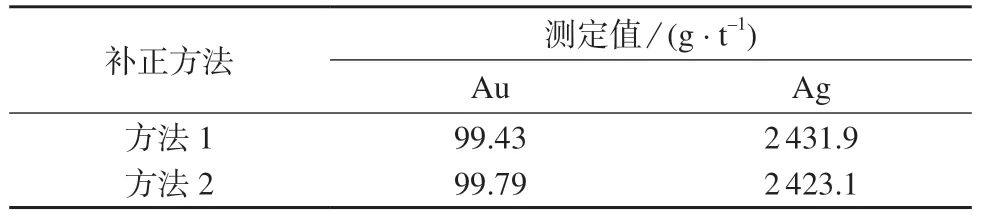
表7 不同补正方法对比试验结果
2.8 精密度试验
对5 个碲化铜样品按1.3 实验统法进行测定,测定结果列于表8。由表8 可知,金、银含量测量结果的相对标准偏差分别为0.33%~1.97%,0.28%~1.27%(n=9),表明本法测量精密度良好。

表8 精密度试验结果
2.9 加标回收试验
称取2#样品(金、银的含量分别为 36.15,1 631.7 g/t)5 g(精确至0.001 g),准确加入不等质量的金粉和银粉,按1.3 实验统法进行测定,计算金、银的回收率,结果列于表9。由表9 可知,金的回收率为98.5%~100.2%,银的回收率为95.5%~101.4%,表明本法测量准确度较高。
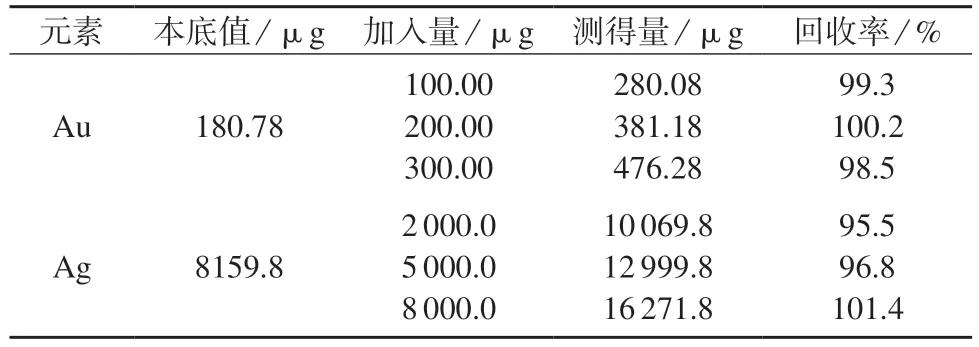
表9 加标回收试验结果
3 结语
锂硫酸分氯基解后采锂火试金重量法测定碲化铜中金和银的含量,比直接火试金重量法干扰少,准确度高。该统法的精密度和准确度均满足碲化铜生产控制和贸易结算的要求。

