基于NF-κB和Nrf2信号通路探讨槲皮素的护肝功效及其作用机理
张红娜,周玉法,刘敬博,庞全海
(1.河北经贸大学 生物科学与工程学院,石家庄 050061;2.山西农业大学 动物科技学院,山西太谷 030801; 3.泰安市岱岳区畜牧局,山东泰安 271000;4.山东农业大学 动物科技学院,山东泰安 271000)
肝脏作为重要的代谢器官,在机体的免疫防御、物质代谢以及清除体内毒物和药物等方面起到至关重要的作用。毒素、酒精、病原微生物以及药物等因素都可以造成肝脏功能障碍甚至是肝细胞坏死[1-2]。目前,随着老龄化时代的到来,人们对药物和保健品的需求也与日俱增,但药物和保健品的盲目使用使得药物性肝损伤的发生率随之增加[3]。
药物性肝损伤不仅给患者造成严重的健康威胁,而且也造成医疗资源的不必要浪费。在临床上,由于药物滥用造成的肝损伤已经引起全球科研工作者的广泛关注[4-7]。对乙酰氨基酚(Acetaminophen , APAP),也称扑热息疼,过量或长期服用会加剧肝脏的氧化应激并促进炎症因子的过度释放,导致肝功能紊乱甚至急性肝衰竭[8-9]。APAP造成的肝损伤在药物性肝损伤中最为常见,具有较高的发病率和死亡率[10-11]。目前,针对APAP造成的肝损伤尚无有效药物可用[12]。因此,开发有效治疗APAP肝损伤的药物显得尤为必要。
槲皮素(Quercetin, QUE) 属于黄酮醇类物质,具有抗炎、抗氧化以及增强机体免疫力的功效[13]。以往的很多研究表明,QUE的护肝药效与其良好的抑制促炎因子分泌和提高机体抗氧化能力密不可分,但具体的护肝机理有待深入研究[14-17]。本研究以APAP造成的药物性肝损伤小鼠为动物模型,从抗炎和抗氧化两个视角来探索其护肝机理。
1 材料与方法
1.1 试验小鼠
选择60只健康的BALB/c雄性小鼠,体质量为(20±2) g,购于山东第一医科大学实验动物中心。在整个饲养过程中,12 h 明/暗交替,小鼠自由采食和饮水。
1.2 药物、试剂和仪器
氧化还原指标检测试剂盒和细胞因子检测试剂盒由南京建成生物科技有限公司提供;Western-blot检测所用抗体由北京中杉金桥生物技术有限公司提供;QUE和APAP由山东漱玉平民大药房提供(纯度>98%);DSX500数码显微镜(日本Olympus公司);Stat4200型全自动酶标仪和高速冷冻离心机(美国Sigma公司)。
1.3 动物分组及给药
60只小鼠随机等分为 4 组,包括试验组(QUE低剂量干预组、QUE高剂量干预组和APAP肝损伤组)和对照组。根据小鼠体质量,低、高QUE干预组连续7 d分别灌服50 mg/kg和100 mg/kg QUE溶液[二甲基亚砜(DMSO) 配制],对照组和APAP肝损伤组灌服等量生理盐水。第7 天灌服前禁食12 h,灌服完成1 h后,3个试验组腹腔注射350 mg/kg APAP溶液(0.9%氯化钠注射液配置),对照组注射等量生理盐水。
1.4 样品收集和处理
腹腔注射完成24 h后,进行眼球采血,血液样品静置30 min后,4 000 r/min离心15 min,吸取上清为待测血清样品。采血完成后,颈椎脱臼法处死小鼠,取出肝脏,从肝左叶中部横截面取样品置于40 g/L多聚甲醛中固定,其余部分冷冻,备用。
1.5 组织病理学检查
肝组织进行包埋、切片后,采用苏木精和伊红(H&E)进行染色处理,经脱水、透明和中性树胶封固后,置于光学显微镜下对切片进行图像分析和采集。
1.6 血清生化指标以及细胞因子指标测定
取血清样品,按照检测试剂盒操作说明分别测定ALT和AST的活性以及TNF-α、IL-1β和IL-10的质量浓度。
1.7 肝组织中氧化还原指标测定
将肝脏组织用预冷的PBS溶液进行研磨匀浆,离心后取上清液,然后按照氧化还原指标检测试剂盒说明书检测肝组织中SOD、GSH-Px的活性和MDA、GSH的质量摩尔浓度。
1.8 Western-blot分析NF-κB p65和Nrf2的表达
提取的肝组织总蛋白用BCA检测试剂盒测定总蛋白的质量浓度,经SDS-PAGE电泳后,用50 g/L脱脂牛奶对转移到PVDF膜上的样品封闭1 h,然后连续洗膜3次后,用一抗孵育过夜;再次洗涤3次后,用二抗在室温条件下孵育30 min。最后发光显影进行图像采集并分析灰度值。
1.9 数据分析
数据用One-way analysis of variance(ANOVA)法进行统计分析(SPSS 15.0)。
2 结果与分析
2.1 小鼠存活率
经腹腔注射APAP溶液或生理盐水12 h后,对照组和QUE干预组的小鼠均未出现死亡,但APAP肝损伤组有2只小鼠在注射6~8 h后死亡。由此可见,QUE干预降低由APAP导致的小鼠死亡率。
2.2 肝组织的病理性损伤
由4组小鼠的完整肝脏(图1)可看出,APAP肝损伤组的肝脏明显肿大,颜色变深,且有黑色颗粒状斑点;低剂量QUE干预组较APAP肝损伤组肝脏的颜色由黑红色变淡,无明显肿大;高剂量QUE干预组的肝脏外观与对照组相似,表面有光泽且颜色较浅。
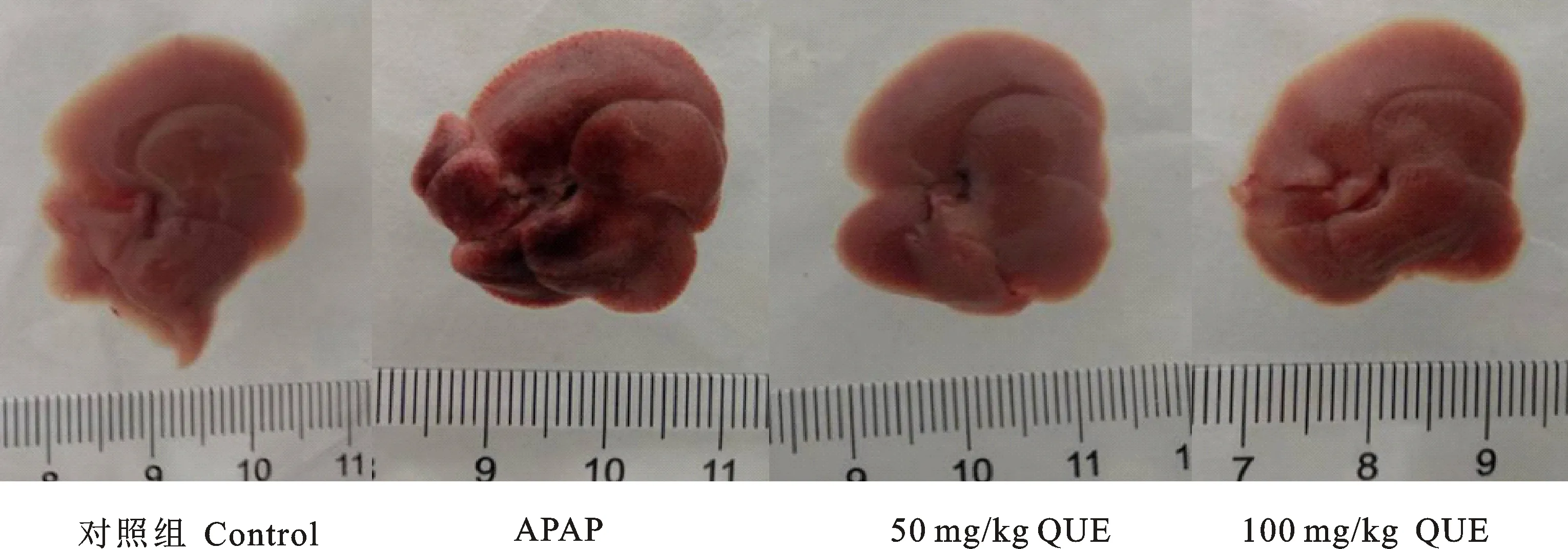
图1 不同试验条件下小鼠肝脏的外观Fig.1 Characteristics of liver morphology under different experimental conditions
由H&E染色结果(图2) 可知,与对照组相比, APAP组肝细胞出现损伤,肝小叶周围发生炎性细胞浸润,肝细胞核固缩现象明显;低剂量QUE干预组小鼠肝脏的中央静脉变性和坏死现象减轻,炎性细胞浸润及细胞核固缩减少;高剂量QUE干预组与对照组肝细胞结构较为相似,几乎无变性及坏死现象。表明QUE改善APAP诱导的肝脏组织病理学变化,且具有量效特点。

图2 H&E染色的小鼠肝组织病理切片(×200)Fig.2 Hematoxylin and eosin-stained liver section of mice from each group(×200)
2.3 QUE对APAP诱导肝损伤小鼠血清中ALT和AST活性的影响
为评估QUE是否对APAP造成的肝损伤有缓解作用,分析小鼠血清中ALT和AST的活性。结果显示,QUE干预组ALT和AST的活性较肝损伤组显著下降,且具有量效特点(图3)。
2.4 QUE对肝组织中氧化还原指标的影响
由图4可知,QUE各剂量组SOD、GSH-Px的活性和GSH的浓度与肝损伤组相比都表现为上升趋势,但MDA的质量摩尔浓度呈现下降趋势,且在高剂量QUE干预情况下差异极显著 (P<0.01)。表明QUE能够抑制APAP造成的氧化性肝损伤。
2.5 QUE对血清中炎症因子的影响
与肝损伤组相比,不同剂量QUE干预组小鼠血清中TNF-α和IL-1β的质量浓度均降低,但IL-10显著升高(图5)。表明QUE不仅能抑制促炎因子的分泌,而且还能提高抑炎因子的表达水平,具有良好的抗炎功效,且与剂量有一定的相 关性。

与对照组相比:**P<0.01;与APAP组相比: #P<0.05、##P<0.01。下同 **P<0.01 vs control group; ##P< 0.01, #P<0.05 vs APAP model group, the same below

2.6 Western-blot分析NF-κB p65和Nrf2的表达变化
通过Western-blot检测QUE和APAP对肝脏中NF-κB p65和Nrf2蛋白表达的影响,探索QUE的护肝通路。由图6-A看出,与对照组相比,APAP诱导的肝损伤引起NF-κB p65蛋白表达明显上升,Nrf2蛋白明显下降。蛋白表达条带的灰度值(图6-B和6-C)可清晰显示,与APAP组相比,高、低剂量的QUE干预显著降低NF-κB p65蛋白的表达水平,显著上调Nrf2蛋白的表达水平,且高剂量QUE组表现为差异极显著。表明QUE发挥护肝功效与其有效抑制NF-κB信号通路,减少促炎症因子的产生,以及促进Nrf2信号通路,增强机体的抗氧化能力密切相关(图7)。

图4 肝组织中SOD、GSH-Px、GSH及MDA水平Fig.4 Level of SOD, GSH-Px, GSH, and MDA in
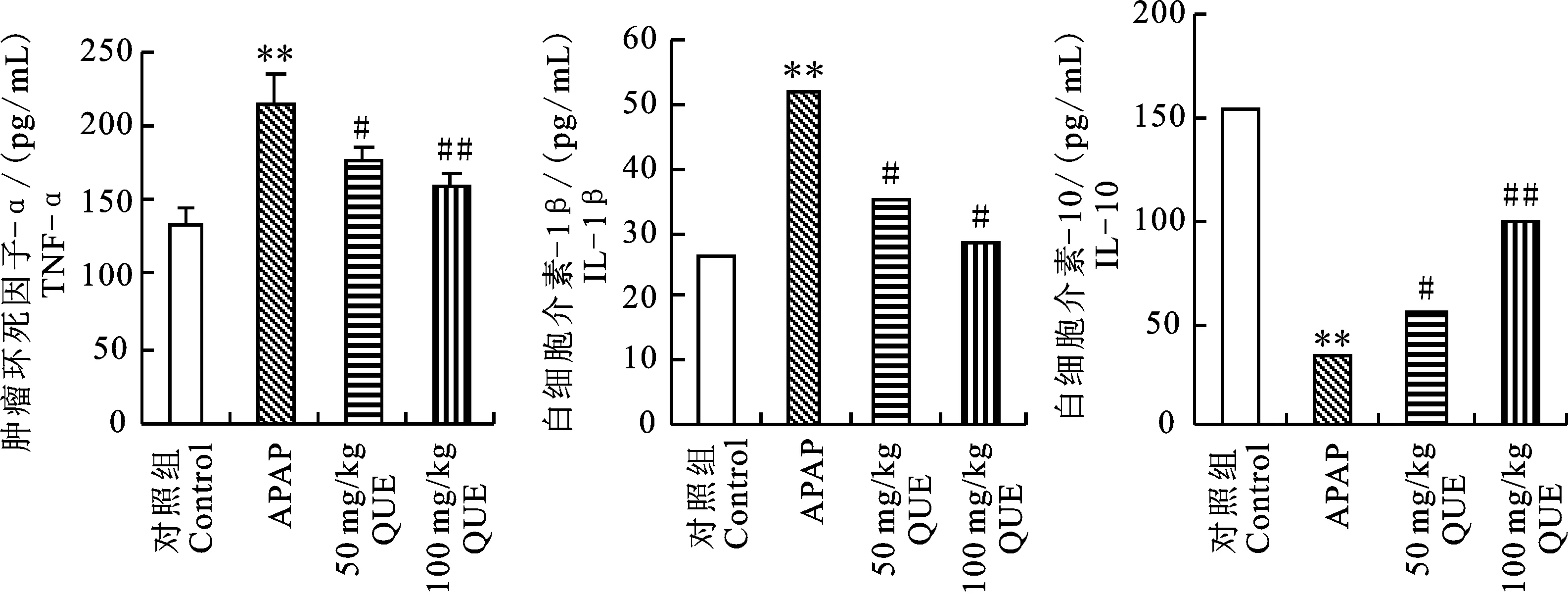
图5 血清中炎症因子的质量浓度 Fig.5 Mass fraction of inflammatory factors in

图6 肝组织中NF-κB p65和Nrf2的蛋白表达水平Fig.6 NF-κB p65 and Nrf2 protein expression levels in
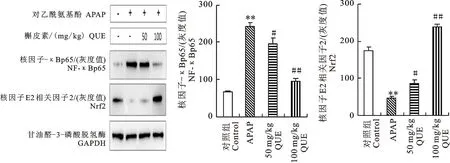
图7 槲皮素缓解APAP造成肝损伤的可能机理图Fig.7 Potential mechanism of quercetin for alleviating liver injury induced by APAP
3 讨 论
血清中ALT和AST活性被公认为是诊断肝脏毒性或肝损伤的重要参考生化指标[18]。本研究中,腹腔注射APAP后,小鼠血清中ALT和AST的活性显著升高,肝组织病理切片检测结果显示肝细胞出现变性甚至坏死以及炎性细胞浸润等,说明本研究中药物性肝损伤小鼠模型建立成功。不同剂量QUE干预处理均能明显降低APAP诱导的血清中ALT和AST的活性,减轻APAP引起的病理组织学变化。表明QUE对APAP造成的药物性肝损伤有一定的保护作用。
APAP过量导致氧化应激是小鼠肝损伤的重要原因[19]。为进一步证实QUE通过降低氧化应激反应而发挥护肝效应。本研究检测了氧化应激相关参数,包括MDA、GSH-Px、GSH和SOD。MDA作为脂质过氧化的重要产物,用来评估氧化应激的程度[20]。抗氧化剂SOD和活性氧清除剂GSH不仅可与自由基、超氧离子等结合,而且可将其催化为无害的物质,使细胞免受氧化损伤[21]。本研究中过量的APAP会通过降低GSH的浓度、降低GSH-Px和SOD的活性,以及增加MDA的质量摩尔浓度引起肝细胞氧化应激,而QUE干预处理明显降低肝组织中SOD、GSH-Px的活性和GSH浓度,抑制MDA质量摩尔浓度的增加,且呈剂量依赖性。表明QUE可通过抗氧化活性减少肝脏的氧化应激损伤。
本研究中,QUE干预处理可显著下调APAP肝损伤组小鼠血清中促炎因子TNF-α、IL-6和IL-1β的质量浓度,显著上调抑炎因子IL-10的表达,且与剂量有一定的相关性。表明QUE可通过抗炎活性来缓解APAP诱导所致的药物性肝损伤。
NF-κB p65和Nrf2作为转录因子,分别在调控炎性细胞因子表达和机体氧化应激反应中起重要作用[22-25]。本研究利用Western-blot分析NF-κB p65、Nrf2转录因子在小鼠肝细胞中的表达情况。结果发现,与对照组相比,APAP可诱导NF-κB p65蛋白的表达水平显著升高,QUE干预处理可使该蛋白表达显著下调,且与剂量有相关性,说明QUE可通过抑制APAP引发的炎症反应缓解肝损伤,从而发挥护肝功效。与对照组相比,APAP组小鼠肝细胞中Nrf2蛋白表达显著下降,而QUE干预组显著上调,表明QUE可通过激活Nrf2通路提高抗氧化因子的表达,发挥抗氧化应激起到护肝效果。由此推测,QUE的护肝功效不仅与激活Nrf2信号通路,加强机体的抗氧化应激水平相关,而且与抑制NF-κB 信号通路,降低促炎因子释放密切相关。
本研究结果证实QUE能有效缓解APAP造成的药物性肝损伤,在对APAP造成的药物性肝损伤中发挥抗炎和抗氧化的护肝机理是分别通过调控NF-κB和Nrf2信号通路来实现,且呈现出量效特点。

