玉米秸秆生物炭和碳骨架的制备及对农田土壤CO2排放的影响
牛淑娟,王朝旭,2①,贺国华,曹 渺,张 浩,覃存立,张 峰,2,崔建国,2,李红艳,2
(1.太原理工大学环境科学与工程学院,山西 晋中 030600;2.山西省市政工程研究生教育创新中心,山西 晋中 030600)
气候变暖和温室气体减排是全球关注的焦点,CO2是主要的温室气体之一,大气中约有5%~20%的CO2源自土壤,农田土壤是重要的CO2源与汇[1]。土壤有机碳是全球碳循环中重要的碳库,不仅对土壤理化性质改善起着至关重要的作用[2],而且影响土壤与大气之间的碳平衡[3]。土壤有机碳由活性和惰性有机碳组成,其中活性有机碳包括溶解性有机碳(dissolved organic carbon,DOC)和易氧化有机碳(readily oxidized organic carbon,ROC)等[4]。虽然活性有机碳占土壤总有机碳的比例较低,但它可以灵敏地反映土壤成分的微小变化,是反映土壤有机碳有效性和土壤质量的早期指标[5]。土壤有机碳变化显著影响大气CO2浓度,因此如何增加土壤有机碳储量,减少土壤有机碳矿化,对缓解全球温室效应意义重大[6]。
生物炭(biochar)是由废弃生物质材料在无氧或缺氧条件下,经高温热解产生的一类高度芳香化、抗分解能力强的富碳物质[7]。生物炭的农田施用是改变土壤碳库平衡、提高土壤碳库容量的有效方法,也是缓解CO2排放的重要途径[8]。然而,目前关于生物炭对土壤有机碳矿化影响方面的研究结论不一致。ZIMMERMAN等[9]研究发现,土壤中添加低温(250和400 ℃)制备的牧草生物炭可促进培养体系有机碳矿化,而添加高温(525和650 ℃)制备的阔叶木材生物炭则抑制有机碳矿化;同时发现,在培养前期(0~90 d),添加生物炭可促进培养体系有机碳矿化,而在培养后期(250~500 d),添加生物炭则抑制有机碳矿化。WHITMAN等[3]研究发现,枫木生物炭的添加,在短期内促进了混合落叶林土壤有机碳矿化(提高20%~30%);而长期条件下则抑制土壤有机碳矿化(降低10%)。他们认为,土壤有机碳的可矿化性与所添加生物炭本身含有的碳有关,这是生物炭影响土壤有机碳矿化的决定因素。LU等[10]研究了玉米秸秆生物炭对砂质土壤有机碳矿化的影响,结果表明,在培养前期(0~11 d),无论施加氮肥与否,生物炭的添加均抑制土壤有机碳矿化(68.3%~83.5%),而在培养后期(11~30 d)抑制程度有所减弱(38.8%~64.9%),笔者认为土壤微生物群落的改变以及生物炭对土壤DOC的吸附,是生物炭抑制土壤有机碳矿化的主要原因。
为探明是否由于生物炭中DOC的矿化导致土壤CO2排放增加,JONES等[11]通过水洗法制得水洗生物炭(即碳骨架),研究发现与未水洗生物炭相比,添加水洗生物炭处理的CO2累积排放量约减少50%。陈威等[12]研究表明,水洗和未水洗玉米秸秆生物炭均能抑制稻田土壤本体有机碳的矿化,且较高添加量(质量比为3%)条件下,水洗生物炭的固碳减排效果更好。王晓洁等[13]研究也表明,与生物炭相比,添加碳骨架处理矿化速率更低,CO2累积排放量更小。生物炭对土壤有机碳矿化的影响,受供试土壤类型、生物炭制备温度和添加量等因素的影响[14-15]。生物炭中活性有机碳(DOC和ROC)在土壤有机碳矿化中的作用如何,尚不十分明确。
因此,笔者分别在400、600和800 ℃条件下自制玉米秸秆生物炭,并通过水洗法剥离活性有机碳,制得碳骨架。在分析6种生物炭基本理化性质的基础上,分别以质量比1%和2%将生物炭添加至土壤,探究其对黄土高原石灰性农田土壤有机碳矿化的影响及其机理。
1 材料与方法
1.1 土壤采集与预处理
实验所用土壤采自山西农业大学校内试验田(37°25′21″ N,112°34′48″ E),土壤类型为褐土。该区域位于黄土高原东南边缘,属暖温带大陆性气候区,以小麦和玉米为主要粮食作物[16]。随机采集多个表层(0~20 cm)土壤,混合后带回实验室,自然风干,去除杂草、碎石等杂物,磨碎并过2 mm孔径筛,充分混匀后备用。土壤pH值(H2O)为8.39±0.02,属石灰性土壤;总有机碳(TOC)、ROC和DOC含量分别为(9.84±0.40)、
(1.57±0.29)和(0.38±0.002) g·kg-1;NH4+-N、NO3--N和NO2--N含量分别为(52.46±0.70)、(16.93±0.90)和
(1.12±0.03) mg·kg-1。
土壤pH值采用pH计〔m(土)∶V(水)=1∶2.5,Mettler Toledo Delta 320〕测定[17];TOC含量采用重铬酸钾容量法-稀释热法测定[18];ROC含量采用高锰酸钾氧化法测定[19-20];DOC含量采用去离子水浸提后再用TOC仪(TOC-VCPH)测定浸提液有机碳含量的方法测定[21-22];NH4+-N、NO3--N和NO2--N含量采用2 mol·L-1KCl溶液浸提后再用比色法测定[23]。
1.2 生物炭和碳骨架的制备
1.2.1生物炭
将玉米秸秆去除杂质,在80 ℃条件下烘干,磨碎后过2 mm孔径筛备用,将其置于石英舟中,然后放入管式电阻炉(SK-G10123K,天津中环)的石英管内,用橡胶塞塞紧两端。升温前预先向石英管中通入高纯氮气20 min(流速为150 mL·min-1);然后以不同的升温速率分别升温至400(5 ℃·min-1)、600(10 ℃·min-1)和800 ℃(10 ℃·min-1),恒温保持2 h;待生物炭温度降至室温后取出,研磨,过0.15 mm孔径筛,即得400、600和800 ℃ 条件下制备的玉米秸秆生物炭,分别记为BC400、BC600和BC800。
1.2.2碳骨架
采用JONES等[11]和LOU等[24]的方法制备碳骨架。分别称取BC400、BC600和BC800各6.0 g于250 mL锥形瓶中,然后加入240 mL去离子水,并用封口膜封口以防水分蒸发;(96±1) ℃条件下水浴加热3 h后,室温振荡24 h(25 ℃,180 r·min-1);最后将生物炭悬浮液过滤(0.45 μm孔径)得到滤渣(即碳骨架,biochar carbon skeleton,记为BS)和浸提液。重复上述操作5次,直至浸提液电导率<50 μS·cm-1。将碳骨架烘干(50 ℃,24 h)后置于干燥器中保存备用。由BC400、BC600和BC800制得的碳骨架分别表示为BS400、BS600和BS800。
1.2.3生物炭和碳骨架特性表征
生物炭和碳骨架的pH值采用pH计测定〔m(炭)∶V(水)=1∶15,g·mL-1,Mettler Toledo Delta 320〕;电导率采用数显电导率仪(雷磁 DDS-307A)测定;生物炭和碳骨架的DOC和ROC含量采用与土壤样品相同的方法测定;C、N、H和O元素含量采用元素分析仪测定(EURO EA3000);比表面积、总孔容和平均孔径采用N2吸附BET法测定(Quadrasorb SI,美国康塔);酸(碱)性含氧官能团含量采用BOEHM滴定法测定[25]。
1.3 室内培养实验
1.3.1CO2排放
采用室内静态土壤培养实验方法,研究玉米秸秆生物炭及其碳骨架对石灰性农田土壤CO2排放的影响。共设置13个处理(3次重复)。将3种生物炭(BC400、BC600和BC800)和3种碳骨架(BS400、BS600和BS800)分别以质量比1%和2%加入土壤,分别记为BC400-1%、BC400-2%、BC600-1%、BC600-2%、BC800-1%、BC800-2%、BS400-1%、BS400-2%、BS600-1%、BS600-2%、BS800-1%和BS800-2%,同时设置不添加任何材料的对照处理(CK)。将生物炭或碳骨架与土壤充分混匀,并装入密闭的培养袋(28 cm×20 cm,PE塑料),每个培养袋装有50 g干土和0.5或1.0 g生物炭/碳骨架。
采用碱液吸收法测定土壤CO2排放[12,26]。首先向培养袋中加入5.0 mL去离子水,并将其与土壤充分混匀,预先在室温(21±2) ℃条件下避光敞口培养7 d。预培养结束后,向每个培养袋中分别均匀喷洒2.7 mL 0.1 mol·L-1(NH4)2SO4溶液(151.2 mg·kg-1干土,以N计),并将其与土壤充分混匀,同时补充去离子水并调整土壤质量含水率为18.5%。将预先装有10 mL NaOH(1 mol·L-1)的塑料杯(高为3.0 cm,底部直径为5.8 cm,顶部直径为7.2 cm)放入密闭培养袋中,在室温(25±2) ℃、避光条件下继续培养50 d。于培养1、2、3、4、5、6、7、9、11、13、15、18、21、25、29、36、43和50 d时,更换装有10 mL NaOH溶液的塑料杯,并使培养袋内外空气充分交换,同时采用称重法补充土壤水分散失量。当天采用滴定法测定NaOH溶液的CO2吸收量,并计算土壤(以干土计)CO2累积排放量(mg·kg-1)和CO2排放速率(mg·kg-1·d-1)。
为排除空气中背景CO2含量的影响,设置以石英砂置换土壤的空白实验。取56 g石英砂(粒径为0.5~1.0 mm,与50 g干土等体积)置于密闭培养袋中,并放入装有10 mL NaOH(1 mol·L-1)的塑料杯,在与土壤处理相同条件下培养。分别测定连续培养1、2、3、4和7 d时NaOH溶液对CO2的吸收量,作为每个采样时间点测得CO2吸收量的背景值。
1.3.2DOC、ROC和TOC含量的动态变化
为研究添加玉米秸秆生物炭或碳骨架条件下,培养体系DOC、ROC和TOC含量的动态变化及其与CO2排放之间的关系,采用与上述CO2排放实验相同的方法进行室内土壤培养。不同之处在于每个培养袋中以300 g干土为基础,并于培养0、1、3、5、7、9、11、13、15、18、21、25、29、36、43、50 d时从每个培养袋中随机采集15.0 g土壤样品,测定其DOC、ROC和TOC含量。同时采用称重法补充去离子水,使土壤质量含水率在整个培养期间保持为18.5%。
1.4 数据分析
根据3次平行实验数据计算平均值和标准偏差,采用Origin 9软件绘图,采用Statistica 6.0软件进行方差分析和多重比较(one-way ANOVA)。
2 结果与分析
2.1 生物炭和碳骨架的基本性质
玉米秸秆生物炭和碳骨架均呈碱性。随着热解温度从400 ℃升高到800 ℃,生物炭pH值从10.32上升到12.37,碳骨架pH值从9.02上升到10.82。将生物炭制成碳骨架后,pH值降低1.19~1.55,且差异显著(P<0.05)。生物炭DOC和ROC含量均显著高于碳骨架(P<0.05)。随着热解温度从400 ℃升高到800 ℃,生物炭DOC含量降低90.33%,ROC含量降低68.97%;碳骨架DOC含量降低92.56%,ROC含量降低67.22%。另外,生物炭C含量增加9.78%,而其N、H和O含量则分别减少7.14%、47.80%和11.76%。与BC400、BC600和BC800相比,BS400、BS600和BC800的C含量分别增加9.95%、16.40%和14.89%,O含量则分别减少18.32%、36.64%和33.61%。
随着热解温度从400 ℃升高到800 ℃,生物炭总酸性含氧官能团含量显著减少0.240 mmol·g-1,而总碱性含氧官能团含量显著增加0.234 mmol·g-1;同样,碳骨架的总酸性含氧官能团含量显著减少0.183 mmol·g-1,而总碱性含氧官能团含量显著增加0.153 mmol·g-1。与生物炭相比,同一热解温度条件下碳骨架的总酸(碱)性含氧官能团含量均显著减少(P<0.05)。生物炭比表面积随着热解温度升高呈先增大后减小变化。BC600和BC800的比表面积(分别为15.14和14.54 m2·g-1)高于BC400(10.26 m2·g-1),且BC600和BC800的总孔容(分别为0.010 8和0.011 7 cm3·g-1)也高于BC400(0.007 7 cm3·g-1),表明在相对较高的热解温度下形成了更多的微孔。另外,与生物炭相比,同一热解温度条件下制得的碳骨架比表面积和总孔容均明显增大(表1)。
表1 不同温度制得生物炭和碳骨架的基本性质
Table 1 Properties of the maize straw-derived biochars and carbon skeletons prepared at different pyrolysis temperatures

材料pH(H2O)1)w(DOC)/(g·kg-1)w(ROC)/(g·kg-1)w(C)/%w(N)/%w(H)/%w(O)/%C/N比值H/C比值 BC40010.32±0.02d6.00±0.01a86.42±5.16a60.8891.6953.97733.43935.920.07 BC60011.19±0.02b2.17±0.01b56.62±8.94c66.0191.6412.33430.00640.230.04 BC80012.37±0.04a0.58±0.01d26.82±5.16e66.8421.5742.07629.50842.470.03 BS4009.02±0.01f1.21±0.01c62.57±1.75b66.9471.5354.20527.31343.610.06 BS60010.00±0.02e0.18±0.003e44.46±1.01d76.8491.6222.51819.01147.380.03 BS80010.82±0.01c0.09±0.001f20.51±0.00f76.7921.7071.91019.59144.990.02 材料O/C比值羧基含量/(mmol·g-1)内酯基含量/(mmol·g-1)酚羟基含量/(mmol·g-1)A/(mmol·g-1)B/(mmol·g-1)比表面积/(m2·g-1)总孔容/(cm3·g-1)平均孔径/nm BC4000.550.327±0.009a0.394±0.008b0.294±0.020b1.015±0.008a0.929±0.036b10.260.007 73.00 BC6000.450.247±0.008b0.346±0.003c0.263±0.005c0.855±0.016c1.143±0.024a15.140.010 82.86 BC8000.440.204±0.005d0.216±0.015e0.355±0.006a0.775±0.009d1.163±0.003a14.540.011 73.23 BS4000.410.227±0.008c0.456±0.017a0.204±0.005d0.887±0.013b0.593±0.005e12.870.015 84.92 BS6000.250.199±0.005d0.312±0.022d0.268±0.022c0.779±0.005d0.686±0.005d20.830.016 13.10 BS8000.260.171±0.010e0.201±0.013e0.331±0.013a0.704±0.013e0.746±0.013c116.160.083 02.86
BC为生物炭,BS为碳骨架,400、600和800为生物炭/碳骨架热解温度,DOC为溶解性有机碳,ROC为易氧化有机碳,A为总酸性含氧官能团含量,B为总碱性含氧官能团含量。同一列数据后英文小写字母不同表示不同材料间某指标差异显著(P<0.05)。1)m(炭)∶V(水)=1∶15。
2.2 碳骨架制备过程中DOC和ROC含量的变化
在以玉米秸秆生物炭制备碳骨架过程中,材料中DOC和ROC含量随浸提次数增加均呈降低趋势(图1)。在浸提之前BC400、BC600和BC800的w(DOC)分别为(6.00±0.01)、(2.17±0.01)和(0.58±0.01) g·kg-1,w(ROC)分别为(86.42±5.16)、(56.62±8.94)和(26.82±5.16) g·kg-1。经过5次热水浸提之后所得碳骨架BS400、BS600和BS800的w(DOC)分别为
(1.21±0.01)、(0.18±0.003)和(0.09±0.001) g·kg-1,减少79.83%、91.71%和84.48%;w(ROC)分别为(62.57±1.75)、(44.46±1.01)和(20.51±0.00) g·kg-1,减少27.60%、21.48%和23.53%。可见,生物炭中DOC更易被热水浸提。
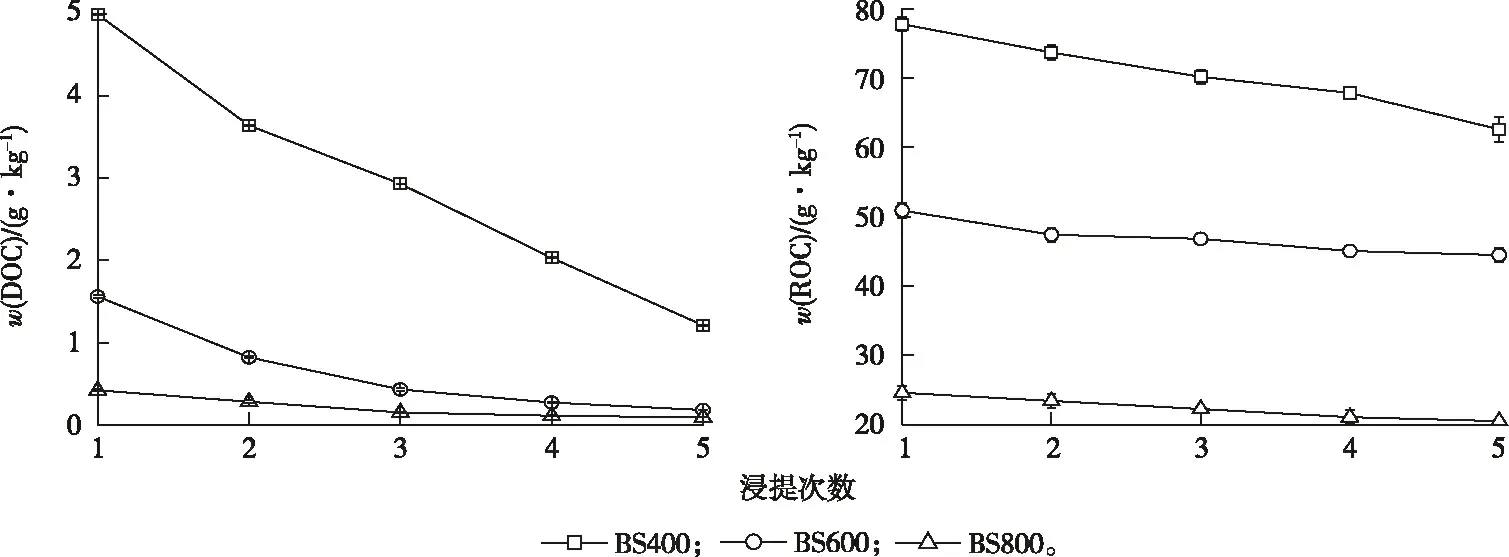
图1 碳骨架制备过程中DOC和ROC含量的动态变化
2.3 CO2累积排放量和排放速率
随着添加材料热解温度的升高,添加生物炭和碳骨架处理的CO2累积排放量均降低(图2)。

50 d时CK、BC400-1%、BC400-2%、BS400-1%和BS400-2%处理间CO2累积排放量的多重比较标记结果为a、bc、b、d和cd(P<0.05); 50 d时CK、BC600-1%、BC600-2%、BS600-1%和BS600-2%处理间CO2累积排放量的多重比较标记结果为a、ab、b、ac和bc(P<0.05); 50 d时CK、BC800-1%、BC800-2%、BS800-1%和BS800-2%处理间CO2累积排放量的多重比较标记结果为a、a、a、bc和ac(P<0.05)。
在培养25 d之后,400、600和800 ℃处理CO2累积排放量呈如下趋势:BC-2%>BC-1%/BS-2%>BS-1%;在此期间,BC400-2%、BC400-1%、BS400-2%和BS400-1%处理CO2累积排放量(以CO2质量计,下同)分别为4 048.00~5 659.14、4 034.57~5 512.13、3 600.66~5 064.58 和3 443.89~4 921.66 mg·kg-1,均高于CK(3 341.49~4 273.55 mg·kg-1);BC600-2%、BC600-1%、BS600-2%和BS600-1%处理CO2累积排放量分别为3 696.31~5 044.89、3 554.05~4 691.51、3 397.46~4 910.25和3 230.22~4 429.81 mg·kg-1,BC600-2%和BC600-1%处理CO2累积排放量高于CK,而BS600-2%和BS600-1%处理CO2累积排放量与CK差别不大;BC800-2%、BC800-1%、BS800-2%和BS800-1%处理CO2累积排放量分别为3 345.94~4 403.95、3 388.45~4 399.58、3 084.96~4 177.69和2 673.79~3 926.49 mg·kg-1,BC800-2%和BC800-1%处理CO2累积排放量略高于CK,而BS800-2%和BS800-1%处理CO2累积排放量则低于CK。
就400 ℃处理而言,50 d时CO2累积排放量表现为BC400-2%>BC400-1%>BS400-2%>BS400-1%>CK;所有处理均显著高于CK,BC400-1%和BC400-2%以及BS400-1%和BS400-2%之间均无显著差异,而BC400-1%和BC400-2%则显著高于BS400-1%(P<0.05)。就600 ℃处理而言,50 d时CO2累积排放量表现为BC600-2%>BS600-2%>BC600-1%>BS600-1%>CK;BC600-2%和BS600-2%显著高于CK,而BC600-1%和BS600-1%与CK间没有显著差异,BC600-2%显著高于BS600-1%(P<0.05)。就800 ℃处理而言,50 d时CO2累积排放量表现为BC800-2%>BC800-1%>CK>BS800-2%>BS800-1%;除BS800-1%显著低于CK外,其他处理与CK之间没有显著差异,同时BC800-1%和BC800-2%显著高于BS800-1%(P<0.05)。
与CO2累积排放量结果一致,随着添加材料热解温度升高,CO2排放速率(以CO2质量计,下同)呈降低趋势(图2)。在培养过程中,CO2排放速率峰值出现在1 d时,然后急剧下降,至25 d时,CO2排放速率下降79.12%~84.81%;25 d之后,CO2排放速率呈缓慢下降趋势。
2.4 培养体系DOC含量的动态变化
玉米秸秆生物炭和碳骨架的添加均增加土壤DOC含量。培养开始时,添加生物炭处理DOC含量比CK高16.27%~39.09%;而添加碳骨架处理DOC含量比CK高6.57%~23.52%。在整个培养过程中,各处理DOC含量呈降低趋势(降低87.90%~89.18%);尤其在前25 d,DOC含量急剧降低,与培养初始相比,25 d时各处理DOC含量降低82.21%~84.67%。在整个培养过程中,BC-2%处理DOC含量(400、600和800 ℃处理分别为38.51~341.85、35.61~318.89和35.59~294.20 mg·kg-1)高于BS-1%(400、600和800 ℃处理分别为32.63~300.92、31.66~276.95和29.83~261.93 mg·kg-1),且高于CK(28.82~245.78 mg·kg-1),呈BC-2%>BC-1%/BS-2%>BS-1%>CK趋势。培养50 d时,400、600和800 ℃处理DOC含量均呈BC-2%>BC-1%>BS-2%>BS-1%>CK趋势,且差异显著(P<0.05)(图3)。

图3 培养过程中土壤DOC含量的动态变化
2.5 培养体系ROC含量的动态变化
玉米秸秆生物炭和碳骨架的添加均增加土壤ROC含量。培养初始,添加生物炭处理ROC含量比CK高62.16%~130.77%;而添加碳骨架处理ROC含量比CK高54.05%~107.79%。在整个培养过程中,各处理ROC含量先降低后趋于平稳,但降幅(19.29%~38.49%)比DOC小。与培养初始相比,25 d时各处理ROC含量降低16.58%~32.57%,随后ROC含量缓慢降低,直至培养结束。添加生物炭处理ROC含量(1.88~3.51 g·kg-1)高于同一热解温度、同一添加量条件下添加碳骨架处理(1.44~3.16 g·kg-1),且均高于CK(1.17~1.52 g·kg-1)。培养50 d时,400和600 ℃处理ROC含量呈BC-2%>BS-2%>BC-1%>BS-1%>CK趋势,而800 ℃处理ROC含量则呈BC-2%>BC-1%/BS-2%>BS-1%>CK趋势,且差异显著(P<0.05)(图4)。

图4 培养过程中土壤ROC含量的动态变化
2.6 培养体系TOC含量的变化
玉米秸秆生物炭和碳骨架的添加均提高土壤TOC含量,且随添加量的增加而增大,随添加材料热解温度的升高而减小,其中BC400处理TOC含量最高。培养初始,添加生物炭处理TOC含量比CK高21.50%~49.22%,而添加碳骨架处理TOC含量比CK高18.91%~39.12%。培养结束时,同一热解温度、同一添加量条件下,添加生物炭处理TOC含量(9.02~11.94 g·kg-1)高于添加碳骨架处理(8.86~11.36 g·kg-1),且均高于CK(8.27 g·kg-1)(表2)。
2.7 CO2排放与DOC和ROC含量的关系
线性回归分析表明,培养体系CO2累积排放量与DOC含量显著相关(P<0.01),且DOC含量对CO2累积排放量的解释程度较高(生物炭:81%;碳骨架:84%)(图5);CO2排放速率与DOC含量也呈显著相关(P<0.01),且DOC含量对CO2排放速率的解释程度分别达到92%(生物炭)和82%(碳骨架)(图5)。另一方面,就添加生物炭处理而言,培养体系CO2累积排放量与ROC含量之间不存在显著相关关系(R2=0.03,P=0.04)(图6);而就添加碳骨架处理而言,培养体系CO2累积排放量与ROC含量之间存在显著相关关系(R2=0.20,P<0.01),但ROC含量仅能解释CO2累积排放量变化的20%(图6)。培养体系CO2排放速率与ROC含量显著相关(生物炭:R2=0.10,P<0.01;碳骨架:R2=0.15,P<0.01)(图6),但ROC含量分别仅能解释CO2排放速率变化的10%(生物炭)和15%(碳骨架)。综上所述,在添加生物炭或碳骨架处理中,培养体系DOC含量对CO2排放变化的解释程度更高。因此,DOC与ROC均是影响黄土高原石灰性农田土壤CO2排放的重要因素,但相比较而言,DOC的影响更加显著。
表2 培养前后土壤TOC含量的变化
Table 2 Changes of soil TOC content before and after incubation

处理w(TOC)/(g·kg-1)培养初始培养结束减少值 CK10.27±0.128.27±0.182.00 BC400-1%14.26±0.0910.96±0.203.30 BC400-2%15.32±0.2111.94±0.053.38 BS400-1%13.81±0.4010.77±0.403.04 BS400-2%14.28±0.2911.36±0.202.92 BC600-1%13.17±0.219.76±0.203.41 BC600-2%14.23±0.1210.83±0.173.40 BS600-1%12.32±0.269.58±0.402.74 BS600-2%13.57±0.0810.51±0.233.06 BC800-1%12.48±0.129.02±0.163.46 BC800-2%13.17±0.409.63±0.093.54 BS800-1%12.21±0.408.86±0.143.35 BS800-2%12.85±0.299.58±0.003.27
3 讨论
3.1 热解温度对生物炭和碳骨架基本性质的影响
笔者研究表明,随着热解温度的升高,添加生物炭和碳骨架处理DOC和ROC含量均显著降低。王晓洁等[13]研究也发现,当热解温度从300 ℃升高到800 ℃时,甘蔗渣生物炭处理DOC含量从1.38 mg·kg-1降至0.40 mg·kg-1,降低71.01%。与同一温度下制得的生物炭处理相比,400、600和800 ℃ 条件下制得的碳骨架DOC含量分别降低79.83%、91.71%和84.48%,ROC含量则分别降低27.60%、21.48%和23.53%,其他研究[13]对此现象也有报道。笔者研究中,生物炭和碳骨架的热解温度越高,其C含量就越高,而H/C比值和O/C比值越低,表明高温制得的生物炭和碳骨架具有较高的芳香性和较弱的极性,此现象与KEILUWEIT等[27]的研究结果一致。

BC为生物炭,BS为碳骨架。

BC为生物炭,BS为碳骨架。
笔者研究发现,与玉米秸秆生物炭相比,同一热解温度条件下制得的碳骨架C含量增加9.95%~16.40%,王晓洁等[13]对甘蔗渣生物炭和碳骨架的研究也得出类似结果。另外,高温(600和800 ℃)制得的玉米秸秆生物炭比表面积大于低温(400 ℃)生物炭,主要是由于随着热解温度升高,生物质中半纤维素、纤维素和木质素相继分解,在生物炭内部形成大量孔隙结构[28]。CHUN等[29]研究也表明,当热解温度从300 ℃增至700 ℃时,小麦秸秆生物炭比表面积从116 m2·g-1增至363 m2·g-1。笔者研究表明,与生物炭相比,同一热解温度条件下制得的碳骨架比表面积和总孔容均明显增大。这是由于在热解过程中,生物炭产生的孔隙被灰分占据,阻止了比表面积测定时N2的进入,而采用水洗法制备碳骨架过程中,灰分被大量清除。因此,碳骨架比表面积和总孔容显著增大[30]。
3.2 生物炭和碳骨架特性对CO2排放的影响
笔者研究中,土壤CO2排放速率在前25 d时较高,随后缓慢降低,最后趋于平稳,该结果与KONG等[31]的研究结果一致,这主要是因为培养初期土壤活性有机碳快速矿化。生物炭在培养前期以易分解有机碳的矿化作用为主,矿化速率较快,而后期以难分解有机碳的矿化作用为主,矿化速率较慢[32]。
同一添加量(质量比为1%或2%)条件下,添加材料(生物炭或碳骨架)的热解温度越高,CO2累积排放量就越低。此现象主要是由于低温制得的生物质材料中N、H和O含量较高,脂肪族结构发达,易分解有机碳含量较高,这些物质对土壤有机碳矿化贡献较大,易被土壤微生物利用,使土壤微生物活性增强,从而促进土壤CO2排放[33];而高温制得的生物质材料中C含量较高,C/N比值较大,芳香族结构发达,不易矿化,从而有利于土壤中碳的储存[34]。另一方面,同一添加量条件下,与同一热解温度制得的生物炭相比,碳骨架处理CO2累积排放量和排放速率较低。陈威等[12]研究表明,在180 d培养期内,添加未水洗生物炭处理CO2累积释放量(4 110.86 mg·kg-1)高于水洗生物炭(3 333.58 mg·kg-1);这是由于与生物炭相比,碳骨架DOC和ROC含量明显下降,芳香烃碳聚合程度提高,性质稳定,可生化性差[13,35]。笔者研究也发现,400、600和800 ℃制得的碳骨架DOC和ROC含量较生物炭显著降低(P<0.05)。与碳骨架相比,生物炭pH值较高,将其添加至土壤更易使土壤中易分解有机碳的弱酸性官能团去质子化,从而增加易分解有机碳的亲水性和溶解性,以及微生物可利用性[36]。另外,碳骨架具有更大的比表面积,孔隙结构更发达,可以吸附土壤中更多的有机质,从而降低土壤有机碳被微生物利用的可能性[37]。
3.3 CO2排放与培养体系DOC和ROC含量的关系
笔者研究表明,在添加生物炭或碳骨架处理中,CO2排放速率与DOC和ROC含量均呈显著相关(P<0.01),但DOC含量对土壤CO2排放变化的解释程度更高,表明DOC与ROC均是影响黄土高原石灰性农田土壤CO2排放的重要因素,但相比较而言,DOC的影响更加显著。土壤CO2排放主要源于DOC的分解。
作为土壤改良剂,生物炭可增加土壤DOC含量。DOC是土壤碳库中活性较高的组分,其中10%~40%的组分能够直接被微生物分解利用[38]。JONES等[11]研究认为,生物炭释放的DOC使土壤呼吸速率增加,他们发现DOC很容易从生物炭中释放出来,并被土壤微生物迅速矿化。LUO等[26]研究了不同花生壳生物炭添加量(质量比分别为0%、0.1%、1%和3%)对沿海湿地土壤有机碳矿化的影响,结果表明,生物炭的添加促进了土壤CO2累积排放量,土壤DOC含量与有机碳累积矿化量之间呈线性正相关关系,且生物炭DOC含量(4 129 mg·kg-1)远高于土壤(31.6 mg·kg-1),因此生物炭中DOC对土壤有机碳矿化有重要贡献。DEMISIE等[5]研究了橡木和竹子生物炭对红壤有机碳组分的影响,结果表明,随着生物炭添加量增加,土壤DOC含量增加,从而促进了土壤微生物活性,以及土壤有机质和活性有机碳的分解。李彬彬等[39]研究了秸秆还田配施氮肥对潮土CO2排放的影响,结果表明CO2排放速率和累积排放量与土壤DOC含量显著相关。
用水提取土壤DOC的过程相对温和,而用KMnO4氧化法提取土壤ROC的过程则相对困难。因此,DOC被认为是最活跃和微生物最易直接利用的底物[40]。DEMISIE等[5]研究发现,将竹子生物炭按不同比例加入红壤中,经327 d培养后,与对照相比,添加生物炭处理DOC/TOC降低的百分比大于ROC/TOC降低的百分比,表明DOC更易被微生物利用,而ROC则较难被微生物利用。WANG等[41]对采自澳大利亚3个州的30个土壤样本的分析表明,土壤DOC和ROC含量均与土壤呼吸速率密切相关,但与DOC相比,ROC对土壤CO2排放变化的解释程度较低。张杰等[42]研究也表明,ROC对土壤CO2累积排放量的影响主要表现在间接影响上,对土壤CO2累积排放量的直接影响很小,且不显著。SHENG等[43]研究了土地利用类型对我国亚热带地区亚表层土中活性有机碳矿化的影响,发现与ROC相比,DOC含量的变化更能直接反映土壤有机碳状态,是土壤质量变化的重要指标。
4 结论
(1)随着热解温度的升高,玉米秸秆生物炭和碳骨架的pH值、总碱性含氧官能团含量显著增大,而DOC、ROC和总酸性含氧官能团含量则显著减小(P<0.05)。与生物炭相比,同一热解温度条件下制得的碳骨架C含量和比表面积增大,而其pH值,DOC、ROC和总酸(碱)性含氧官能团含量则显著减小(P<0.05)。
(2)随着添加材料(生物炭或碳骨架)热解温度的升高,各处理CO2累积排放量呈降低趋势,且添加生物炭处理CO2累积排放量高于添加碳骨架处理,尤其是BC-2%处理CO2累积排放量显著高于BS-1%处理(P<0.05)。
(3)在整个培养过程中,培养体系DOC和ROC含量均呈降低趋势,但DOC含量降幅(87.90%~89.18%)大于ROC含量(19.29%~38.49%);培养过程中400、600和800 ℃处理DOC和ROC含量均呈BC-2%>BC-1%/BS-2%>BS-1%>CK趋势。
(4)在添加生物炭或碳骨架处理中,与ROC相比,DOC含量对CO2累积排放量和排放速率变化的解释程度均较高,且达到显著水平(P<0.01);DOC和ROC含量均是影响黄土高原石灰性农田土壤CO2排放的重要因素,但相比较而言,DOC含量的影响更加显著。

