探究分子的性质
在学习了分子的性质后,同学们知道分子是保持物质化学性质的最小粒子。分子的质量和体积都很小,分子间有间隔,分子是不断运动的。为了更加深刻地认识分子的性质,同学们在老师指导下分小组探究分子的性质。
一、分子间有间隔
第一小组的同学用两支医用注射器吸入等体积的空气和水,用手堵住注射器末端的出口,慢慢推动活塞(如图1)。吸入空气的注射器推起来很容易,吸入水的注射器推起来很费力。同学们得出结论:分子间有间隔,气体分子间间隔较大易被压缩,液体分子间间隔较小不易被压缩。
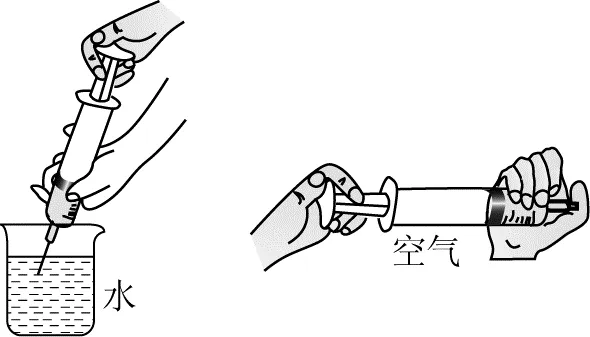
图1
第二小组的同学把吸入20 mL空气的注射器的末端出口用蜡油封住,然后把注射器放入冰水中,观察到注射器的活塞向里移动了一点,注射器中的气体体积缩小;把注射器从冰水中取出在室温下放置一段时间,注射器活塞又恢复到原来的位置。得出结论:物体的热胀冷缩是由分子间的间隔受热增大、遇冷缩小引起的。
第三小组的同学取一块蔗糖放入杯中,然后加入一定量的水并标记水面位置,观察现象(如图2)。同学们观察到蔗糖逐渐溶解最后消失,液面下降。蔗糖溶于水证明分子是不断运动的,液面下降证明分子间有间隔。
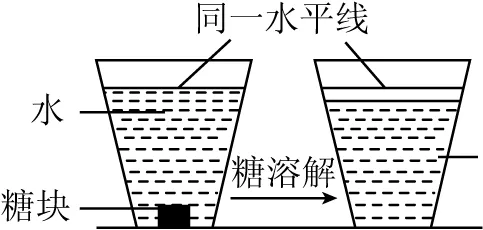
图2
二、分子是不断运动的
同学们将“探究分子运动演示实验”(如图3)改进后再进行实验。第一小组的同学用如图4所示装置进行实验,把浸有酚酞的棉花团绑在树形的铁丝上制成铁树。在玻璃片上滴几滴浓氨水,罩上大烧杯,观察现象。观察到浸有酚酞的棉花团从下到上逐渐变红,说明分子是不断运动的。

图3
第二小组的同学用如图5所示装置进行实验。把滴有酚酞的滤纸条贴在试管内壁上,在剪掉一端的塑料眼药水瓶内滴几滴浓氨水放在试管口,并塞好橡胶塞,观察现象。一段时间后,观察到滤纸条上的酚酞由下到上逐渐变红,说明分子是不断运动的。这个实验便于回收浓氨水,减少了空气污染。

图4
第三小组的同学用如图6所示装置进行实验,把盛有浓氨水和酚酞溶液的两支试管用导管连接起来,做成两套装置,把其中一支盛有浓氨水的试管放入热水中,观察现象。观察到C 试管中的酚酞溶液先变红,B 试管中的酚酞溶液后变红,说明分子是不断运动的,温度越高,分子运动越快。
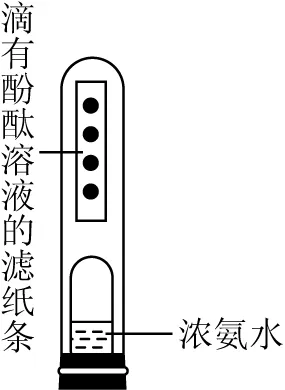
图5

图6
老师评价了同学们实验方案的优点和不足,指出了实验过程中存在的操作不规范、实验现象描述不准确等问题。为了激发学生们的学习兴趣,老师给同学们演示了“二氧化氮的扩散”和“空杯生烟”两个实验。“二氧化氮的扩散”实验如图7,在盛有二氧化氮的集气瓶上方倒扣一个空集气瓶,观察到红棕色的二氧化氮气体不断扩散,最后两瓶中气体颜色一致,说明分子是不断运动的。
“空杯生烟”实验如图8,把内壁涂有浓氨水和浓盐酸的两个集气瓶盖好毛玻璃片倒扣在一起,随后抽开毛玻璃片,可以看到有白烟生成。浓盐酸挥发出的氯化氢气体和浓氨水挥发出的氨气接触后反应生成了白色固体氯化铵,于是我们就看到瓶中产生白烟了。从微观上说,是由于氯化氢分子和氨分子不断运动接触后发生反应,生成了白色固体氯化铵。

图7
由于二氧化氮气体有毒,氯化氢气体和氨气有刺激性气味,因此在实验过程中会有少量气体泄漏出来污染空气。为减少空气污染,可以用如图9 所示装置进行实验。在做“二氧化氮的扩散”实验时,在A 瓶中收集二氧化氮。把与K1端连接的导管伸入能吸收二氧化氮的氢氧化钠溶液中,防止二氧化氮气体逸出污染空气。由于二氧化氮的密度比空气大,打开K2,从K2端通入二氧化氮气体,当与K1端相连的导管中出现红棕色气体时,说明A 瓶中的二氧化氮气体已经收集满。关闭K1和K2,打开K3,观察现象。可以看到A 瓶中的红粽色气体沿着导管进入B 瓶,一段时间后A、B瓶中气体的颜色一致。A瓶中的二氧化氮分子不断运动到B瓶中,产生了上述现象。
利用这一装置还可以做“空杯生烟”实验。关闭K3,在B 瓶中滴入1 滴~2 滴浓盐酸,并迅速塞好与K3相连的胶塞,浓盐酸挥发出来的氯化氢气体充满B 瓶。把与K2相连的导管末端通入滴有酚酞的水中,吸收A 瓶逸出的氨气,防止污染空气。由于氨气极易溶于水,故可以用水吸收。打开K1和K2,并从K1端通入氨气,由于氨气的密度比空气小,因此当酚酞溶液变红时,说明A 瓶中氨气已收集满。关闭K1和K2,打开K3,观察到B 瓶中先产生白烟,A 瓶中后产生白烟。白烟是氯化氢气体与氨气相遇反应生成的白色固体氯化铵的小颗粒。这个实验说明分子是不断运动的。相同条件下,相对分子质量越小,分子运动越快。氨气的相对分子质量为17,氯化氢气体的相对分子质量为35.5,氨分子运动较快,所以B瓶中先产生白烟,A瓶中后产生白烟。

图8
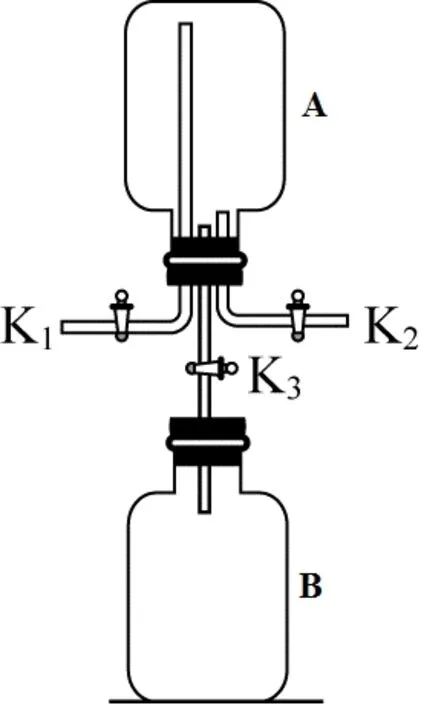
图9
三、分子的质量和体积都很小
蔗糖溶于水看不到蔗糖,是由于蔗糖分子与水分子均匀混合了,同时也说明分子很小。1个水分子的质量约为3×10-26kg,一滴水中约含有1.67×1021个水分子,这些都说明分子的质量和体积都很小。
通过探究分子的性质,同学们体验到了实验探究的乐趣,加深了对分子性质的理解。

