纳米TiO2暴露对湿地植物大薸和泽泻光合特征影响的差异
曾强,李辉,侯磊
西南林业大学生态与环境学院,昆明 650224
纳米TiO2因具有良好的催化活性、吸附活性和抗紫外线吸收等特性,被广泛应用于污水处理、工业合成催化和防晒化妆品等领域[1]。在纳米TiO2的生产、使用和废弃过程中不可避免地被释放到环境中,使其成为一种新型污染物[2-5]。纳米TiO2可能会通过各种途径进入到水体和土壤环境中,再通过水循环进入到植物体内,由此引起的植物生长发育、生理生态和营养吸收等方面的效应值得探索。
近年来,有不少研究报道了纳米TiO2对植物的效应,研究对象包括农作物、草本植物、藻类及少量湿地植物,涉及对植物种子萌发、幼苗生长、植物生理特征(如细胞结构完整性、光合色素、抗氧化酶活性)、营养利用(如氮代谢、磷吸收)等多方面的影响[6-13]。其中,针对纳米TiO2对植物光合作用影响的报道结果差异较大。一方面,纳米TiO2显示出了对植物光合作用的促进效应。如Yang等[12]发现,在土壤中施加2.5~40 g·kg-1纳米TiO2,不仅增强了菠菜的光合作用,而且还提高了根的固氮能力。在对油菜的胁迫实验中,纳米TiO2未显示出植物毒性,并促进了油菜的光合作用,使得油菜产量增加[14]。另一方面,研究也报道了纳米TiO2对植物光合作用的抑制效应,例如,Ayyaraju等[15]将小球藻在浓度为0、0.1、1、5、10和20 mg·L-1的纳米TiO2中暴露96 h之后,不仅光合活性受到显著抑制,而且出现了细胞损伤,还进一步影响了小球藻的基因表达。Dias等[16]将小麦幼苗于浓度为0、5、50和150 mg·L-1的纳米TiO2溶液中暴露20 d,小麦的叶绿素a含量、PSⅡ的最大有效效率、净光合速率、蒸腾速率、气孔导度、胞间CO2浓度和淀粉含量都显著降低。纵览当前的研究报道,纳米TiO2对于植物光合作用的促进和抑制作用都有报道,但是针对纳米TiO2影响湿地植物光合作用的研究鲜有开展,湿地植物因生境的差异可能表现出与其他植物不同的特征,因此这方面有待深入研究。
大薸(Pistiastratiotes)和泽泻(Alismaplantago-aquatica)分别作为湿地植物中的浮水和挺水植物的代表,因生活型的差异,对于水体环境中人工纳米颗粒浓度变化的响应可能有区别,故选为研究对象。通过水培实验,评估了一种金红石型纳米TiO2暴露对2种湿地植物生物量变化及光合活性影响的差异,并讨论了可能的机制。该研究结果可为准确评估纳米TiO2的湿地植物生物效应提供科学依据。
1 材料与方法 (Materials and methods)
1.1 实验材料
纳米TiO2购于上海水田科技有限公司,纯度>99%,为金红石型,通过Tecnai G2 F20透射电镜(TEM)(美国FEI公司)表征,并用Nano Measure 1.2软件测得平均粒径为(42.6±5) nm。
实验使用的浮水植物大薸和挺水植物泽泻购于昆明泛亚花卉基地,挑选长势相近的植物进行实验,植物培养为水培方式,培养液为0.5倍浓度的Hoagland溶液,其中,大量元素浓度为:2.5 mmol·L-1Ca(NO3)2,1.0 mmol·L-1KH2PO4,2.5 mmol·L-1KNO3,1.0 mmol·L-1MgSO4和0.5 mmol·L-1NaCl;微量元素浓度为:23.1 μmol·L-1B,4.6 μmol·L-1Mn,0.38 μmol·L-1Zn,0.16 μmol·L-1Cu,0.052 μmol·L-1Mo和8.95 μmol·L-1Fe (EDTA-Fe)[17],所有化学试剂均为分析纯,购于广东光华科技有限公司。在可控温控湿的温室大棚中预培养7 d备用。
1.2 实验方法
在营养液中加入纳米TiO2粉末,使用JY99-ⅡDN超声波细胞粉碎仪(中国宁波新芝生物科技有限公司)超声30 min,制成悬浮液。基于文献报道的纳米TiO2产生植物效应的浓度范围(0.01~1 000 mg·L-1)[8-9,18],选择纳米TiO2中间浓度进行水培实验。营养液中纳米TiO2的浓度(以TiO2的质量浓度计)分别设置为10、30和250 mg·L-1,同时设置空白实验组(0 mg·L-1),每个浓度设置5个平行(5棵植物)。将制备好的纳米TiO2悬浮液装于聚乙烯塑料桶中,每个桶放置一棵植物,大薸浮于水面,泽泻用海绵固定,标记液面位置,同时用黑色卡纸对根部进行遮光处理。胁迫实验期间,每天补充去离子水至刻度线,并搅拌悬浮液。暴露实验开始前需要测定每棵植物的生物量,整个实验过程均在温室大棚中进行。
1.3 光合参数测定
2017年9月,使用Li-6400光合仪(美国LI-COR公司)进行光合参数的测定,在纳米TiO2暴露的第14天,选择天气晴朗的早上9:00—11:00测定,使用红蓝光源叶室并设定光强为1 000 μmol·m-2·s-1。测定指标包括净光合速率(Pn,μmol·m-2·s-1)、气孔导度(Gs,mmol·m-2·s-1)、胞间CO2浓度(ci,μmol·mol-1)、蒸腾速率(Tr,mmol·m-2·s-1)和ci/ca(ca为空气中CO2浓度,μmol·mol-1),并计算气孔限制值(Ls=1-ci/ca)。
1.4 植物生物量及Ti浓度测定
光合参数测定完成后,将植物收割,根部用去离子水清洗3遍后擦干。测定每棵植物的生物量,用处理前后植物生物量差值除以处理前该植物的生物量计算得到每个浓度处理组的相对生物量变化率。将大薸按照根、叶和芽,泽泻按照根、茎和叶的方式进行分割,记录每部分的重量,于105 ℃杀青30 min,然后在60 ℃烘干,研磨后备用。分别称取0.15 g和0.30 g研磨后的大薸和泽泻植物样品,采用H2SO4-H2O2方法消煮[19],并用710型ICP-OES仪器(美国Agilent公司)测定消煮液中Ti元素浓度(mg·L-1),并折算为鲜植物组织中的Ti浓度(mg·kg-1)。分别运用公式(1)和(2)计算大薸和泽泻对Ti元素的生物富集系数(bioaccumulation factors, BAFs)和转移系数(transportation factors, TFs)。
BAFs=植物体中Ti元素质量(mg)/营养液中Ti元素质量(mg)
(1)
TFs=植物地上部分Ti元素质量(mg)/植物根中Ti元素质量(mg)
(2)
其中,大薸和泽泻的植物地上部位Ti元素质量分别为叶和芽、茎和叶中Ti元素的质量和。
1.5 数据统计与分析
采用分析软件SPSS 22.0对实验数据进行统计分析,采用单因素方差分析(ANOVA)进行显著性差异检验,统计量显著性水平为P<0.05认为差异显著。利用SigmaPlot 10.0和Origin 2017软件绘图。
2 结果(Results)
2.1 纳米TiO2暴露对大薸和泽泻生物量的影响
纳米TiO2暴露浓度对大薸和泽泻相对生物量变化率的影响如图1所示。由图1可知,大薸和泽泻的相对生物量变化率随纳米TiO2浓度的增加总体呈现上升趋势,与对照组相比,纳米TiO2暴露后,大薸相对生物量变化率增加了5.08%~17.58%,而泽泻增加了2.41%~8.15%,并在250 mg·L-1处理组分别检测到大薸和泽泻相对生物量变化率的最大值64.97%(P<0.05)和18.18%(P<0.05),分别是对照组变化率的1.37倍和1.81倍。从对照组来看,大薸相对生物量变化率是泽泻的4.72倍,纳米TiO2暴露后,2种植物相对生物量变化率的倍数关系无显著变化。

图1 不同浓度纳米TiO2对大薸和泽泻相对生物量变化率的影响注:不同字母表示与对照组相比具有显著性差异(P<0.05)。Fig. 1 Effect of different concentrations of TiO2 nanoparticle on the biomass change rate of Pistia stratiotes and Alisma plantago-aquaticaNote: Different letters indicate that there are significant differences (P<0.05), compared with the control.
2.2 Ti在大薸和泽泻不同部位的分布
Ti元素在植物不同部位的分布随纳米TiO2暴露浓度的变化规律如图2所示。由图2可知,Ti元素在大薸和泽泻各个部位中的浓度随着纳米TiO2浓度的上升而上升,与对照组相比,均显著增加(P<0.05),并在最高浓度250 mg·L-1处理组达到最大值,Ti元素在2种植物根中的浓度均最高。2种植物相比,大薸各部位的Ti浓度均随TiO2浓度的升高而升高,泽泻仅有根表现出以上规律。经过纳米TiO2暴露后,大薸的根和叶中Ti元素浓度均高于泽泻的,其中,根中Ti元素浓度是泽泻根中Ti浓度的4.20倍~4.95倍。此外,2种植物的对照组中,各个部位均检测到了Ti元素,其中,泽泻根和叶中浓度分别是大薸的3.57倍和7.77倍。
不同浓度纳米TiO2暴露条件下,2种植物对Ti元素的生物富集系数和转移系数变化规律如表1所示。由表1可知,同一处理浓度,泽泻表现出比大薸更高的生物富集系数,且随着纳米TiO2浓度的增加,2种植物对Ti元素的生物富集系数均减小。此外,2种植物对Ti元素的转移系数也表现出不同规律,低浓度条件下(10 mg·L-1),泽泻的转移系数大于大薸,但纳米TiO2浓度升高后,大薸的转移系数无显著变化(P>0.05),而泽泻的转移系数明显下降(P<0.05)。

表1 大薸和泽泻对Ti的生物富集系数和转移系数随纳米TiO2暴露浓度的变化Table 1 Changes of bioaccumulation factors and transportation factors of Ti element for Pistia stratiotes and Alisma plantago-aquatica in different exposure concentrations of TiO2 nanoparticles
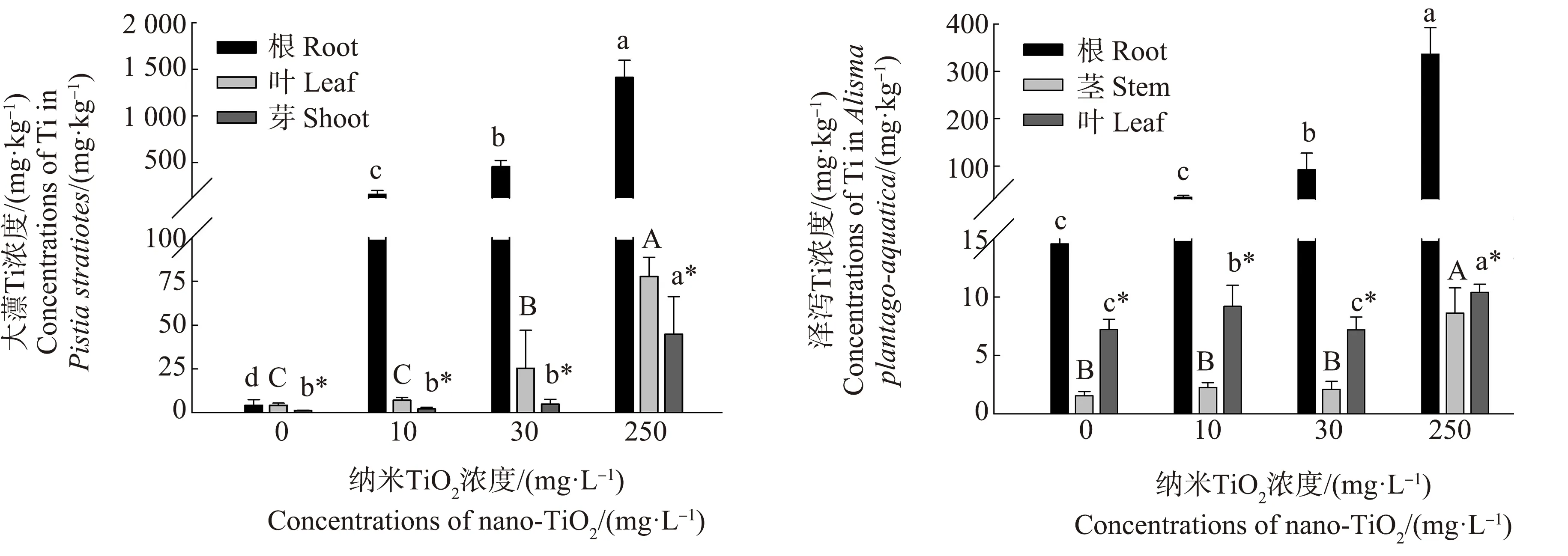
图2 Ti在大薸和泽泻各部位的浓度分布注:不同字母表示与对照组相比具有显著性差异(P<0.05)。Fig. 2 Distribution of Ti concentration in each part of Pistia stratiotes and Alisma plantago-aquaticaNote: Different letters indicate that there are significant differences (P<0.05), compared with the control.
2.3 纳米TiO2暴露对大薸和泽泻的光合参数的影响
纳米TiO2暴露对2种植物光合参数的影响如图3所示。由图3可知,随着纳米TiO2暴露浓度的上升,与对照组相比,2种植物的净光合速率均表现出低浓度抑制、高浓度促进的规律,但变化趋势不显著(P>0.05)。与净光合速率相关的其他指标,2种植物呈现出类似的变化规律,随着纳米TiO2浓度升高,气孔导度与净光合速率呈现出相同的变化规律,胞间CO2浓度下降,蒸腾速率增大,除蒸腾速率外,其余指标的变化均不显著(P>0.05)。对比2种植物的各项参数发现,挺水植物泽泻的净光合速率更大,是大薸的1.58倍~2.04倍,对应的胞间CO2浓度更低,气孔导度更大,此外,泽泻的蒸腾速率是大薸的582.14倍~932.65倍。同时,随着纳米TiO2浓度的升高,大薸的气孔限制值显著增加(P<0.05),而泽泻的无显著变化(P>0.05)。
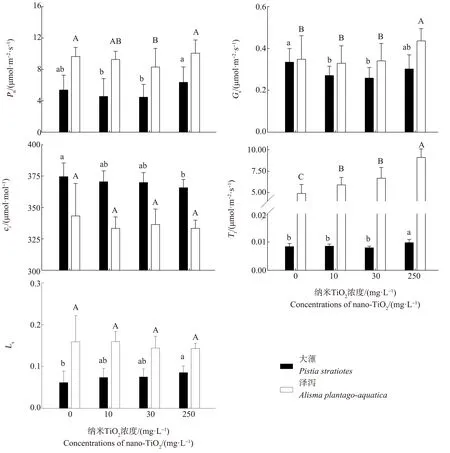
图3 纳米TiO2浓度对大薸和泽泻的光合参数的影响注:Pn、Gs、ci、Tr和Ls分别表示净光合速率、气孔导度、胞间CO2浓度、蒸腾速率和气孔限制值;不同字母表示与对照组相比具有显著性差异(P<0.05)。Fig. 3 Effects of TiO2 nanoparticle concentrations on the photosynthetic parameters of Pistia stratiotes and Alisma plantago-aquaticaNote: Pn, Gs, ci, Tr and Ls represent net photosynthetic rate, stomatal conductance, intercellular carbon dioxide concentration, transpiration rate and limiting value of stomata, respectively; different letters indicate that there are significant differences (P<0.05), compared with the control.
3 讨论(Discussion)
为了进一步讨论植物各个部位中Ti元素浓度、相对生物量变化率及光合各参数间的关系,深入分析纳米TiO2暴露对2种植物光合特征影响差异的原因,绘制了各参数间的相关系数热图(图4)。由图4可以观察到2类关系,即植物中Ti元素浓度与相对生物量变化率及光合参数之间的关系。第一,2种植物各个部位中Ti元素浓度与相对生物量变化率呈正相关关系,大薸的相关系数高于泽泻,且大薸芽中Ti元素浓度越高,相对生物量变化率越大。第二,Ti元素浓度与Pn和Tr正相关,与ci负相关。与Pn的相关系数,大薸大于泽泻,与Tr的相关系数大薸小于泽泻,而与ci的相关系数,2种植物无明显差异。Ti元素浓度与Gs和Ls的相关关系2种植物相反,对于大薸,Ti元素浓度与Gs负相关,而与Ls正相关。由此可见,纳米TiO2暴露对2种类型湿地植物的影响差异较为明显,可能与2种植物生活型的差异有关。

图4 大薸和泽泻各部位Ti浓度与光合参数间相关系数热图注:Δm 表示相对生物量变化率。Fig. 4 Heat map of correlation coefficients between Ti concentrations and photosynthetic parameters of Pistia stratiotes and Alisma plantago-aquaticaNote: Δm represent biomass change rate.
本研究发现,纳米TiO2暴露能够促进大薸和泽泻的生长,同时随着暴露浓度的升高,植物各部位中Ti元素浓度也增加,根尤其明显。目前针对植物吸收纳米TiO2的研究开展较多,对象包括农作物、草本植物、藻类及少量湿地植物,发现纳米TiO2可被小麦、玉米、拟南芥和青萍等植物体吸收[7-11],在根部浓度较高[20],纳米TiO2同时也能被吸收进入植物的茎、叶等营养器官,甚至在果实中也可检测到[6,21]。本研究的发现与这些研究结果相一致。本研究还观察到植物生活型差异导致了吸收纳米TiO2能力的差异,我们发现泽泻对Ti的生物富集系数更大,而大薸对Ti的转移系数更稳定。此外,本研究没有设置含Ti溶液暴露组,因此不能区分纳米TiO2暴露和Ti溶液暴露的差异,在今后的研究中需要考虑。
纳米TiO2暴露对2种植物的Pn均表现出低浓度抑制、高浓度促进的规律,但变化趋势不显著(P>0.05),但是从ci和Ls的变化规律可以发现,纳米TiO2暴露影响2种植物光合作用的机制不同。许大全[22]指出,可以通过ci和Ls的变化方向来判断气孔是否为光合速率下降的限制因素,如ci下降,Ls上升,那么气孔导度变化是主因,而ci上升,Ls下降,则光合速率下降为非气孔因素导致。在本研究中,随着纳米TiO2暴露浓度的升高,大薸的ci下降,Ls上升,气孔限制是其光合速率变化的主因,而泽泻的ci和Ls没有明显变化趋势,气孔限制不是其光合速率变化的主因。
纳米TiO2暴露能促进部分植物的光合作用和生长发育,其可能的原因正如Carvajal和Alcaraz[23]在研究中提出的,Ti元素非植物必需元素,但对植物有益,主要表现在以下几个方面:(1)Ti元素能够促进植物的生长,90%的关于农作物的研究显示,Ti元素能够提高作物产量;(2)提高植物细胞中酶的活性,促进相关的代谢过程,如促进植物叶片光能的吸收分配、光电转换和光合放氧等过程,提高光合作用效率等[24-25];(3)降低其他元素的毒性效果[23];(4)增加植物对必需元素的吸收和利用,如Ti可携带离子促进植物对营养元素Fe、N的吸收;植物缺Fe时,适当浓度的Ti元素可刺激植物提高Fe转运蛋白基因的表达,进而提高Fe的吸收[26]。结合本研究发现的Ti元素在大薸中浓度更高,对其生长和光合影响更为显著的结果可以推测,浮水植物没有茎组织,Ti元素能够更快地进入到叶片中,发挥积极作用,而在挺水植物中,Ti元素可能滞留在茎组织中,进而降低其对叶片光合作用的影响。基于Carvajal和Alcaraz[23]的研究结果,还可以推测,本研究中观察到TiO2加入后,2种植物净光合速率增加不显著的现象(P>0.05),可能是Ti元素同时提高了植物的光合和呼吸作用,进而导致净光合速率变化不明显。Yang等[12]关于纳米TiO2提高菠菜对氮元素代谢的报道,可能从侧面支撑了本研究的推测。
研究也报道了纳米TiO2暴露对植物生长的抑制作用乃至毒性效性,当纳米TiO2暴露浓度超过一定限度时,可附着在植物根表降低根部导水率,缩小细胞壁孔径,影响叶片的蒸腾作用及生长[17,27-28];也有可能产生脂质过氧化作用,导致抗氧化酶活性降低,造成细胞氧化损伤,从而抑制植物的生长[29-31];也可与营养元素竞争配体或转运蛋白,导致植物缺营养而对植物产生毒性[32-33]。本研究中添加的纳米TiO2未对大薸和泽泻表现出毒性效应,可能是该粒径的纳米TiO2未对植物细胞产生损伤。
综上所述,本研究结果表明:
(1)纳米TiO2暴露促进了大薸和泽泻的生物量增长,虽大薸生长更快,但纳米TiO2暴露对2种植物生物量增加的促进作用没有显著差异(P>0.05)。
(2)纳米TiO2暴露后主要富集在2种植物的根部,富集量随暴露浓度的升高而增加,纳米TiO2也能进入植物体内,大薸植物内Ti元素浓度明显高于泽泻。
(3)较高浓度纳米TiO2暴露(250 mg·L-1)能够显著改变2种植物的叶孔开放程度、CO2消耗状况及蒸腾速率,但对净光合速率的影响不显著(P>0.05)。通过相关性和气孔限制分析发现,植物的生活型可能决定纳米TiO2暴露影响大薸和泽泻光合作用的机制。

