17β-雌二醇(E2)对大型溞(Daphnia magna)生殖、发育和相关基因转录的影响
李晓东,袁思亮,李俊,刘春生
华中农业大学水产学院,武汉 430070
环境中的多种化合物具有内分泌干扰效应,能够干扰生物体正常的内分泌功能,对个体及其子代产生不良影响,而类雌激素效应物质是环境中最主要的内分泌干扰物。长期以来,由于环境雌激素浓度低、急性毒性小等特点,长期以来不为人们所重视[1]。近些年来,由于环境介质中雌激素物质浓度的逐步升高,释放到环境中的雌激素效应物质可能会干扰生物体的内分泌系统[2]。畜禽养殖是产生雌激素的重要来源,更值得引起注意的是,由于活禽养殖的粪便被用作土壤肥料,因此造成环境雌激素的广泛分布,且在众多环境雌激素中,17β-雌二醇(17β-estradiol, E2)具有较高的生物活性[3]。E2作为最典型的雌激素效应物质,大量应用在生物医药领域,并在环境中被频繁地检测到且具有较高的环境浓度。与其他污染物类似,E2首先在污水厂进出水口中被检测到。在德国污水处理厂中,检测到E2的最高浓度为19 ng·L-1[4],巴西、意大利和以色列污水处理厂中检测到的E2浓度分别为21、16.1和141.9 ng·L-1[5-6]。在中国沿海地区,检测3家污水处理厂进出水口的E2浓度,范围分别为39.6~90.1 ng·L-1和2.2~54.6 ng·L-1[7-8]。在对地表径流的检测中,E2在日本和美国河流中的浓度为1.8~2.1 ng·L-1[9]和9 ng·L-1[10]。在中国天津地区的3条河流以及珠江检测到E2最高浓度分别为32.4 ng·L-1[11]和7.5 ng·L-1[12]。
大量的毒理学研究证明,水环境中的雌激素物质对鱼类[13]和两栖类[14]等水生脊椎动物有发育毒性、生殖毒性和内分泌干扰效应等多种毒性效应。李国超等[15]报道E2暴露能够引起斑马鱼中雌性比例上升,并上调部分雌性相关基因的转录,下调部分雄性相关基因的转录。侯彦峰等[16]报道0.1 ng·L-1E2暴露导致日本青鳉肝脏内卵黄蛋白原基因转录显著上调。树蛙暴露于E2导致间性个体的出现并干扰肝脏中相关基因的转录[17]。徐伟等[18]报道6月龄非洲爪蛙暴露于2.72 μg·L-1E2中6 d,可导致雌性个体输卵管发生形态改变。目前,有关水体雌激素风险或危害评价研究大多集中在高营养级的水生脊椎动物中[19],而其对低营养级水生无脊椎动物的毒性效应缺乏系统性的研究和分子机制上的探究。
大型溞(Daphniamagna)是一类小型的枝角类浮游甲壳动物,广泛分布于亚洲、欧洲、北美洲以及非洲[20-21],其生命周期和繁殖周期短,繁殖量大,在环境条件良好的状况下进行孤雌生殖,是一种模式毒理学生物[22]。大型溞作为低等的水生生物,处在水环境食物链的中间位置,占据重要生态位。因此,有关大型溞毒性效应的研究对整个水生环境食物链具有一定的参考作用[23]。Brennan等[24]报道了E2对大型溞的48 h半致死浓度(48 h-LC50)为2.87 mg·L-1,且1.0 mg·L-1E2暴露21 d显著降低大型溞存活率至60%,同时E2暴露对大型溞的累积蜕皮个数与累积产卵个数没有显著性影响。李根[25]报道了1.28 mg·L-1E2急性暴露抑制了大型溞抗氧化酶的活性,但是21 d慢性暴露对其平均繁殖次数和产溞数没有显著性影响。Torres等[26]报道了在巴西Piracicaba河流中E2的浓度为137 ng·L-1,进一步揭示河水中的E2对大型溞有较低的急性毒性风险并强调开展慢性E2暴露的环境风险评估的必要性。已有的有关E2对大型溞毒性效应和环境风险评估的研究仅仅统计了部分表观指标的改变,而未涉及分子机制上的探究。基于此,本研究在总结已有文献结果的基础上,为了进一步探究E2对大型溞的发育和生殖等的毒性效应以及相应的分子机制,选择0、1.36、13.6、136和1 360 μg·L-1为E2的暴露浓度,开展了为期21 d的慢性暴露实验。实验期间,统计并分析了大型溞存活率、累积产溞量、累积蜕皮个数、母代与子代体长、母代与子代游泳速度等终点指标,并利用荧光定量PCR技术(qRT-PCR)评估了大型溞发育和生殖相关基因的转录水平,在分子机制上探讨了E2对大型溞毒性效应的机理。
1 材料与方法 (Materials and methods)
1.1 实验试剂
E2购自日本东京化成工业株式会社,CAS号为50-28-2,纯度>97%。有机助溶剂二甲基亚砜(DMSO)购自美国Sigma公司,CAS号为67-68-5,纯度>99%。实验前,取不同量的E2溶解于DMSO中,制备成相应浓度的贮备液,存放于4 ℃。RNA提取所需的RNAiso Plus试剂、反转录试剂PrimeScriptTMRT reagent kit及荧光定量试剂SYBR®Primex Ex TaqTMⅡ购自中国TaKaRa公司。此外,RNA提取所用氯仿(CAS号67-66-3)、异丙醇(CAS号67-63-0)和无水乙醇(CAS号64-17-5)均购自中国国药集团化学试剂有限公司,为国产分析纯级。
1.2 大型溞的培养
本研究所用大型溞已在本实验室中连续培养多代,日常持续培养在光照培养箱中,并设置培养箱内的温度为(22±1)℃,光照/黑暗时长比为16 h/8 h。大型溞培养所用水体为连续曝气48 h的过滤自来水。以小球藻(Chlorellapyrenoidosa)和斜生栅藻(Scenedesmusobliquus)的混合液喂食大型溞,喂养密度为4.5×104cells·mL-1,待到大型溞开始产卵后喂食9.0×104cells·mL-1的小球藻和斜生栅藻的混合液,每天上午喂食一次,每次投喂2 mL。
1.3 慢性暴露实验
慢性暴露实验在1 L的玻璃烧杯中进行,按照OECD Test Guideline 211[27]相关指导方案。因为Brennan等[24]报道了E2对大型溞48 h-LC50为2.87 mg·L-1,并且1.0 mg·L-1E2对大型溞21 d慢性暴露没有引起显著性效应。因此,为了探究不同浓度范围的E2暴露对大型溞的影响,本实验设置了5个浓度梯度,分别为0、1.36、13.6、136和1 360 μg·L-1,每个浓度梯度设置3个平行。采用OECD Test Guideline 211[27]指导方案中的半静态暴露方法,暴露液每2 d更换一次,每个平行烧杯中含有900 mL暴露液和30只幼溞(<24 h),对照组和处理组中DMSO浓度均为0.1‰,暴露时间为21 d。暴露期间每天统计大型溞的死亡个数、产溞数以及蜕皮个数,并绘制累积蜕皮曲线和累积产卵曲线。
1.4 体长测量与游泳速度检测
在暴露的第7、14和21天每个暴露缸取10只溞用于体长的测定,在第21天取10只(<24 h)子一代小溞,用于体长的测定,使用软件Image Pro Plus和LEICA DFC450C(德国)测量体长,用动物行为仪DanioVision(荷兰Noldus公司)检测F0、F1代游泳速度。检测用24孔板,每个暴露缸取4只溞,每个孔板中放置1只溞,每个浓度组共12个平行。检测程序设置为25 min,包括5 min黑暗适应时间和2个10 min的光暗循环,每个光暗循环包括5 min光照时间和5 min黑暗时间,在每个5 min光照或黑暗时长中间给予一个轻拍刺激。
1.5 qRT-PCR
21 d暴露结束后,每个暴露缸取10只溞,用TRIzol法提取总RNA,所提取的RNA用Epoch Microplate分光光度计(美国BioTek Instruments, Inc.公司)进行纯度检验。检验方法根据RNA样品在260 nm/280 nm波长下的比值,若比值在1.90~2.10之间,则确定所得RNA的纯度较高,可以用于反转录。RNA的浓度则根据260 nm波长下的吸光度数值确定,将所提取的RNA在200 μL EP管中稀释至100 ng·L-1。反转录使用Prime Script RT reagent kits (中国Takara公司)试剂,所需RNA的量为500 ng。将反转录所需所有试剂配制为10 μL体系,具体试剂用量如下:5× Prime Script Buffer (for real time) 2 μL、Prime Script RT Enzyme Mix 0.5 μL、Oligo dT Primer (50 μmol·L-1) 0.5 μL、Random 6 mers (100 μmol·L-1) 0.5 μL、RNase Free dH2O 1.5 μL和Total RNA 5 μL。反转录体系加样完成后,经离心后放置在PCR仪中进行反转录。PCR仪反应条件设置如下:37 ℃,15 min;85 ℃,5 s。反应完成后得到cDNA,在200 μL EP管中加入RNase Free dH2O 90 μL,cDNA被稀释10倍,均匀混合后置于-20 ℃中保存备用。qRT-PCR使用SYBR Green Primex Ex TaqⅡ kits(中国Takara公司)试剂。根据SYBR Green Primex Ex TaqⅡ kits试剂盒说明,配制20 μL反应体系:SYBR Green Mix试剂10 μL、DEPC水6 μL、ROX Reference Dye试剂0.4 μL、Primer F 0.8 μL、Primer R 0.8 μL和cDNA 2 μL。将此20 μL体系置于qRT-PCR专用96孔板中,每个浓度组设置3个平行,每个暴露缸中的10只溞混样为一个平行。qRT-PCR扩增条件设置为:95 ℃,2 min;95 ℃,15 s;60 ℃,1 min;共计40个循环。数据采用CT值计算,采用2-△△CT法分析。实验所选取的与蜕皮和生殖有关基因选自相关文献的报道[28-33],如表1所示。根据相关文献的研究,在雌激素物质暴露中,ubc的转录水平更为稳定[28],因此本实验选定ubc为内参基因。
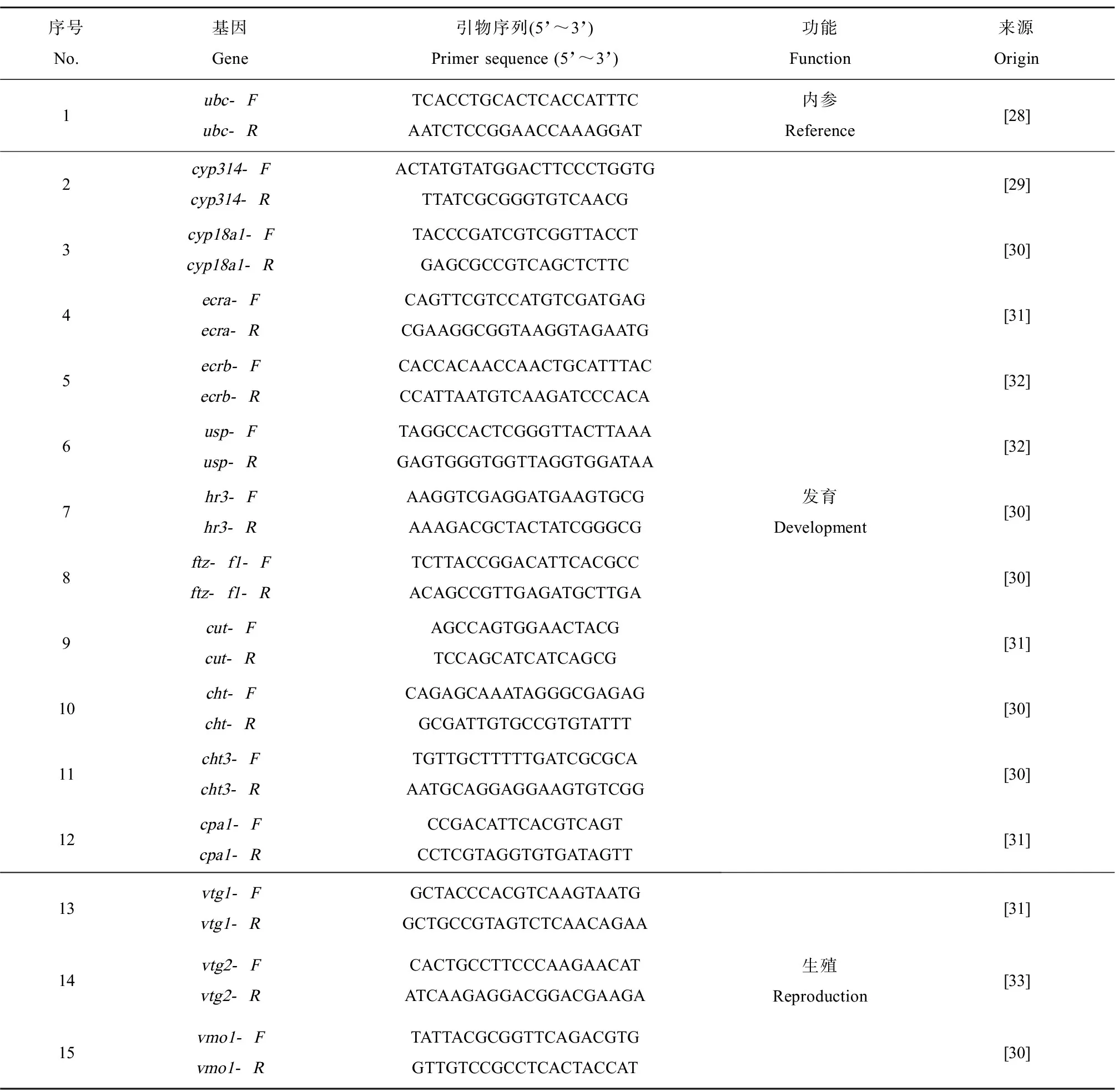
表1 大型溞生殖和发育有关基因引物序列Table 1 The primer sequences of the genes related to the reproduction and development of Daphnia magna
1.6 数据分析
所有数据均采用SPSS 20.0(SPSS, 芝加哥)软件进行分析。所有数据均采用单因素方差分析(one-way analysis of variance, ANOVA)方法中的Tukey’s多量程检验来确认对照组与暴露组之间的显著差异,P<0.05定义具有显著性差异。所有的数据结果均表示为平均值±标准差(mean±SD)。实验结果中所有图片均用软件Prism Graphpad6绘制。
2 结果(Results)
2.1 E2慢性暴露的致死率
如图1所示,21 d暴露实验结束,0、1.36、13.6、136和1 360 μg·L-1暴露组大型溞存活率分别为97.78%±1.92%、97.78%±1.92%、98.89%±1.92%、93.33%±6.67%和71.11%±17.10%。与对照组相比,1 360 μg·L-1暴露组大型溞的存活率显著降低,对大型溞的致死效应显著。
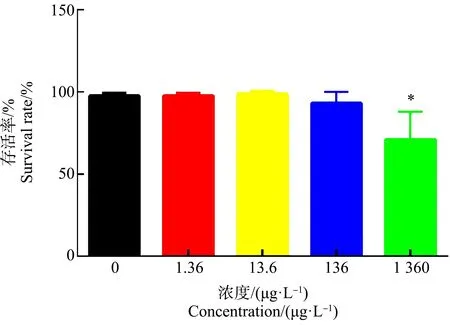
图1 17β-雌二醇(E2) 21 d暴露对大型溞的致死效应注:E2浓度为0、1.36、13.6、136和1 360 μg·L-1;数据表达为平均值±标准差;*代表P<0.05,与对照组相比有显著性差异。Fig. 1 The lethal effect of 17β-estradiol (E2) exposure on Daphnia magna after exposure for 21 dNote: The concentrations of E2 are 0, 1.36, 13.6, 136, 1 360 μg·L-1; data was represented by mean±standard deviation; *represented that the exposure group had significant difference at P<0.05 level when compared with control.
2.2 E2暴露的发育毒性
2.2.1 E2暴露对累积蜕皮个数的影响
如图2(a)所示,E2暴露21 d后,0、1.36、13.6、136和1 360 μg·L-1暴露组中,平均每只溞的累积蜕皮个数分别为(9.16±0.05)、(8.89±0.05)、(9.00±0.10)、(8.91±0.13)和(8.37±0.28)个。与对照组相比,1 360 μg·L-1暴露组平均累积蜕皮个数降低了8.62%,表明E2暴露能够显著地抑制大型溞的蜕皮,减缓其发育过程。
2.2.2 E2暴露对大型溞F0代体长及游泳速度的影响
如图2(b)所示,0、1.36、13.6、136和1 360 μg·L-1这5个暴露组在第7天时体长分别为(2.41±0.13)、(2.38±0.15)、(2.36±0.13)、(2.33±0.20)和(2.12±0.28) mm。E2暴露对大型溞体长呈现剂量依赖性抑制效应,并且1 360 μg·L-1暴露组中大型溞F0代体长受到显著抑制。但是在第14天和第21天时暴露组与对照组相比体长均没有受到显著性抑制效应,说明E2对大型溞生长发育早期有明显抑制效应。随着暴露时间的延长,暴露组与对照组之间的差异逐渐减小。1 360 μg·L-1暴露组与对照组相比,体长虽有所减少,但已经没有显著性差异。
如图2(c)所示,0、1.36、13.6、136和1 360 μg·L-1这5个暴露组中,F0代游泳速度分别为(0.52±0.04)、(0.46±0.10)、(0.53±0.06)、(0.55±0.07)和(0.47±0.03) cm·s-1。所有暴露组与对照组相比,速度均无显著性差异。
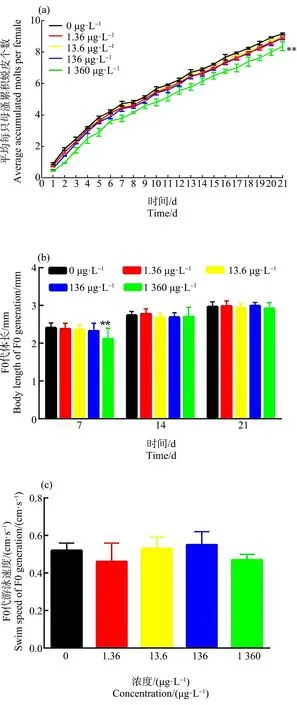
图2 E2的21 d暴露对大型溞发育的影响注:E2浓度为0、1.36、13.6、136和1 360 μg·L-1;数据表达为平均值±标准差;**代表P<0.01,与对照组相比有显著性差异。Fig. 2 The effect of E2 exposure on the development of Daphnia magnaNote: The concentrations of E2 are 0, 1.36, 13.6, 136, 1 360 μg·L-1; data was represented by mean±standard deviation; ** represented that the exposure group had significant difference at P<0.01 level when compared with control.
2.3 E2暴露的生殖毒性
2.3.1 E2暴露对大型溞幼溞产量的影响
如图3(a)所示,暴露21 d后,0、1.36、13.6、136和1 360 μg·L-1这5个暴露组中,平均每只母溞的累积产溞量分别为(13.50±0.68)、(12.96±0.91)、(11.41±0.37)、(13.16±1.38)和(18.28±1.39)个。与对照组相比,1 360 μg·L-1暴露组大型溞平均累积产溞量显著提高35.40%,表明E2暴露能够显著增加大型溞产溞量,干扰大型溞的生殖。
2.3.2 E2暴露对大型溞F1代体长和游泳速度的影响
如图3(b)所示,0、1.36、13.6、136和1 360 μg·L-1这5个暴露组中,F1代体长分别为(0.84±0.05)、(0.87±0.04)、(0.87±0.05)、(0.85±0.04)和(0.82±0.03) mm。与对照组相比,暴露组F1代体长并无显著性差异。
如图3(c)所示,0、1.36、13.6、136和1 360 μg·L-1这5个暴露组中,F1代游泳速度分别为(0.52±0.04)、(0.46±0.10)、(0.53±0.06)、(0.55±0.07)和(0.47±0.03) cm·s-1。与对照组相比,暴露组F1代游泳速度无显著性差异。
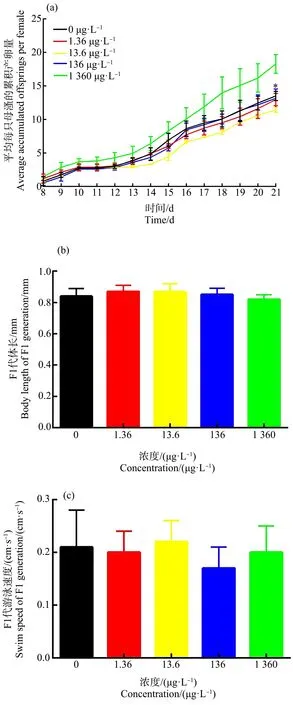
图3 E2的21 d暴露对大型溞生殖的影响注:E2浓度为0、1.36、13.6、136和1 360 μg·L-1;数据表达为平均值±标准差;*代表P<0.05,与对照组相比有显著性差异。Fig. 3 The effect of E2 exposure on the reproduction of Daphnia magnaNote: The concentrations of E2 are 0, 1.36, 13.6, 136, 1 360 μg·L-1; data was represented by mean±standard deviation; *represented that the exposure group had significant difference at P<0.05 level when compared with control.
2.4 E2暴露对相关基因转录的影响
如图4(a)所示,在与大型溞发育有关的基因转录中,1 360 μg·L-1E2暴露显著性地降低了大型溞蜕皮激素代谢相关基因cyp18a1(0.42±0.04)和蜕皮激素受体基因hr3(0.52±0.16)的转录,同时也降低了大型溞表皮蛋白合成基因cut(0.70±0.66),并促进了表皮蛋白代谢基因cht(2.05±1.11)和cht3(1.60±0.74)的转录,但是与对照组相比没有统计学上的显著性差异。在与大型溞生殖有关的基因转录中,如图4(b)所示,所有暴露组中生殖相关基因vtg1、vtg2和vmo1的转录均与对照组无显著性差异。
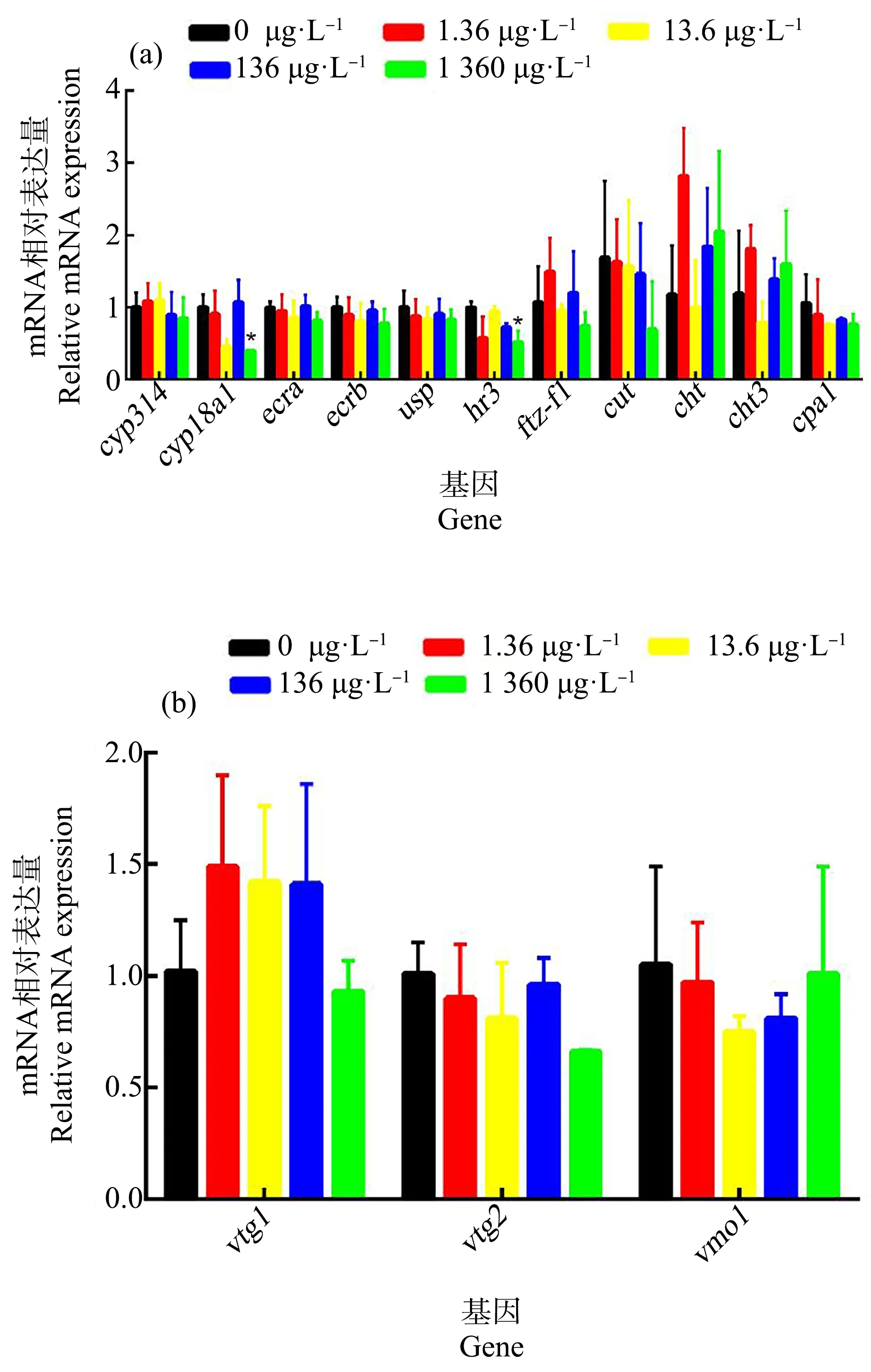
图4 E2的21 d暴露对大型溞发育(a)和生殖(b)相关基因转录的影响注:E2浓度为0、1.36、13.6、136和1 360 μg·L-1;数据表达为平均值±标准差;*代表P<0.05,与对照组相比有显著性差异。Fig. 4 The effect of E2 exposure on the transcriptions of genes relevant to development (a) and reproduction (b) of Daphnia magnaNote: The concentrations of E2 are 0, 1.36, 13.6, 136, 1 360 μg·L-1; data was represented by mean±standard deviation; *represented that the exposure group had significant difference at P<0.05 level when compared with control.
3 讨论(Discussion)
本研究依据OECD Test Guideline 211[27]测试方法,评价了E2对大型溞存活、发育和生殖的影响。结果表明,只有最高浓度组(1 360 μg·L-1E2)中,暴露21 d后大型溞会有显著死亡,其死亡率约为30%,说明高浓度E2对大型溞有显著致死效应。Brennan等[24]曾报道1.0 mg·L-1E2暴露21 d可对大型溞产生40%的致死率,与本研究结果基本一致。李根[25]探究了E2急性暴露对大型溞抗氧化酶系统的影响,发现0.64 mg·L-1E2暴露48 h会抑制大型溞幼溞过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽S-转移酶(GST)等抗氧化酶的活性,这说明E2暴露可能会通过影响大型溞氧化应激水平,降低大型溞的存活率。
蜕皮是大型溞生殖和发育所必需的重要生理过程,蜕皮后大型溞体长增加,卵囊空间增大,有利于其生长和产卵[34]。本研究结果表明,E2显著地抑制
了大型溞的平均累积蜕皮个数,此外,E2暴露7 d显著抑制了F0代大型溞的个体生长,但是随着暴露时间延长,处理组和对照组体长之间的差异逐渐缩小,这说明E2可能对大型溞早期发育抑制效应更为显著,从而导致其发育减缓。对于E2的生殖毒性,本研究表明,E2暴露会导致大型溞21 d累积产溞数显著升高,但对F1子代的个体生长和运动行为没有影响。这说明,E2能干扰F0代大型溞的生殖能力,但E2的母代暴露不会影响子代的发育。相关研究用1 mg·L-1E2连续染毒两代大型溞,发现F0代产溞量没有显著变化,但是暴露至F1代时,其产溞量与F0代相比,显著性降低[30]。本研究与此研究结果的差异可能是由暴露方式和浓度不同导致的,但两者均说明E2暴露会对大型溞产生生殖毒性。
为进一步探究E2对大型溞毒性效应的分子机制,本研究利用qRT-PCR技术对大型溞蜕皮和生殖相关基因的转录进行了评价。大型溞蜕皮主要受20-羟基蜕皮激素(20-HE)的直接控制[35],并且蜕皮激素在蜕皮过程中的代谢对大型溞的蜕皮至关重要[36]。在大型溞中,cyp18a1负责编码将蜕皮激素20-HE催化成26-羧基酸的酶[36],因此,cyp18a1转录结果的降低会干扰大型溞蜕皮激素20-HE的正常代谢。蜕皮激素20-HE与蜕皮激素受体(EcR)和超气门蛋白(USP)共聚物结合后引发蜕皮激素受体基因hr3的转录[37]。蜕皮激素受体基因hr3是引发蜕皮激素下游信号通路的非常关键的基因,当沉默hr3基因时,可以导致蜕皮的延迟和失败[38-39]。在本研究中,E2暴露显著地降低了cyp18a1及hr3这2个基因的转录,这与1 360 μg·L-1E2处理组中累积蜕皮个数减少的结果一致。在大型溞中,一个完整的蜕皮过程包括旧有的表皮水解、角质蛋白分泌、旧蛋白水解与重吸收、旧表皮脱落以及新的表皮形成等过程[39]。其中,cut基因负责角质蛋白的生成[37],cht和cht3基因负责水解角质蛋白[31]。本研究中,E2暴露导致cut转录的下调和cht转录的上调,继而可能导致了大型溞旧表皮水解和新角质蛋白分泌过程被干扰,最终减少了大型溞蜕皮个数,抑制了大型溞的蜕皮。Zou和Fingerman[40]曾指出,在大型溞中,具有多个苯环的外源性化学物质可以与蜕皮激素受体结合,对内源性蜕皮激素产生拮抗作用,干扰正常的蜕皮过程[40]。Mu和Leblanc[41]总结了他们之前的研究,认为能够表现出干扰蜕皮激素代谢或者与蜕皮激素产生拮抗效应的外源性化学物质对大型溞可以表现出蜕皮抑制和生殖干扰作用[41-44]。然而,qRT-PCR结果显示,E2暴露并未对大型溞生殖相关基因vtg1、vtg2和vmo1基因的转录有显著性影响。这表明,E2主要是通过干扰大型溞蜕皮激素的代谢,从而影响了大型溞的蜕皮和生殖周期,并干扰了大型溞的生殖能力。
综上所述,1 360 μg·L-1E2暴露对大型溞产生了明显的致死效应,以及较高的生殖毒性效应和较低的发育毒性效应。此外,1 360 μg·L-1暴露抑制了大型溞蜕皮激素代谢关键基因cyp18a1和蜕皮激素受体基因hr3的转录,干扰了蜕皮激素代谢,并且抑制了大型溞表皮蛋白合成基因cut的转录,同时促进了大型溞表皮蛋白分解基因cht、cht3的转录,从而干扰了大型溞蜕皮和生殖。同时,E2暴露显著地促进大型溞产卵量,干扰了大型溞正常的生殖过程。以上结果表明,E2暴露对大型溞产生较低的环境风险。
本研究揭示了E2对大型溞生殖、发育及相关基因转录的影响,为环境中E2的风险评估提供了相关的理论依据。有关E2暴露对大型溞生殖发育影响的具体分子机制需要进一步的研究。同时,由于自然界中化学物质的多样性和持续存在性,联合暴露和多代暴露在进一步的研究中也具有重要意义。

