雌二醇暴露中国青鳉原代肝细胞转录组分析
吕钧惠,王悦,周蕾,范晓琳,肖寒,杨磊,胥建卫,张照斌,*
1. 西北农林科技大学理学院,杨凌 712100 2. 北京大学城市与环境学院,北京 100871
环境雌激素(EEs)是水环境中最受关注的内分泌干扰物质类型[1-4]。研究表明,暴露在EEs污染的环境中,鱼类会出现雄性生殖能力下降、雌雄同体、雄性逆转为雌性和性激素水平异常等问题,进而造成鱼类种群的繁殖能力下降,种群数量减少,甚至灭绝[5-7]。卵黄原蛋白(vitellogenin, VTG)和卵壳前体蛋白(choriogenin, CHG)是鱼类等卵生动物卵巢发育过程中需要的2类蛋白质,正常情况下,雌性个体中,2类蛋白质在内源雌激素刺激下在肝脏合成后运输至卵巢。鱼类幼体和雄性中VTG和CHG基因通常不表达或表达量极低,但是在环境雌激素作用下幼鱼和雄鱼中VTG和CHG基因也会大量表达[8-9],因此,VTG和CHG基因被开发为生物标记物(biomarker),广泛应用于化学物质雌激素活性的评估。近年来,随着新一代测序技术(NGS)的成熟,人们开始用其研究鱼类其他雌激素响应基因,以期阐明环境雌激素影响鱼类生殖发育的分子机理,同时也希望找到更多可以利用的生物标记物基因。Kausch等[10]发现斑马鱼肝脏中有211个雌激素响应基因。在环境雌激素的生态毒理学研究中,国内外常用斑马鱼和日本青鳉等[11-13]作为模式生物,我国的一些学者也采用本土物种稀有鮈鲫开展研究[14-16]。国际通用的模式生物的优势在于其生物学信息较全面,包括基因组、转录组和基因功能等已有大量基础研究,数据信息可以在现存常规数据库中调阅,如斑马鱼模式物种数据库ZFIN(Zebrafish Model Organism Database)和基因组注释数据库Ensembl、Vega和UCSC Genome Browser[17];而本土物种材料易得,甚至可以直接从环境水体中获得,且不存在外来物种入侵风险。近年来NGS的迅速发展,使得一个独立课题组也能够开展一个物种的基因组和转录组分析,能够较容易地分析本地物种的基因组和转录组。在本研究中,选择在中国南北方均广泛分布的中国青鳉作为实验动物,通过实验室多代驯化培育,获得了实验室内稳定传代的野生型实验品系。利用NGS和生物信息学软件,对其肝脏转录组进行分析。
在开展环境雌激素的鱼类毒理学研究中,通常采用活体暴露方式,其优点在于暴露方式与现实环境暴露形式相同。但是在机理性研究时,往往由于实验动物的个体差异,造成一些误差和不确切的结果。因此,建立和采用鱼类细胞培养方法,利用离体细胞开展机理研究更为理想[18-21]。为此,以中国青鳉肝细胞为实验对象,经不同浓度的17β-雌二醇(E2)暴露后,利用NGS获得转录本后筛选雌激素响应基因,并通过GO功能注释和KEGG通路富集分析,揭示肝脏雌激素响应基因的功能和通道;然后利用RT-qPCR方法,验证NGS结果并建立雌激素响应基因与E2浓度的关系,以期建立有效的环境雌激素生物检测方法。
1 材料与方法(Materials and methods)
1.1 实验材料
实验动物为雄性中国青鳉(Oryziassinensis),取自本实验室繁育的4月龄个体,体长2.8~3.5 cm,体重0.2~0.28 g。该实验品系最初采自北京市海淀公园湖泊,目前在本实验室已繁育>3 a,繁育代数超过6代。养殖条件:采用活性炭处理的自来水,水温(25±1) ℃,水硬度8.0 mg·L-1,pH 7.5~7.8,溶解氧8.0~9.0 mg·L-1,光照周期昼夜比为16 h∶8 h,饲料为新孵化丰年虾,每日喂食2次。
E2纯度>98%,购于美国Sigma公司;DMEM高糖培养基和青链霉素溶液购自美国Gibco公司;胎牛血清(FBS)购自以色列BI公司;0.28%胰蛋白酶-EDTA溶液和生理盐水(两栖动物专用,无菌)购自中国Leagene公司;二甲基亚砜(DMSO)分析纯,购自美国VWR公司;RNA提取试剂Trizol和实时定量PCR试剂SYBR®Green PCR Master Mix购自美国Life Technologies公司;M-MLV反转录酶、M-MLV-RT缓冲液、dNTP Mix、Oligo(dT)15 Primer和RNA酶抑制剂购自美国Promega公司;35 mm培养皿、6孔培养板购自美国Costar公司;96孔光学PCR板和光学透明塑料盖膜购自美国Axygen公司。
1.2 实验方法
1.2.1 中国青鳉原代肝细胞采集
将鱼置于冰上麻醉,用1%的次氯酸钠和75%的酒精对鱼体表消毒,解剖取肝脏组织,置于生理盐水(两栖动物专用,无菌)中;肝脏经多次洗涤后转移至培养皿中,剪刀剪碎后用胰酶消化2~3 min至组织块松散,去掉胰酶,加入完全培养基(15% FBS+80% DMEM+5% H2O+0.1%青链霉素)终止反应;用150目滤网过滤,将滤液置于15 mL离心管,1 000 r·min-1离心5 min,收集肝细胞弃上清;用培养基悬浮细胞,计数细胞密度,采用台盼兰染色法评估细胞活力达到90%以上方可使用;采用完全培养基培养细胞。
1.2.2 E2暴露实验
将鱼原代肝细胞接种于6孔板中,对照组加入DMSO,实验组加入E2溶液,置于25 ℃、5% CO2细胞培养箱中培养24 h,E2溶液由DMSO配制,浓度梯度为0.01、0.1、1、10和100 nmol·L-1,DMSO含量不超过0.01%,每个浓度设置3个生物学重复,暴露时间24 h。
1.2.3 RNA提取和转录组测序
细胞总RNA用Trizol试剂提取,提取方法按Trizol试剂说明书。用Agilent 2100(美国安捷伦科技公司)和Nanodrop 2000c(美国Thermo Fisher Scientific公司)检测RNA的完整性。检测合格的RNA样品构建测序文库,在北京大学高通量测序平台Illumina Hiseq进行测序,获得clean reads数据。
1.2.4 转录组组装、基因注释与差异表达基因筛选
通过CLC Genomics Workbench软件对clean reads进行剪切(trim)和组装,得到表达序列标签(ESTs)。通过CLC Genomics Workbench软件中blastX功能对ESTs序列进行注释。将ESTs序列作为参考序列分析各个样品的表达数据,以RPKM作为衡量基因表达水平指标进行组间比较。以差异倍数绝对值|fold change (FC)|≥2、P<0.05作为筛选标准,进行差异表达基因(DEG)筛选。最后通过GO分析和KEGG Pathway分析得到GO功能注释和Pathway富集分析。
1.2.5 RT-qPCR方法
用Primer Express(美国Applied Biosystems)软件设计引物,引物序列如表1所示。先将RNA按照反转录试剂盒说明书反转录为cDNA,以rpl7为内参基因,以cDNA为模版进行荧光定量PCR。反应程序为:95 ℃预变性1 min,95 ℃变性20 s,60 ℃退火1 min,40个循环,溶解曲线条件为:95 ℃变性1 min,60 ℃退火30 s,95 ℃保温30 s。基因的相对表达量采用2-ΔΔCT法计算。
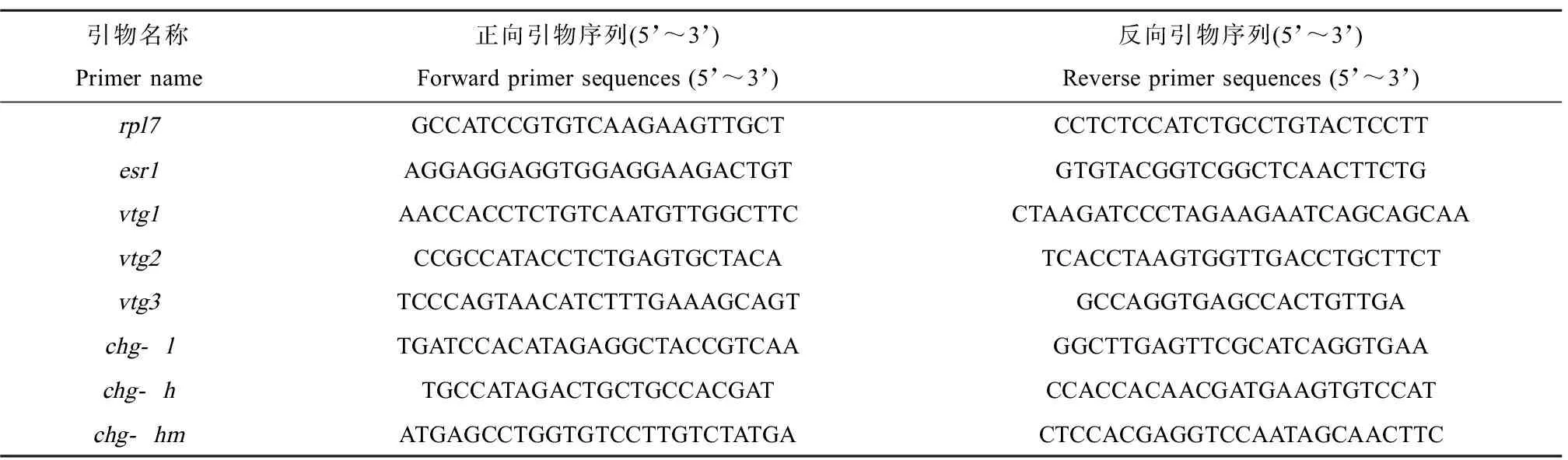
表1 RT-qPCR引物Table 1 Primers for RT-qPCR
1.3 数据处理方法
使用Excel 2016对实验数据进行整理,用SPSS进行单因素方差分析(ANOVO),显著性水平为P<0.05,通过Origin 9.0作图。
2 结果与分析(Results and analysis)
2.1 中国青鳉原代肝细胞培养方法建立
以DMEM(无酚红,高糖)为基础培养基,加入15% FBS,添加5%的超纯水调节渗透压。细胞采集过程中,鱼体需经过2层体表消毒,1%次氯酸钠和75%酒精,减少细菌污染机会。原代细胞分离过程中采用机械破碎和胰蛋白酶消化相结合的方式能有效提高活细胞比例,经过72 h培养后,细胞数量明显增多(图1)。

图1 中国青鳉原代肝细胞照片(100倍)注:(a)细胞培养开始时;(b)细胞培养72 h时。Fig. 1 Primary hepatocytes of Oryzias sinensis (100 times)Note: (a) before cell culture; (b) after 72 h of cell culture.
2.2 转录组序列组装结果
中国青鳉肝细胞暴露于不同浓度(0.01、0.1、1、10和100 nmol·L-1)的E2中24 h,提取RNA测序。经Illumina测序后,对原始数据进行过滤,获得clean reads,每个样本均获得6 G左右的测序数据量。各样本reads有88%以上能匹配到参考序列上,具体结果如表2所示。
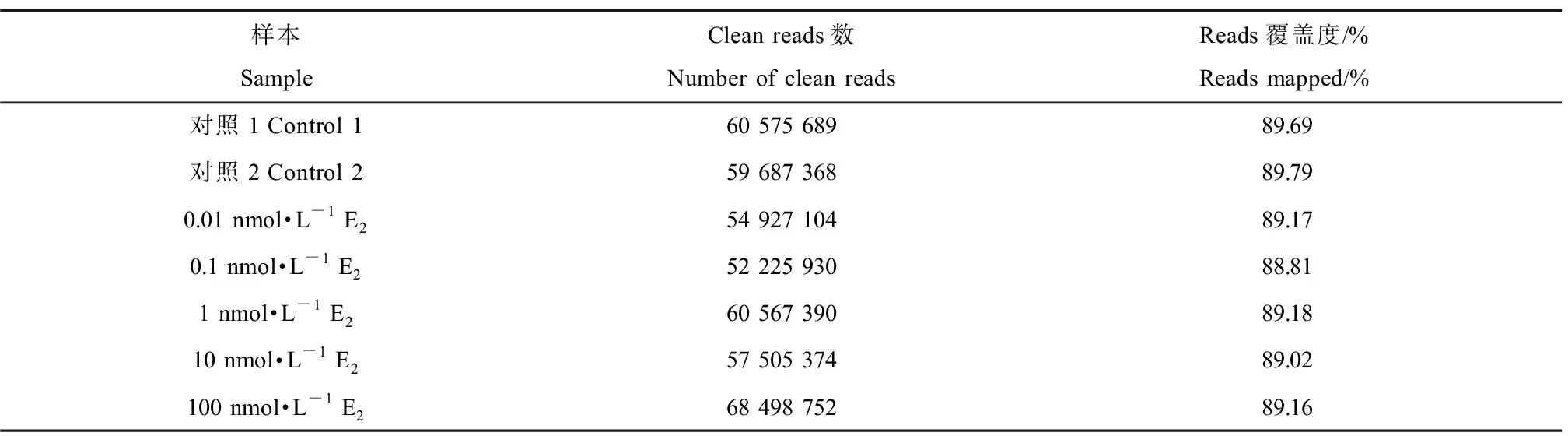
表2 各样本转录组数据结果统计表Table 2 Summary of different sample transcriptome sequencing data
通过CLC Genomics Workbench对clean reads进行De novo组装,共获得65 765条ESTs,最大contig长度为46 862 bp,平均长度为531 bp,N50为596 bp,GC含量44.7%,组装结果比较理想。
2.3 差异基因表达筛选与分析
以差异表达变化倍数和显著性P<0.05为筛选标准,筛选出差异基因105个,其中,上调基因38个,下调基因67个,如表3所示,基因表达聚类分析如图2所示。

图2 差异表达基因聚类分析注:(a)为总体差异表达基因;(b)为上调差异表达基因;(c)为下调差异表达基因。Fig. 2 Cluster analysis of differentially expressed genesNote: (a) total differentially expressed genes; (b) up-regulated differentially expressed genes; (c) down-regulated differentially expressed genes.

表3 上调和下调基因列表Table 3 Up and down regulated gene list
2.4 差异基因的GO和KEGG Pathway富集分析
将筛选到的105个差异表达基因通过在线分析网站DAVID(Database for Annotation, Visualization and Integrated Discovery)分别进行GO和KEGG富集分析,结果如图3和图4所示。差异表达基因主要富集到的生物学过程为雌激素的细胞响应、脂质运输和代谢、转录调控、蛋白磷酸化、骨骼肌组织发育、钙离子运输、胞内信号传递、对外来物的刺激反应、红细胞分化和肌肉收缩。上调基因主要富集到的生物学过程为雌激素的细胞响应、脂质运输、骨骼肌组织发育、对外来物的刺激反应和肌原纤维组装。下调基因主要富集到了转录调控、蛋白磷酸化、跨膜转运、钙离子运输、蛋白泛素化、红细胞分化和血管发育。KEGG Pathway富集分析显示,差异表达基因主要富集到的生物学过程为蛋白泛素化降解、MAPK信号通路和钙离子信号通路。
2.5 标记物基因的浓度效应关系
肝脏中与雌激素相关的基因有esr1、VTG家族和CHG家族等,ESR1为雌激素核受体,介导下游基因表达。VTG和CHG都由肝脏产生,通过血液运输到卵巢,对鱼类的繁殖发育有重要影响。本实验选取了生物标记基因esr1、vtg1、vtg2、vtg3、chg-l、chg-h和chg-hm,以rpl7作为管家基因进行RT-qPCR,验证实验方法的可靠性。将得到的循环数经2-ΔΔCT法计算后,通过SPSS进行单因素方差分析,实验结果如图5所示。随着E2浓度的增加,基因表达水平显著提高,与转录组测序结果一致。VTG家族对雌激素的响应比CHG家族更灵敏,与对照组相比,雌激素受体esr1在0.1 nmol·L-1E2暴露后升高了2.70倍,chg-l、chg-h和chg-hm在0.1 nmol·L-1E2暴露后分别升高了2.08倍、3.75倍和1.84倍,而vtg1、vtg2和vtg3在0.1 nmol·L-1E2暴露后时分别升高了70.81倍、11.39倍和18.68倍,具有很高的灵敏度。
3 讨论(Discussion)
结合胰蛋白酶-EDTA法和机械分散法处理肝脏,获得的肝脏细胞分散均匀且损伤小,有别于传统的单一处理方法。淡水鱼类细胞培养常用的培养基为EMEM,且多用于细胞系培养,RPMI-1640多用于悬浮细胞培养,M199适用范围比较广[22-23],本实验采用的是DMEM高糖无酚红培养基加胎牛血清的方法,适用于各种原代细胞及细胞系的培养,尤其适合附着性较差的细胞培养。原代细胞培养保留了部分甚至全部体细胞的生理功能特性,广泛应用于药物测试和毒理学研究等领域。
ER、VTG、CHG以及脑特异性芳香化酶B(AroB)是雌激素暴露的生物标志物,已被广泛用于检测雌激素内分泌干扰物。为了寻找其他的雌激素响应基因,Lam等[24]通过寡核苷酸微阵列技术获得了雄性斑马鱼的雌激素响应基因1 092个;Levi等[25]通过转录组分析研究了斑马鱼肝脏中的雌激素响应基因并筛选出了20个显著差异基因;Hao等[26]研究了斑马鱼早期胚胎发育的雌激素响应基因。本研究筛选出肝细胞雌激素响应基因105个,包含7个生物标记基因esr1、vtg1、vtg2、vtg3、chg-l、chg-h和chg-hm,7个报道过的雌激素响应基因klf3、cxcr3、chia.1、zgc:154058、nots、fam20c和apoebmgll,82个新发现的雌激素响应基因以及9个未命名的基因,这些新发现的基因表达量显著上调或下调,可以作为新的生物标记物。
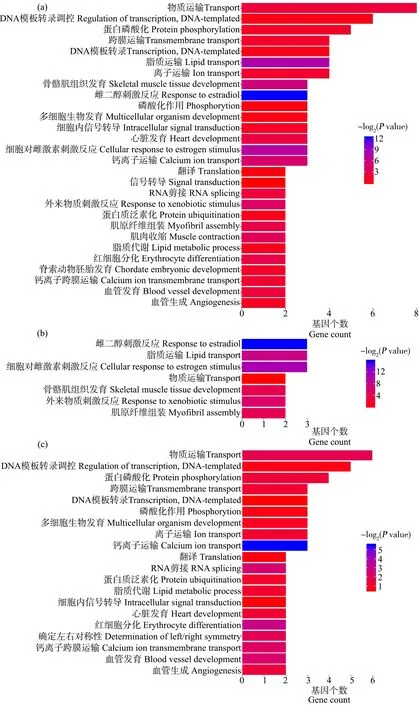
图3 差异表达基因GO富集分析注:(a)为总体差异表达基因;(b)为上调差异表达基因;(c)为下调差异表达基因。Fig. 3 GO enrichment analysis of differentially expressed genesNote: (a) total differentially expressed genes; (b) up-regulated differentially expressed genes; (c) down-regulated differentially expressed genes.
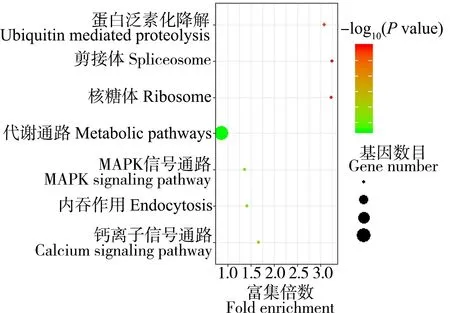
图4 差异表达基因KEGG富集分析Fig. 4 KEGG enrichment analysis of differentially expressed genes
GO和KEGG Pathway分析显示,差异表达基因主要参与了雌激素响应、脂质运输和代谢、转录调控、蛋白磷酸化、钙离子运输和信号传递等生物学过程以及蛋白泛素化降解、MAPK信号通路和钙离子信号通路,分子功能富集分析显示差异表达基因主要与脂质运输代谢和离子运输相关。Jin等[27]的研究证明了雌激素影响肝脏的脂质代谢。雌激素作用于肝细胞后,雌激素受体磷酸化程度增加,激活了MAPK信号通路,MAPK通路的激活增强了Ser-118和Ser-167的磷酸化[28]。雌激素可以引起内质网钙离子释放,钙离子可以参与ERK通路的活化[29-30]。
ESR1为雌激素受体,VTG和CHG是卵黄蛋白和卵壳蛋白的前体,影响鱼类的胚胎和幼体早期发育,对雌激素暴露反应敏感,常作为生物标记物[31]。本实验通过原代肝细胞培养来检测雌激素活性,RT-qPCR结果与转录组测序结果一致,证明中国青鳉原代肝细胞作为检测环境雌激素的实验方法可行。esr1、VTG和CHG基因在0.01~100 nmol·L-1E2浓度范围内都有很好的剂量效应关系,且VTG家族比CHG家族对雌激素的响应更灵敏,vtg1在0.1 nmol·L-1E2暴露后升高了70.81倍,vtg2在100 nmol·L-1E2暴露后升高了29 227.91倍。罗平[32]通过高效液相色谱法检测地表水中E2,检出限为0.04 μg·mL-1;Kovalchuk等[33]的酵母双杂交实验结果表明,E2最低浓度为1 nmol·L-1时与雌激素受体有相互作用,Tyler等[34]通过酶联免疫吸附试验(ELISA)测定了黑头软口鲦VTG的含量,建立了鱼早期发育阶段的雌激素体内检测体系,E2暴露浓度为100 ng·L-1时,VTG含量是对照组的100多倍。这些结果表明,原代细胞培养结合RT-qPCR的方法灵敏度高,对雌激素的响应明显。

图5 不同浓度雌二醇(E2)暴露下基因表达变化注:样本数n=3,与对照组相比,*P<0.05、** P<0.01。Fig. 5 Changes of gene expression in groups with different concentrations of estradiol (E2)Note: Number of samples, n=3, * P<0.05 and ** P<0.01 compared to control group.

