外泌体miR-940在前列腺癌骨转移中的作用
黄航 李萍 叶雪挺 陈伟 张方毅
前列腺癌(prostate cancer,PCa)是男性泌尿生殖系统最常见的恶性肿瘤,而且PCa病死人数占癌症总病死人数的3.8%[1]。2015年相关数据统计显示,我国PCa发病率及病死率逐年升高,达26.6/100万[2],确诊时多处于晚期,且出现远处转移[3]。骨转移是PCa最常见的转移方式,约90%的PCa病死患者合并骨转移[4]。成骨细胞、破骨细胞和间充质干细胞是骨微环境的重要组成部分[5],PCa细胞可以通过分泌骨形成蛋白、血管内皮生长因子、内皮素-1等骨促进因子来调节成骨细胞和破骨细胞分化,对骨转移前微环境进行重构[6-8]。因此,在治疗原发灶的同时,对播散的PCa细胞和潜在的转移前微环境进行针对性干预,有望遏制PCa骨转移灶的形成,改善晚期患者的预后。外泌体是一种直径约30~100 nm的细胞外囊泡[9],近年来研究证实是肿瘤微环境生态互动中的重要信使,它可以选择性地包裹特异的RNA、DNA、蛋白和脂类等物质,并被肿瘤细胞释放到细胞外,从而介导细胞间通讯[10]。肿瘤来源的外泌体释放入血循环后,可被靶器官的细胞摄取并定植,通过一系列信号分子启动与靶器官的生态互动,促进转移前微环境的重塑[11-12]。微小 RNA(microRNA,miRNA)是一类小片段非编码单链RNA,也是目前最受关注的外泌体信号分子。有证据表明,肿瘤细胞来源的miRNA可借助外泌体的“运载”到达靶器官,通过调控靶器官内其他细胞的基因表达来影响细胞表型及生物学功能,从而参与转移前微环境的构建[13-14]。另外,miRNA还可以通过调控成骨细胞或破骨细胞分化,重构骨微环境,在肿瘤骨转移过程中发挥至关重要的作用[15-17]。本研究将PC-3细胞经转染后与人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hMSC)共培养 48 h,检测成骨细胞分化相关基因表达及矿化面积占比,以探讨外泌体miR-940在PCa骨转移中的作用。
1 材料和方法
1.1 材料 (1)血清标本:2017年6月在温州医科大学附属第一医院就诊的3例正常老年男性及3例PCa骨转移患者的血清标本。(2)细胞株:PCa细胞株为PC-3细胞,正常前列腺上皮细胞株为RWPE-1细胞,购自中国科学院上海生命研究院细胞资源中心;hMSC购自深圳华拓生物科技有限公司。本研究经医院伦理委员会审查通过,血清标本的获取取得研究对象的知情同意。
1.2 主要试剂和仪器 蛋白质定量试剂盒(500-0005)购自美国Bio-Rad Laboratories公司;抗-VDAC(ab14734)、抗-D63(ab134045)、抗-Hsp70(ab2787)、抗-CD81(ab155760)购自美国Abcam公司;ECL试剂(320002)购自英国GE Healthcare公司;Trizol(100 ml,15596018)购自美国Invitrogen公司;逆转录试剂盒(RR047A)购自日本 TaKaRa 公司;miR-940 mimic、miR-940 inhibitor购自上海吉玛公司;InvitrogenTMLipofectamine 2000转染试剂购自美国Thermo Fisher公司;Transwell细胞培养小室(MCHT06H48)购自美国Sigma Aldrich公司。RTPCR仪(ABI7900)购自美国Applied Biosystems公司。
1.3 细胞培养 (1)PC-3细胞、RWPE-1细胞均用10% FBS-F12K培养基进行培养。FBS 4℃、120 000 g离心14 h,获得无外泌体FBS;待细胞生长至铺满培养皿80%~90%时,更换为无外泌体血清培养基进行培养,24 h后收集培养液上清液,待后续外泌体提取。(2)hMSC使用专用培养基(Corning)进行培养。
1.4 外泌体的提取和鉴定 (1)血清外泌体提取:血清4℃、300 g离心10 min,收集上清液;30 000 g离心20 min,经0.22 μm一次性滤器过滤后,收集上清液;120 000 g离心 90 min,弃上清液,100 μl PBS 重悬,分装,贮存于-80℃待用。(2)细胞外泌体的提取和鉴定:采用差速离心法。取细胞培养液上清液,300 g离心10 min,取上清液;2 000 g离心10 min,取上清液;10 000 g离心30 min,取上清液;100 000 g离心70 min,弃上清液,PBS重悬;100 000 g离心70 min,所得沉淀即外泌体。在透射电镜下,对获得的外泌体进行大小、形态鉴定;并用Western blot法检测外泌体标志性蛋白(VDAC、CD63、Hsp70、CD81)表达:用含蛋白酶抑制剂的细胞裂解液裂解细胞,提取蛋白,用蛋白质定量试剂盒定量。在聚丙烯酰胺凝胶电泳中,每个泳道上样40 μg蛋白并转移至PVDF膜上。用含0.1% Tween 20、5% BSA的Tris缓冲盐溶液(TBST)封闭膜 2 h;再用抗-VDAC、抗-CD63、抗-Hsp70和抗-CD81(1∶1 000稀释)4℃ 孵育过夜。次日TBST洗去抗体,PVDF膜分别与二抗结合(1∶2 000稀释)孵育2 h;洗去抗体,使用ECL试剂使膜上标记的抗体发生反应,暗室曝光,洗胶片,获得条带。
1.5 外泌体中miRNA表达检测 采用RT-PCR法。取血清外泌体或细胞外泌体标本,使用Trizol提取mRNA,逆转录试剂盒进行逆转录;利用ABI7900序列检测系统进行RT-PCR。采用2-ΔΔCt法计算目标基因与管家基因表达量的比值,即目的基因的相对表达量。
1.6 PC-3细胞转染与PCa-hMSC共培养体系的建立 将未处理的PC-3细胞以1×105个/孔接种于6孔板并补充2 ml相应培养基,待细胞生长至80%左右进行转染;将 50 nM siRNA(miR-940 mimic或 miR-940 inhibitor) 和 50 μl InvitrogenTMLipofectamine 2000 转染试剂加入到铺板的细胞中,分别为miR-940过表达组、miR-940敲减组,同时设置空白对照组;转染48 h。采用插入式Transwell细胞培养小室(0.4 μm孔径的6孔板)构建PCa-hMSC共培养体系,经转染的PC-3细胞以2.5×104个/孔接种于上室,hMSC 以 5×104个/孔接种于下室,共培养72 h后检测细胞外泌体成骨细胞分化相关基因表达;共培养28 d后去除培养基,hMSC经PBS漂洗后加入4%多聚甲醛固定,行Von Kossa染色。
1.7 成骨细胞分化相关基因表达检测 采用RTPCR法,实验步骤同1.5。成骨细胞分化相关基因包括 ALP、骨钙素(bone gamma carboxyglutamate protein,BGLAP)等。
1.8 矿化面积占比检测 采用Von Kossa染色。固定后的hMSC加入适量5%硝酸银染色液覆盖细胞表面,在紫外线直射60 min或直至肉眼可见黑色,去除染色液,蒸馏水漂洗数次;加入5%硫代硫酸钠溶液孵育2~3 min平衡定影,再次漂洗,行核固红复染5 min;在光学显微镜下观察黑色的钙沉积细胞(阳性细胞)区域,即矿化面积;计算矿化面积占比,公式为阳性细胞面积/总细胞面积×100%。
1.9 统计学处理 采用SPSS 24.0统计软件。计量资料均符合正态分布,两组间比较采用两独立样本t检验;多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 PCa骨转移患者与正常老年男性血清外泌体中miRNA表达比较 与正常老年男性比较,PCa骨转移患者血清外泌体中多个miRNA表达明显升高,其中miR-940尤为明显,见图1(插页);同时在Starbase数据库中得到进一步验证,见图2。

图1 PCa骨转移患者与正常老年男性血清外泌体miRNA表达谱(PCa为前列腺癌,miRNA为微小RNA;A、B、C为PCa骨转移患者;D、E、F为正常老年男性)

图2 Starbase数据库中前列腺癌(PCa)组织与正常前列腺组织miR-940表达比较
2.2 PC-3细胞外泌体形态观察及标志性蛋白表达在电镜下,PC-3细胞外泌体呈40~100 nm的盘状囊泡,见图 3a;外泌体标志性蛋白 VDAC、CD63、Hsp70、CD81表达均明显上调,见图3b。
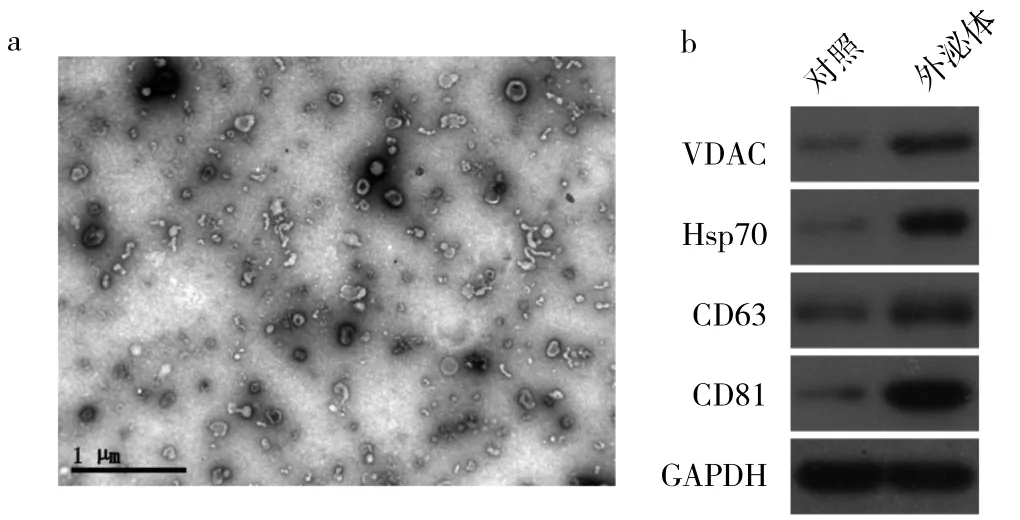
图3 电镜下PC-3细胞外泌体形态观察及标志性蛋白表达(a:电镜下所见,×10 000;b:标志性蛋白表达的电泳图)
2.3 PC-3细胞与RWPE-1细胞外泌体中miR-940表达比较 PC-3细胞外泌体中miR-940表达明显高于RWPE-1细胞外泌体,差异有统计学意义(P<0.05),见图4。

图4 PC-3细胞与RWPE-1细胞外泌体中miR-940表达比较(与PC-3细胞外泌体比较,*P<0.05)
2.4 PCa细胞外泌体miR-940过表达对骨转移前微环境的影响 在PCa-hMSC共培养体系中,miR-940过表达组ALP、BGLAP基因表达及矿化面积占比较miR-940敲减组、空白对照组明显降低,差异均有统计学意义(均P<0.05),见图 5a-d(插页)。
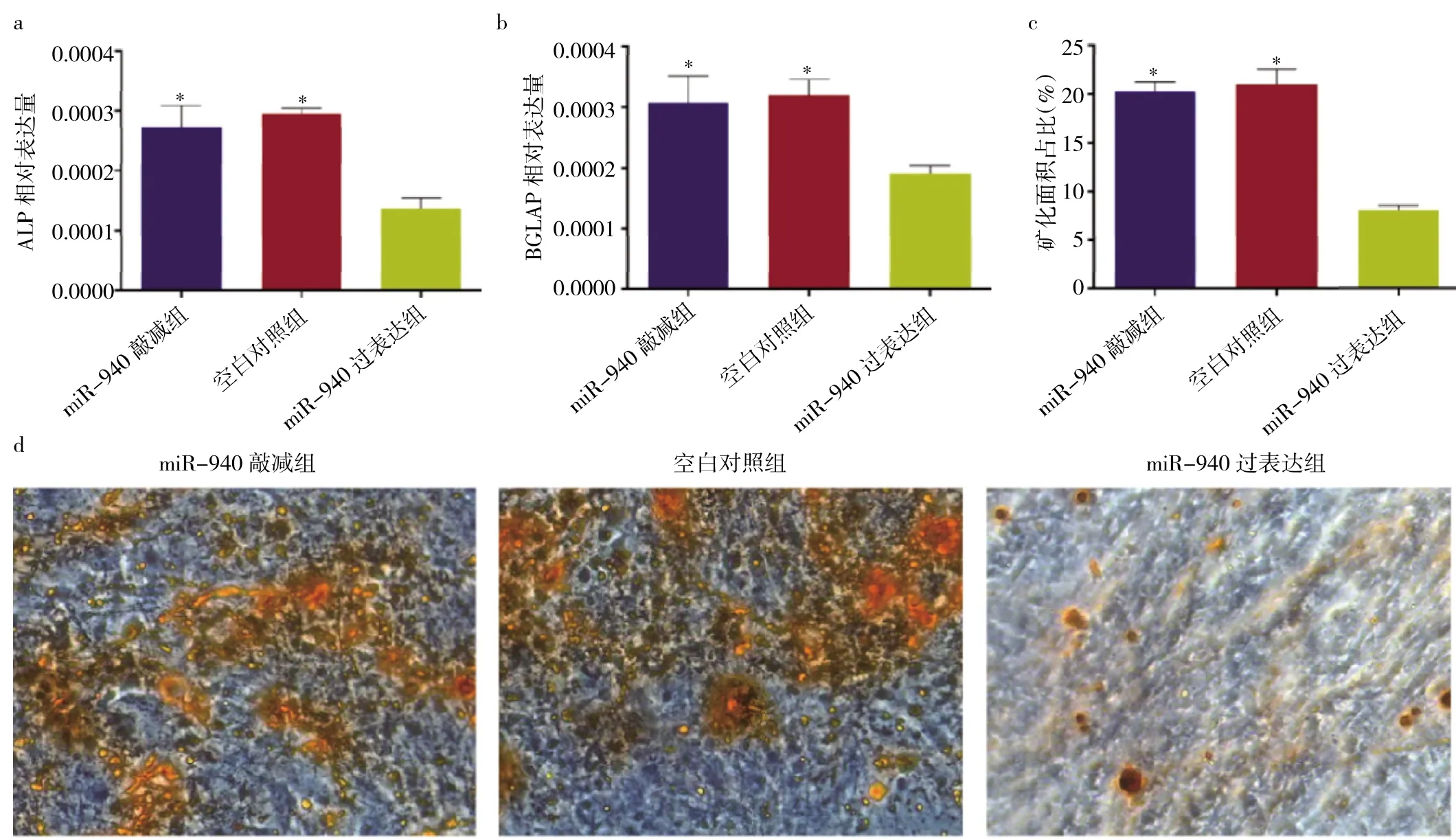
图5 PCa细胞外泌体miR-940过表达对骨转移前微环境的影响(PCa为前列腺癌,BGLAP为骨钙素;a:ALP基因表达比较,与miR-940过表达组比较,*P<0.05;b:BGLAP基因表达比较,与miR-940过表达组比较,*P<0.05;c:矿化面积占比比较,与miR-940过表达组比较,*P<0.05;d:Von Kossa染色所见,×100)
3 讨论
大部分PCa患者会发生成骨细胞型骨转移。分子介导的信号传导途径可能是预防或治疗成骨细胞型骨转移的潜在靶标。关于PCa与骨骼之间沟通的介体,目前有研究提出了多种机制[18]。例如PCa通过旁分泌的方式,使可溶性蛋白与骨骼之间产生相互作用,从而诱导溶骨或成骨细胞活性,进而导致骨骼重塑,影响PCa转移生长的骨基质[19]。另有研究表明,骨髓能释放基质衍生因子-1,增强PCa细胞到骨髓的转移[20]。癌细胞分泌的miRNA可以修饰肿瘤微环境,促进肿瘤的发生、发展和转移[21]。而它通过外泌体在细胞间进行传递,从而影响受体细胞的表型[22]。研究表明,外泌体可以将生物分子(如蛋白质、miRNA和mRNA等)转移到不同的细胞[23],其中来自原发肿瘤的外泌体可增强转移。有证据显示,原发性黑色素瘤的外泌体通过增加基质细胞中MET癌基因的表达来培育骨髓间质,从而促进骨转移[24]。因此,本文就PCa来源外泌体在骨转移前微环境中的作用进行探讨。
目前关于PCa细胞释放的外泌体携带何种特异性的miRNA信息,其能否通过调控转移前微环境介导骨转移的发生、发展鲜有报道。本研究首先通过正常老年男性及PCa骨转移患者血清外泌体miRNA表达谱,结合Starbase数据库中既往报道参与调控PCa侵袭转移的miRNA研究,筛选出了存在显著表达差异的外泌体miR-940。然后通过体外实验比较了PCa细胞株PC-3与正常前列腺上皮细胞株RWPE-1外泌体中miR-940表达;再转染PC-3细胞并建立PCa-hMSC共培养体系,观察了PCa细胞外泌体miR-940过表达对骨转移前微环境的影响。本研究结果显示,PC-3细胞外泌体中miR-940表达明显高于RWPE-1细胞外泌体;在PCahMSC共培养体系中,miR-940过表达组ALP、BGLAP基因表达及矿化面积占比较miR-940敲减组、空白对照组均明显降低;这提示PCa细胞来源的外泌体miR-940有望成为逆转骨转移前微环境重构、抑制PCa骨转移形成的潜在靶点。
综上所述,外泌体miR-940可以有效抑制PCahMSC成骨分化,这为转移性PCa个体化治疗提供了新的靶点。但是其调控PCa骨转移前微环境的分子机制尚未研究,笔者将进一步筛选出存在潜在调控的基因,验证miR-940与候选靶基因是否存在直接的靶向关系,探讨具体调控机制。

