前列腺癌组织中驱动蛋白5的表达及其与5年进展和生化复发的关系
徐礼臻 朱再生 徐旻
近年来,我国前列腺癌发病人群日趋年轻化,但关于前列腺癌的病因仍未完全阐明。癌基因在肿瘤的发生、发展中发挥着重要作用,研究发现驱动蛋白5(kinesin-5,Eg5)基因存在于所有真核细胞中,具有ATP酶活性,在有丝分裂过程中对双极轴的形成和维持起重要作用,参与多种肿瘤的发生和发展[1-2],但它在前列腺癌中的作用尚未阐明。本研究对前列腺癌组织及前列腺增生组织中Eg5蛋白表达进行了检测与比较,同时分析了不同临床病理特征的前列腺癌患者Eg5蛋白阳性表达率,还分析了Eg5蛋白表达阳性与阴性的前列腺癌患者累计5年进展及生化复发情况,现将结果报道如下。
1 对象和方法
1.1 对象 收集浙江大学医学院附属金华医院2001至2011年手术治疗的前列腺癌65例和前列腺增生38例患者的临床资料和病理组织标本。65例前列腺癌患者年龄 54~78(65.5±4.5)岁;Gleason 评分<7 分 32 例,≥7分33例;按照2002年美国癌症联合委员会的TNM临床分期标准,Ⅰ~Ⅱ期41例,Ⅲ~Ⅳ期24例;术前均未接受过放化疗和内分泌治疗。前列腺增生患者年龄53~79(66.2±4.3)岁。两组患者年龄比较,差异无统计学意义(P>0.05)。本研究经医院伦理委员会审查通过。
1.2 Eg5蛋白表达的检测 采用免疫组化SP法。所有标本经10%甲醛固定,石蜡包埋,3 μm厚连续切片,使用SP试剂盒、DAB显色剂(均购自北京中杉生物技术公司)进行免疫组化染色,二甲苯脱蜡,依次梯度乙醇水化,加入兔抗人 Eg5 一抗(工作浓度 1:100,规格:100 μg,批号:abs7431),4 ℃孵育过夜,PBS洗 3次,5 min/次;滴加二抗(生物素标记)室温孵育0.5 h;PBS洗3次,5 min/次;DAB显色、苏木素复染,封片,在光镜下观察。使用PBS缓冲液代替一抗作为阴性对照。结果判定:细胞质出现褐色颗粒为阳性表达。由2位经验丰富的病理科医生参照Sulzers表达分级法对实验结果进行判断:几乎无阳性表达细胞为(-),阳性表达细胞数<10%为(+),阳性表达细胞数 10%~50%为(++),阳性表达细胞数>50%为(+++);其中阳性表达细胞数≥10%判定为阳性表达。
1.3 相关标准 临床进展是指影像学检查提示局部病灶进展及转移灶数目增多;生化复发是指血清前列腺特异抗原水平升高,达到0.2 μg/L。
1.4 统计学处理 采用SPSS 23.0统计软件。计数资料用率表示,组间比较采用χ2检验。绘制Kaplan-Meier曲线,采用log-rank法比较Eg5蛋白表达阳性与阴性的前列腺癌患者累计5年进展率及生化复发率。P<0.05为差异有统计学意义。
2 结果
2.1 前列腺增生组织和前列腺癌组织Eg5蛋白表达的免疫组化染色结果 Eg5主要表达在细胞质,在细胞核中表达较少;前列腺癌组织中Eg5表达高于前列腺增生组织,见图1(插页)。
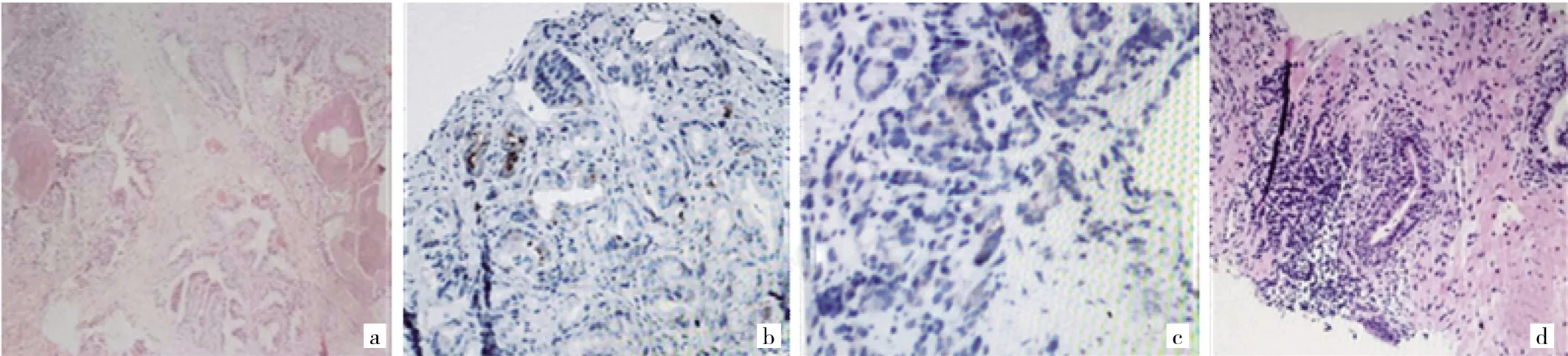
图1 前列腺增生组织和不同Gleason评分前列腺癌组织中驱动蛋白5(Eg5)蛋白表达(a:在前列腺增生组织中的表达;b:在Gleason评分7分的前列腺癌组织中的表达;c:在Gleason评分8分的前列腺癌组织中的表达;d:在Gleason评分9分的前列腺癌组织中的表达;免疫组化染色,×100)
2.2 前列腺增生组织与前列腺癌组织中Eg5蛋白阳性表达率比较 前列腺癌组织中Eg5蛋白阳性表达率为69.23%(45/65),明显高于前列腺增生组织中的阳性表达率15.79%(6/38),差异有统计学意义(χ2=27.398,P<0.05)。
2.3 不同临床病理特征的前列腺癌患者癌组织中Eg5蛋白阳性表达率比较 不同Gleason评分、临床分期以及有无5年进展、5年生化复发的患者前列腺癌组织中Eg5蛋白阳性表达率比较,差异均有统计学意义(均P<0.05),其中Gleason评分≥7分、临床分期Ⅲ~Ⅳ期、5年进展、5年生化复发的患者Eg5蛋白阳性表达率较高,见表1。
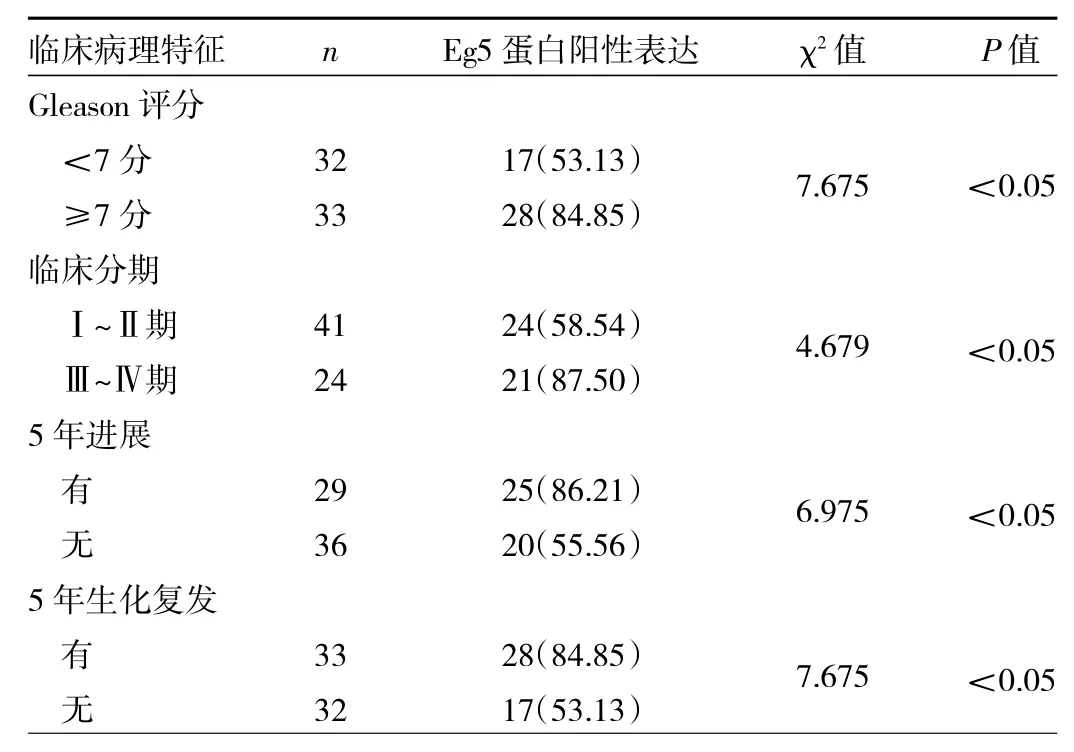
表1 不同临床病理特征的前列腺癌患者癌组织中Eg5蛋白阳性表达率比较[例(%)]
2.4 Eg5蛋白表达阳性与阴性的前列腺癌患者累计5年进展率及生化复发率比较 Eg5蛋白表达阳性患者累计5年进展及生化复发率均明显高于Eg5蛋白表达阴性患者,差异均有统计学意义(χ2=3.969、4.924,均P<0.05),见图 2。
3 讨论

图2 驱动蛋白5(Eg5)蛋白表达阳性与阴性的前列腺癌患者累计5年进展及5年生化复发的Kaplan-Meier曲线
Eg5在细胞有丝分裂过程中起着重要作用[3]。Eg5是一个对肿瘤有潜在治疗作用的靶点基因,体外研究表明抑制Eg5表达可抑制乳腺癌、肺癌、结肠癌、卵巢癌细胞的增殖和迁移[4-6]。由于Eg5抑制剂对ATP不具竞争性抑制,通过与远离ATP结合位点结合而起变构抑制剂的作用,不存在与ATP竞争性激酶抑制剂相同的作用机制[7-8]。因此,利用Eg5抑制剂可以明显增强抑癌基因的作用。最近有研究发现Eg5高表达可以增强肿瘤浸润和肿瘤血管形成,其作用机制可能与Eg5可阻断CD4+T细胞从而影响肿瘤细胞的周期,进而影响肿瘤的发生、进展和血管形成有关[9]。抑制Eg5后,多西紫杉醇的抗癌活性明显增强,耐药性降低。研究发现,Eg5抑制剂对激素难治性前列腺癌以紫杉醇为基础的化疗有明显疗效,与微管靶向药物相比,可以增强紫杉醇疗效且降低其毒性[10]。虽然Eg5基因异常表达对肿瘤的作用机制至今尚未清楚,但有实验结果显示具有E3泛素连接酶活性的Parkin蛋白对Hsp70-JNK-c-Jun信号传导通路进行负向调控,Parkin可催化Hsp70泛素化,造成蛋白激酶JNK活性丧失,使c-Jun无法与Eg5启动子AP1位点结合,从而下调Eg5基因表达[11]。因为Eg5在神经细胞中不表达,Eg5抑制剂较多西紫杉醇毒副反应更小,耐药性更低[12]。可见,Eg5抑制剂在前列腺癌中有更广阔的应用前景。本研究对Eg5在前列腺癌中的作用方式及作用机制进行研究,具有重要意义。
研究发现,Eg5是细胞有丝分裂周期中一个重要的驱动蛋白,在细胞质分裂中纺锤体形成、定位、染色体分离中起重要作用。Liu等[13]采用qPCR法对肝癌组织及癌周正常组织进行Eg5表达检测与比较,同时对肝癌组织进行免疫组化分析,探讨Eg5表达与肝癌临床病理因素及预后的关系,结果显示Eg5 mRNA和蛋白在肝癌组织中的表达水平明显高于癌周正常组织(P<0.05),同时Eg5蛋白表达与肝硬化(P=0.038)和肝癌TNM分期(P=0.008)密切相关;Kaplan-Meier生存曲线分析显示Eg5蛋白表达与肝硬化(P=0.000)和肝癌TNM分期(P=0.025)密切相关;Cox回归模型分析显示Eg5表达是预测肝癌患者生存的独立预后因素(P=0.001)。陈杰勋等[14]对Eg5在膀胱癌中的表达进行了研究,通过靶向干扰Eg5基因对膀胱癌T24细胞的生物学功能进行研究,研究发现靶向干扰Eg5基因后,T24细胞增殖和迁移明显被抑制,T24细胞凋亡增加。国外相关文献报道Eg5在肿瘤中的作用机制与作用于肿瘤细胞迁移和血管生成有关,其机制可能是参与了免疫调节和蛋白质翻译过程;在前列腺癌PC-3细胞中应用Eg5抑制剂K858(1,3,4-噻二唑啉类似物、驱动蛋白Eg5抑制剂)可以抑制PC-3细胞生长,G2/M细胞周期受到阻滞[15]。本研究采用免疫组化染色法检测了前列腺癌组织与前列腺增生组织中Eg5蛋白表达,结果显示前列腺癌组织中Eg5蛋白表达阳性率明显高于前列腺增生组织;分析不同临床病理特征的前列腺癌患者癌组织中Eg5蛋白阳性表达率,发现Gleason评分≥7分、临床分期Ⅲ~Ⅳ期、5年进展、5年生化复发的患者Eg5蛋白阳性表达率较高。进一步绘制Kaplan-Meier曲线,发现Eg5蛋白表达阳性患者累计5年进展及生化复发率均明显高于Eg5蛋白表达阴性患者,表明Eg5在前列腺癌的发生、发展中起重要作用。
综上所述,前列腺癌组织中Eg5蛋白呈高表达,其表达与前列腺癌Gleason评分、临床分期、5年临床进展和5年生化复发有关。然而,其确切机制尚未阐明,今后可从细胞学水平系统研究Eg5在前列腺癌细胞系中的表达及作用机制,为前列腺癌的治疗探寻新途径。

