铂钯精矿中氯化银的浸出预处理研究
徐 娟,张福元,丁 丁
铂钯精矿中氯化银的浸出预处理研究
徐 娟,张福元*,丁 丁
(安徽工业大学 冶金工程学院,安徽 马鞍山 243032)
铜阳极泥分铜液所得铂钯精矿中的银主要以氯化银(AgCl)形态存在,可用氨水或亚硫酸钠作为浸出剂去除银。绘制了Ag+与NH3、SO2- 3配体组分图,结合电位-pH图分析表明,氨浸的pH值范围为7.7~13.5,亚硫酸钠浸出宜在中性或碱性条件下进行。优化条件实验结果表明,银的氨浸浸出率为95.3%,碲浸出率为14.9%,有微量铂、钯浸出;以亚硫酸钠为浸出剂,银的浸出率为97.3%,碲浸出率为11.5%,金、铂和钯均不被浸出。亚硫酸钠更适于作为铂钯精矿预处理除银的浸出剂。
铂钯精矿;氯化银;氨水;亚硫酸钠;浸出
铜阳极泥作为火法铜冶炼系统的电解副产物,含有多种不同品位的贵金属金、银、铂、钯,以及硒、碲、铜、铅、铋等高价值元素而具有重要的回收价值[1-5]。目前,工业上应用成熟、经典的铜阳极泥预处理工艺主要有2种[6]:一是铜阳极泥氧压预浸除杂[7],二是硫酸化焙烧脱硒-酸浸脱铜。硫酸化焙烧渣中碲、砷、铋、铁等杂质元素在酸浸脱铜过程部分溶解在分铜液中,并溶解一定量具备工业回收价值的金、银、铂和钯等贵金属[8-9]。
本文作者团队发明了一种稀贵金属复合还原剂的制备方法[10],并成功应用在分铜液中金、银、铂和钯的高效还原富集[11],得到了高品位铂钯精矿。该铂钯精矿的主要成分为砷、铁、铋、碲和银等元素,铂、钯的合计品位近3000 g/t。为进一步富集高价值贵金属元素,避免在金、铂、钯湿法回收过程中银的分散损失,应将品位较高、价值相对较低的银首先分离回收。对于铜阳极泥中银的分离回收工艺主要有氨浸-水合肼还原法[12-13]、亚硫酸钠浸出-甲醛还原法[14-15]。氨对多种重金属离子均有很强的络合能力,易导致还原银粉中杂质含量较高,同时氨气逸出恶化操作环境、高浓度氨氮废水不易处理;亚硫酸钠对银具有很强的选择性但络合能力较氨弱,还原后液可重复循环利用但需定期开路除杂。
关于铜阳极泥浸银的研究报道[16-18]较多,由于本研究物料的特殊性,需在去除银的同时减少碲的浸出分散。本文对氨浸和亚硫酸钠浸银的过程进行分析,绘制浸出中间物相组态和配离子的关系曲线,通过实验对比2种体系中的浸出行为,为该铂钯精矿的预处理提供参考。
1 实验部分
1.1 实验原料
铂钯精矿由国内某铜冶炼厂铜阳极泥分铜液还原所得,该精矿由于洗涤不彻底而含有一定可溶性杂质。控制液固比4:1,在85℃左右搅拌水浸,能够除去其中的可溶性盐类,滤饼经过水洗、筛杂过滤,用真空干燥箱烘干,物料为浅黄色粉末状。经磨细、混合、缩分后作为实验用铂钯精矿原料,其多元素分析结果如表1所示。
表1 铂钯精矿的多元素分析结果

Tab.1 Multi-element analysis results of platinum-palladium concentrate /%
表1数据中,As、Fe、Bi为XRF半定量测定结果,碲为K2Cr2O7滴定法所得,银采用火试金重量法测定,贵金属金、铂、钯采用火试金-ICP联合法测定。由表1可知,铂钯精矿主成分砷、铁、铋、碲和银合计质量分数为95.5%。贵金属金、铂和钯分别为0.013%、0.060%和0.234%,银含量为7.02%。XRD分析表明该铂钯精矿[11]中的银主要以AgCl物相存在,其他组分主要为非晶态;SEM观察发现其微观结构为片状或块状结晶颗粒及无规则的细微颗粒状。
1.2 实验步骤
量取定量浸出液于烧杯中,再加入一定量实验用铂钯精矿,搅拌条件下反应至预定时间,进行固液分离,滤饼洗涤后烘干、称重,计算渣率,滤液与洗涤液合并,定容后用于定量测定。
1.3 分析检测
溶液中微量元素采用电感耦合等离子体原子发射光谱仪(ICP-AES)测定,固体物料中的银采用火试金重量法测定,金、铂、钯品位采用火试金富集-ICP-AES测定,常量碲品位采用K2Cr2O7滴定法测定。固体样品采用X-射线荧光光谱仪(XRF,ARL Advant'X Intellipower 3600型)进行半定量分析。
2 浸出过程组态分析
2.1 氨浸过程银络合物组态及电位-pH图
AgCl溶于氨水形成[Ag(NH3)]+和[Ag(NH3)2]+两种形态的络合物,其lgβ分别为3.24和7.05,根据金属离子逐级解离平衡常数,可得络合形态的分布分数()与稳定常数()和配体氨浓度()之间的关系如下:

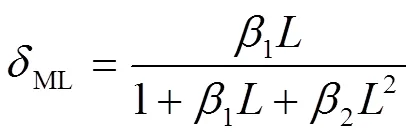
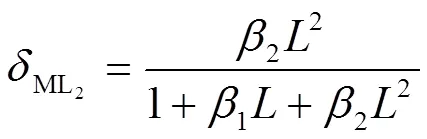
根据式(1)~(3),绘制银离子络合组态和配体氨浓度之间的关系曲线,如图1所示。
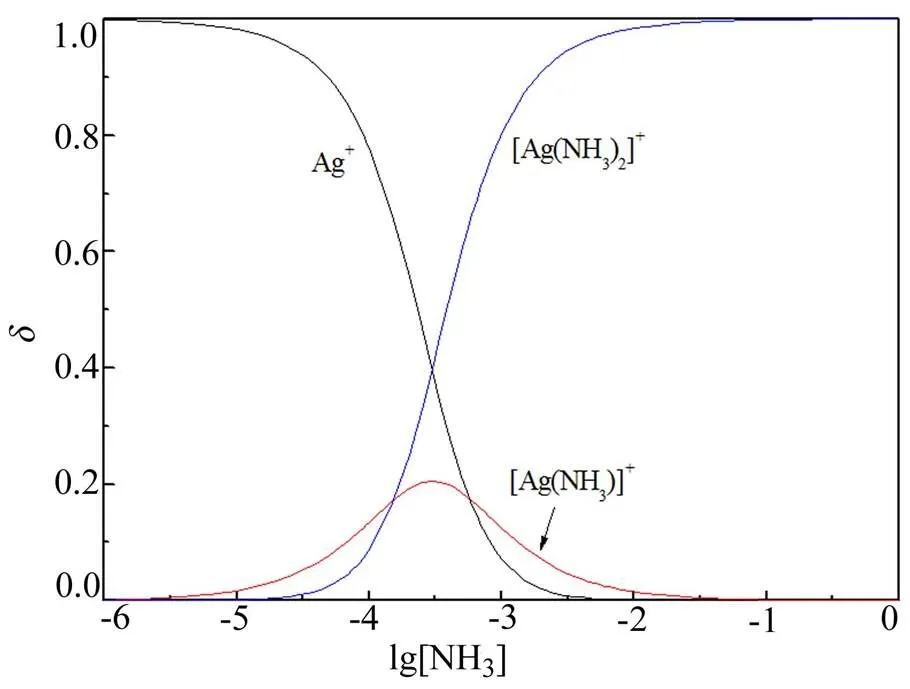
图1 银离子络合组态与氨浓度关系曲线
由图1可知,氨浓度([NH3])小于10-6mol/L时,银主要以Ag+形式存在,占比大于99%;随[NH3]增大,Ag+占比逐渐减少,逐渐有[Ag(NH3)]+生成,在[NH3]=10-5mol/L时Ag+和[Ag(NH3)]+组态占比分别为98%和1.7%,并开始有[Ag(NH3)2]+生成;[NH3]增大到3×10-4mol/L时,[Ag(NH3)]+组态占比达到最大值为20.6%,此时Ag+和[Ag(NH3)2]+具有相同组分数为39.7%。[NH3]继续增大,Ag+和[Ag(NH3)]+组分进一步减少,[Ag(NH3)2]+占比继续增大,当[NH3]大于0.1 mol/L时,[Ag(NH3)2]+占比大于99%。根据氨在水中的解离平衡:
NH3+H2O⇌ NH+ 4+OH-b=1.8×10-5(4)
利用式(4)可求得:
[OH-]=(b)1/2=(0.1×1.8×10-5)1/2=1.3×10-3mol/L (5)
计算得到pH=11.11。据此可知,利用氨络合银浸出AgCl,pH≈11为较理想的条件。为了进一步明确氨水浸出银的条件控制范围,绘制AgCl-NH3- H2O系的电位-pH图(-pH)如图2所示。
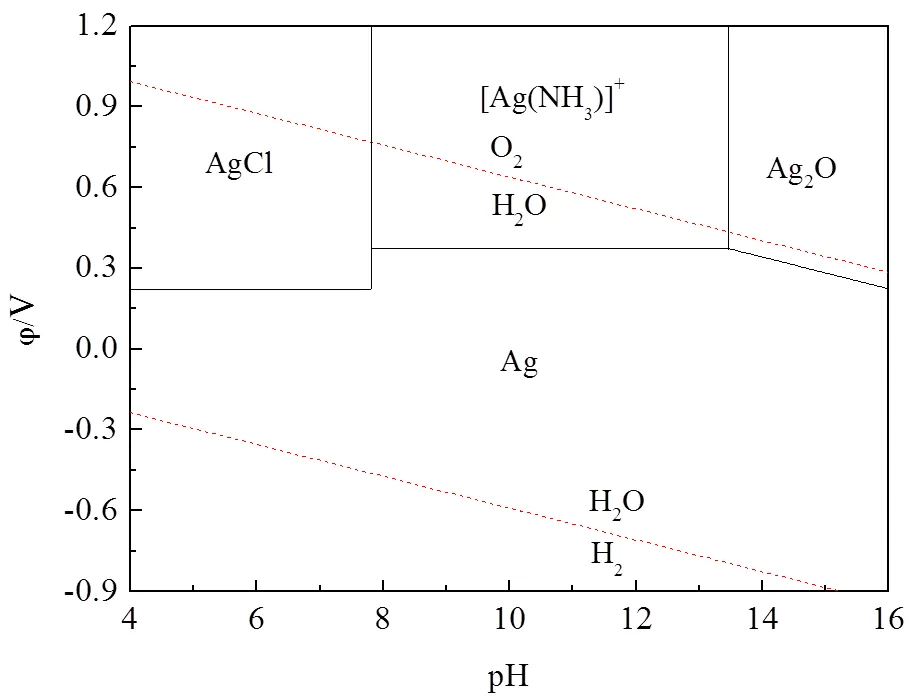
图2 AgCl-NH3-H2O系的φ-pH图
(25℃,[Ag+]=[Cl-]=0.3 mol/L,[NH3]=1 mol/L)
由图2可知,在pH<7.7时,银主要以AgCl形态存在;pH>7.7时AgCl能与NH3络合,开始生成银氨络离子;当pH>13.5时银氨络离子转化为非可溶性的氧化银析出。因此,氨浸银过程需将pH控制在7.7~13.5范围内。
2.2 亚硫酸根浸银过程银络合物及亚硫酸组态图
银离子能够与亚硫酸根形成[Ag(SO3)]2n-1(=1, 2, 3)络合物,lgβ为5.60、8.68和9.00,根据金属离子逐级解离平衡常数,绘制银离子络合组态和配体亚硫酸根浓度之间的关系曲线,如图3所示。
由图3可知,[SO2- 3]<10-7mol/L时,银主要以Ag+组态存在;随着[SO2- 3]增大,Ag+逐渐络合SO2- 3,形成[Ag(SO3)]-络合物;[SO2- 3]=4.5×10-5mol/L时,[Ag(SO3)]-络合物组分占绝对优势,达到90%,同时有Ag+和[Ag(SO3)2]3-组态共存。[SO2- 3]=8.5×10-4mol/L时,[Ag(SO3)]-和[Ag(SO3)2]3-组态共存,各占约50%;[SO2- 3]继续增大,[Ag(SO3)2]3-络合物组分增加,[SO2- 3]=2.0×10-2mol/L时,[Ag(SO3)2]3-组态占绝对优势,达92%,同时有[Ag(SO3)]-和[Ag(SO3)3]5-组态共存。[SO2- 3]进一步增大,[Ag(SO3)2]3-组态逐渐减少、[Ag(SO3)3]5-组态逐渐增加,[SO2- 3]=0.48 mol/L时,[Ag(SO3)2]3-和[Ag(SO3)3]5-组态共存,各占约50%。在采用亚硫酸钠浸出AgCl时,浸出剂浓度一般控制在2 mol/L左右,此时浸出液中银主要以[Ag(SO3)2]3-和[Ag(SO3)3]5-两种组态共存,并以[Ag(SO3)3]5-形态为主。

图3 银离子络合组态与[SO2- 3]配体浓度关系曲线
为了明确亚硫酸钠浸出银的条件控制范围,绘制了亚硫酸不同解离形态与溶液pH之间的关系曲线,如图4所示。
由图4可知,在溶液pH小于0的强酸性溶液,亚硫酸主要以分子形态存在,随pH的升高逐渐解离出氢离子,形成亚硫酸根离子,在pH=3.5~5时亚硫酸氢根组分占比达到99%以上,在pH=5时开始有少量的SO2- 3产生,所以亚硫酸钠浸出AgCl的pH至少要大于5,才有足够浓度的SO2- 3与AgCl络合形成[Ag(SO3)2]3-,当pH增加到7左右时,溶液中亚硫酸氢根和亚硫酸根的组分各占50%,在pH大于9时,溶液中的亚硫酸全部形成亚硫酸根离子。采用亚硫酸钠浸出AgCl在宜在中性或碱性体系进行,增大溶液中SO2- 3浓度和减少Cl-浓度亦利于AgCl的浸出。

图4 亚硫酸不同解离形态与溶液pH关系曲线图
3 实验结果与讨论
3.1 氨浸结果
3.1.1浸出时间的影响
量取8%的氨水50.0 mL,倒入100 mL烧杯中,加入5.00 g铂钯精矿,常温搅拌浸出,考察浸出时间对渣率及银、碲浸出率的影响,结果如图5所示。

图5 氨浸时间对渣率及银、碲浸出率的影响
由图5可知,采用8%的氨水对铂钯精矿进行浸出,其渣率基本稳定在86.5%~88.5%。银浸出率在浸出0.5 h时为94.0%,且随浸出时间的增加银浸出率呈逐渐减小的趋势,4 h时浸出率只有86.7%。原料中银的主要物相为AgCl,在氨浸过程中AgCl溶解形成[Ag(NH3)2]+,产生大量游离的氯离子。氯离子具有与[Ag(NH3)2]+结合形成AgCl沉淀的趋势,二者达到动态平衡后浓度保持不变。随着反应时间延长,由于NH3的挥发,导致溶液中[NH3]降低,致使[Ag(NH3)2]+减少,溶解的银重新生成AgCl沉淀,导致银的浸出率降低。碲的浸出率在0.5 h时为9.05%,随时间的增加浸出率逐渐增加,4 h时浸出率增加到14.8%。碲的浸出主要形成亚碲酸钠(Na2TeO3),随时间延长氨与银络合后释放出游离的OH-,有利于碲的浸出。
为了使银进入到溶液中而碲保留在渣中,选择不大于0.5 h为适宜的浸出时间。
3.1.2氨浓度的影响
量取不同浓度的氨水50 mL,倒入100 mL烧杯中,加入5.00 g铂钯精矿,常温搅拌浸出0.5 h,考察氨浓度对渣率及银、碲浸出率的影响,结果如图6所示。

图6 氨浓度对渣率及银、碲浸出率的影响
由图6可知,浸出渣率随氨浓度的增加呈逐渐减小趋势,银的浸出率随氨浓度的增加呈逐渐增大的趋势。氨浓度由5%增加到9.5%时,银的浸出率由94.4%增加到97.1%,再提高氨浓度银的浸出率变化不大。氨浸过程中,AgCl与NH3络合形成银氨络离子,由图3可知主要形成[Ag(NH3)2]+,当氨浓度达到9.5%(5.6 mol/L,lg[NH3]=0.75)时基本达到AgCl的溶解和析出平衡。碲的浸出率随氨浓度的增加呈先增加后降低的趋势,在氨浓度为9.5%达到最高浸出率为28.6%。氨浸过程中NH3主要以分子形态与Ag+结合,部分NH3水解形成NH4+和OH-,对碲起到浸出溶解作用;随氨浓度的增加,溶液中OH-增加,碲的浸出率增加。当氨浓度为9.5%时银的浸出溶解达到动态平衡,再增加氨浓度时氨的挥发性增强,导致碲的浸出率逐渐降低。综合考虑选择氨浓度为9.5%。
3.1.3浸出液固比的影响
量取不同体积9.5%氨水,倒入100 mL烧杯中,加入5.00 g铂钯精矿,常温搅拌浸出0.5 h,考察液固比(mL/g)对渣率及银、碲浸出率的影响,结果如图7所示。
由图7可知,采用不同的液固比对原料进行浸出,渣率基本稳定在85%~87%。银的浸出率随液固比的增加总体上呈逐渐增大的趋势,当液固比为7:1时浸出率在94%左右;碲的浸出率在所取液固比范围内基本维持在12%~14%。综合考虑选取浸出液固比为7:1。

图7 液固比对渣率及银、碲氨浸出率的影响
3.1.4优化条件实验
根据上述实验参数进行优化浸出实验(=2)。量取9.5%氨水倒入烧杯,加入5.00 g铂钯精矿,控制浸出液固比7:1,常温搅拌浸出0.5 h后固液分离,滤液用稀硝酸定容到250 mL后分析检测。浸出渣率为87.8%,渣中银品位降至0.38%、碲品位为16.1%,银浸出率达到95.3%,碲浸出率为14.9%,浸出液分析结果如表2所列。
表2 优化条件浸出液结果

Tab.2 Leaching solution results of optimized conditions /(mg/L)
由表2可知,氨浸银过程碲的分散不利于后续碲回收。浸出液中碲和砷的浓度分别为201.3和348.8 mg/L,铂和钯浓度分别为0.031和0.046 mg/L,金基本未溶出。
3.2 亚硫酸钠浸出结果
采用氨水浸出铂钯精矿过程中,除了银具有较高浸出率外,碲和铂、钯也有部分溶出,为了选取更理想的分银工艺,采用亚硫酸钠作为浸出剂考察多金属浸出情况。
3.2.1浸出时间的影响
量取20 mL 280 g/L的亚硫酸钠溶液,倒入100 mL烧杯中,加入5.00 g铂钯精矿,常温搅拌浸出,考察浸出时间对渣率及银、碲浸出率的影响,结果如图8所示。
由图8可知,采用280 g/L的亚硫酸钠溶液对原料进行浸出,浸出渣率随时间延长呈先增加后减少的趋势;浸出时间为1 h时渣率为88.0%,2~3 h时基本稳定(90.8%),4 h时渣率降至87.9%。银和碲的浸出率随时间的增加基本为逐渐增加的趋势,1 h时银和碲的浸出率分别为92.0%、8.06%,2 h后银和碲的浸出率分别增加到97.5%和9.69%,浸出基本达到动态平衡,银的浸出率随时间增加基本保持稳定,而碲的浸出略有增加。综合考虑,选取2 h为适宜的搅拌浸出时间。

图8 亚硫酸钠浸出时间对渣率及银、碲浸出率的影响
3.2.2亚硫酸钠浓度的影响
量取不同浓度的亚硫酸钠溶液20 mL,倒入100 mL烧杯中,加入5.00 g铂钯精矿,常温搅拌2 h,考察亚硫酸钠浓度对渣率及银、碲浸出率的影响,结果如图9所示。
由图9可知,采用不同浓度的亚硫酸钠溶液对原料进行浸出,银浸出率随亚硫酸钠浓度的增加而缓慢升高;亚硫酸钠浓度为190 g/L时银浸出率为95.2%,亚硫酸钠浓度增加到220 g/L时银浸出率达到96.4%,再增加亚硫酸钠浓度银浸出率增加缓慢。碲的浸出率随亚硫酸钠浓度的增加呈逐渐增加的趋势,当亚硫酸钠浓度为190 g/L时,碲的浸出率为8.01%,增加亚硫酸钠浓度有利于增加溶液碱度,同时也增加碲的浸出率,为了不使稀散金属碲分散,兼顾银的浸出率,选择亚硫酸钠浓度220 g/L为宜。
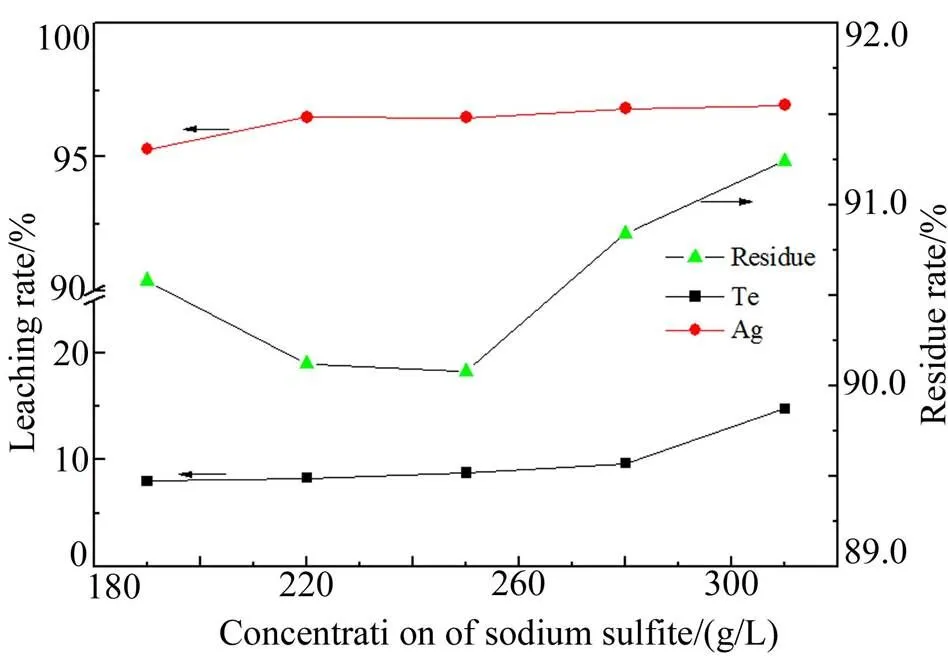
图9 亚硫酸钠浓度对渣率及银、碲浸出率的影响
3.2.3浸出液固比的影响
量取一定体积220 g/L的亚硫酸钠溶液,倒入100 mL烧杯中,加入5.00 g铂钯精矿,常温搅拌浸出2 h,考察液固比(mL/g)对渣率及银、碲浸出率的影响,结果如图10所示。
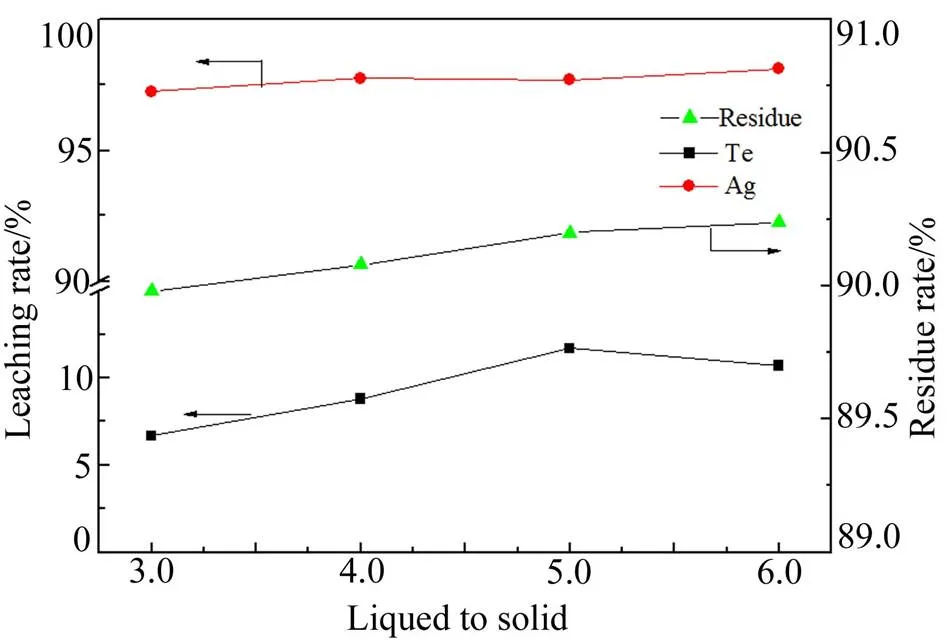
图10 浸出液固比(mL/g)对渣率及银、碲浸出率的影响
由图10可知,采用不同液固比对铂钯精矿进行浸出,其渣率随液固比的增加基本变化不大,保持在90%左右。银的浸出率随液固比的增加总体上呈逐渐增大的趋势,碲的浸出率在液固比为5:1时较高(11.7%)。增加浸出液固比能够降低单位体积固含量、降低溶液粘度,同时有利于增加固体颗粒的分散,从而增加反应速率。尤其是浸出反应速控步骤为扩散控制时,增加液固比提高搅拌速度有利于加快反应速率;但过大的浸出液固比降低溶液中目标离子的浓度,同时降低单位体积有效处理量。综合考虑银、碲浸出率,选取5:1为适宜的浸出液固比。
3.2.4优化条件实验
量取220 g/L的亚硫酸钠溶液25 mL,倒入100 mL烧杯中,准确加入5.00 g铂钯精矿,常温搅拌2 h浸出。在此实验优化条件下的浸出渣率为89.9%,渣中银品位降至0.21%、碲品位为16.4%,银浸出率97.3%、碲的浸出率为11.5%。滤液用硝酸定容到250 mL,控制硝酸浓度在5%~10%,为了不影响其他元素的测定,将酸化后的液体进行固液分离除去AgCl沉淀,滤液检测结果如表3所列。
由表3可知,浸出液中碲和砷含量分别为113.9和25.9mg/L,贵金属金、铂和钯未检出,能够实现银的单向分离。亚硫酸钠标准电极电位为0.17 V,在中性或弱酸性介质中为一种强还原剂,可将溶液中较高电极电位的金、铂、钯还原,在浸出液中未检测到金、铂和钯的存在。
表3 优化条件实验的滤液检测结果

Tab.3 Leaching solution results of optimized conditions /(mg/L)
4 结论
1) 铂钯精矿中银主要以AgCl物相存在,可采用氨水或亚硫酸钠浸出。绘制了两种体系中的组态-配体浓度分布图,结合电位-pH图对浸出条件进行分析。结果表明,氨浸银过程需将pH控制在7.7~ 13.5,中性或碱性体系有利于亚硫酸钠浸出AgCl。
2) 采用氨水浸出铂钯精矿中银的优选实验条件为:氨水浓度9.5%、浸出液固比7:1 mL/g、常温搅拌浸出0.5 h。优化试验得到浸出渣率为87.8%,银的浸出率95.3%,碲的浸出率14.9%,部分贵金属铂、钯进入溶液。
3) 采用亚硫酸钠浸出铂钯精矿中AgCl的优选条件为:亚硫酸钠溶液浓度220 g/L,液固比5:1 mL/g,常温搅拌2 h。优化试验得到的浸出渣率为89.9%,银的浸出率97.3%,碲的浸出率为11.5%,浸出液中未检出金、铂和钯。亚硫酸钠浸出可实现银的单向分离,碲浸出分散量少,更适于铂钯精矿中AgCl的选择浸除。
[1] 郑雅杰, 乐红春, 孙召明. 铜阳极泥处理过程中中和渣中碲的提取与制备[J]. 中国有色金属学报, 2012, 22(8): 2360-2365.
ZHENG Y J, LE H C, SUN Z M. Extraction and preparation of tellurium from neutralization sludge of process for treatment of anode slime[J]. The Chinese journal of nonferrous metals, 2012, 22(8): 2360-2365.
[2] KILIC Y, KARTAL G, TIMUR S. An investigation of copper and selenium recovery from copper anode slimes[J]. International journal of mineral processing, 2013, 124: 75-82.
[3] ZHENG Y J, CHEN K K. Leaching kinetics of selenium from selenium-tellurium-rich materials in sodium sulfite solutions[J]. Transactions of Nonferrous Metals Society of China, 2014, 24(2): 536-543.
[4] GUO X Y, XU Z P, TIAN Q H, et al. Optimization on selenium and arsenic conversion from copper anode slime by low-temperature alkali fusion process[J]. Journal of Central South University, 2017, 24: 1537-1543.
[5] KHANLARIAN M, RASHCHI F, SABA M. A modified sulfation-roasting-leaching process for recovering Se, Cu, and Ag from copper anode slimes at a lower temperature [J]. Journal of environmental management, 2019, 235: 303-309.
[6] 熊家春, 朱茂兰, 衷水平, 等. 铜阳极泥处理工艺比较及建议[J]. 稀有金属与硬质合金, 2017, 45(1): 26-30.
XIONG J C, ZHU M L, ZHONG S P, et al. Comparison and suggestion of treatment process of copper anode slime[J]. Rare metals and cemented carbides, 2017, 45(1): 26-30.
[7] 张博亚, 王吉坤. 加压酸浸预处理铜阳极泥的工艺研究[J]. 矿冶工程, 2007, 27(5): 41-43.
ZHANG B Y, WANG J K. The technological research on pretreating copper anode slime with pressure acid leaching method[J]. Mining and metallurgical engineering, 2007, 27(5): 41-43.
[8] 郭学益, 肖彩梅, 钟菊芽, 等. 铜阳极泥处理过程中贵金属的行为[J]. 中国有色金属学报, 2010, 20(5): 990- 998.
GUO X Y, XIAO C M, ZHONG J Y, et al. Behaviors of precious metals in process of copper anode slime treatment[J]. The Chinese journal of nonferrous metals,, 2010, 20(5): 990-998.
[9] 金哲男, 马致远, 杨洪英, 等. 铜阳极泥全湿法处理过程中贵贱金属的行为[J]. 东北大学学报(自然科学版), 2015, 36(9): 1305-1309.
JIN Z N, MA Z Y, YANG H Y, et al. Behaviors of precious and base metals in process of copper anode slime hydrommetallurgical treatment[J]. Journal of Northeasten University (Natural science), 2015, 36(9): 1305-1309.
[10] 张福元, 赵卓, 樊友奇, 等. 一种新型稀贵金属复合还原剂的制备及其使用方法: ZL201711083017.8[P]. 2017-11-07.
ZHANG F Y, ZHAO Z, FAN Y Q, et al. Preparation and application of a new complex reducing agent for rare and precious metals: ZL201711083017.8[P]. 2017-11-07.
[11] 张福元, 赵卓, 樊友奇, 等. 一种从铜阳极泥分铜液中回收稀贵金属的方法: ZL201711081760.X[P]. 2017-11-07.
ZHANG F Y, ZHAO Z, FAN Y Q, et al. A process for recovering rare and precious metals from copper anode slime: ZL201711081760.X[P]. 2017-11-07.
[12] 杨天足, 窦爱春, 江名喜, 等. 氯离子浓度对氨水浸出氯化银的影响[J]. 贵金属, 2006, 27(4): 6-11.
YANG T Z, DOU A C, JIANG M X, et al. Influence of concentration of chlorine ion on leaching of silver chloride by ammonia[J]. Preciuoe melals, 2006, 27(4): 6-11.
[13] 蒙星辉, 柯家骏. 氨性溶液中Ag氧化浸取动力学研究[J]. 金属学报, 1987, 23(2): B68-75.
MENG X H, KE J J. Kinetics of oxidation leaching of Ag in ammoniacal solutions[J]. Acta metallurgica sinica, 1987, 23(2): B68-75.
[14] 汪秋雨, 何强, 胡意文, 等. 全湿法短流程高纯银的制备工艺[J]. 中国有色金属学报, 2017, 27(5): 1037-1044.
WANG Q Y, HE Q, HU Y W, et al. Preparation technology of hydrometallurgical process high purity silver power[J]. The Chinese journal of nonferrous metals, 2017, 27(5): 1037-1044.
[15] 陈小红, 赵祥麟, 楚广, 等. 用亚硫酸钠从分银渣中浸出银[J]. 中南大学学报(自然科学版), 2014, 45(2): 356-360.
CHEN X H, ZHAO X L, CHU G, et al. Leaching of Ag from residue containing silver with sodium sulfite[J]. Journal of Central South University (Science and technology), 2014, 45(2): 356-360.
[16] 杨俊奎, 徐斌, 李科, 等. 硫代硫酸盐浸出脱铜阳极泥中金、银和钯的研究[J]. 贵金属, 2018, 39(4): 1-11.
YANG J K, XU B, LI K, et al. Leaching Au, Ag and Pd from decopperized anode slime by thiosulfate solutions[J]. Precious metals, 2018, 39(4): 1-11.
[17] 张杜超, 杜新玲, 杨天足, 等. 氯化银在含氯离子的亚硫酸钠溶液中的浸出研究[J]. 贵金属, 2007, 28(3): 10-14.
ZHANG D C, DU X L, YANG T Z, et al. Study on leaching of silver chloride in sodium sulfite solution containing chloride ions[J]. Precious metals, 2007, 28(3): 10-14.
[18] 张小林, 李伟, 宁瑞. 用Na2SO3与NH3分银实验研究[J]. 有色金属科学与工程, 2014, 5(1): 63-67.
ZHANG X L, LI W, NING R. Siler separation by using Na2SO3and NH3[J]. Nonferrous metals science and engineering, 2014, 5(1): 63-67.
Study on the Leaching Pretreatment of Silver Chloride in Platinum-Palladium Concentrate
XU Juan, ZHANG Fu-yuan*, DING Ding
(Sclool of Metallurgical Engineering, Anhui University of Technology, Maanshan 243032, Anhui, China)
Silver in platinum-palladium concentrate obtained from the copper-rich solution of copper anode slime is mainly in the form of silver chloride, which can be removed by ammonia or sodium sulfite leaching agents. The diagrams of silver multiform complex with NH3, SO2- 3 ligands were drawn. The potential-pH diagram showed that the pH range of ammonia leaching was 7.7~13.5, and that sodium sulfite leaching should be carried out under neutral or alkaline conditions. The ammonia leaching rate of silver was 95.3%, and the tellurium leaching rate was 14.9%, and there were only trace amounts of leached platinum and palladium under the optimized experimental conditions. Using Na2SO3as the leaching agent, the leaching rates of sliver and tellurium were 97.3% and 11.5% respectively, and gold, platinum and palladium were not leached. Sodium sulfite is more suitable as a leaching agent for removing silver from platinum palladium concentrates.
platinum palladium concentrate; sliver chloride; ammonia; sodium sulfite; leaching
TF83
A
1004-0676(2020)03-0001-07
2019-08-02
国家重点实验室开放基金资助(GZSYS-KF-2020-008)
徐 娟,女,硕士,讲师,研究方向:稀贵金属综合回收。E-mail:xujuanzh@163.com
张福元,男,博士,教授,研究方向:稀贵金属分离富集。E-mail:13939816876@163.com

