胃癌间充质干细胞高表达G6PD促进肿瘤细胞迁移 *
黄霞,陈斌,黄超,韩志强,陈志红,许文荣,朱伟
(1. 江苏大学医学院&江苏省检验医学重点实验室,江苏镇江212013;2. 泰州人民医院检验科,江苏泰州225300;3. 江苏大学附属医院骨科部,江苏镇江212001;4. 江苏大学附属人民医院普通外科部,江苏镇江212002)
肿瘤微环境中胃癌间充质干细胞(gastric cancer mesenchymal stem cells, GCMSCs)作为基质细胞影响胃癌的发展[1-2]。本课题组前期研究[3]发现,与健康人骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs)相比,GCMSCs分泌炎性因子明显升高。MSCs通过旁分泌机制促进胃癌的迁移[4],且GCMSCs促进肿瘤进展的作用较BMMSCs明显增强,但其具体作用机制尚不明确[1]。葡萄糖-6-磷酸脱氢酶(G6PD)作为磷酸戊糖途径的关键酶,不仅为细胞生长提供原料,还可激活细胞信号,促进细胞因子的产生[5]。肿瘤细胞的转移受多种细胞信号调节,包括转化生长因子-β(transforming growth factor-β,TGF-β)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等细胞信号[6]。研究发现,G6PD在GCMSCs中的表达水平较BMMSCs显著升高,但其高表达是否影响胃癌细胞转移目前尚不清楚[7]。因此,本研究探究了G6PD在GCMSCs中的表达及其在胃癌转移中的作用,明确胃癌细胞来源的外泌体(exosome)调节GCMSCs G6PD表达的机制,旨在为胃癌转移诊断及预后判断提供辅助指标。
1 研究对象与方法
1.1研究对象 20例胃癌组织石蜡切片收集于2018年1月至2019年4月泰州市人民医院就诊的胃癌患者。其中,男14例,女6例,年龄59~84岁,中位年龄70岁。入选标准[8]:经影像学检查(CT、钡剂造影等)、组织学检查(胃镜等)最终诊断为胃癌。排除标准:合并其他系统肿瘤;严重肝肾功能不全;严重感染及血液系统疾病。胃癌分期及病理组织学分型按照美国癌症联合会(AJCC)2018版诊断标准[9]。其中,印戒细胞癌1例,神经内分泌癌1例,腺癌18例。收集患者病历及病理资料。9例新鲜胃癌组织收集于2018年5月至2019年10月江苏大学附属医院就诊的胃腺癌患者。其中,男8例,女1例,年龄56~72岁,中位年龄64岁。入选标准、排除标准、胃癌分期及病理组织学分型诊断标准同上。健康人骨髓标本收集于2018年5月至2019年6月江苏大学附属医院就诊的骨科外伤患者。其中,男3例,女2例,年龄26~52岁,中位年龄40岁。
1.2细胞系、主要仪器和试剂 SGC-7901、HGC-27购自于中国科学院典型培养物保藏委员会细胞库。G6PD siRNA (50 nmol/L)和阴性对照(50 nmol/L)购自广州锐博生物公司。Ficoll试剂(北京达科为生物技术公司),RPMI 1640培养基、胎牛血清、α-MEM培养基(以色列 Biolhd公司),Lipofectamine®2000 (美国赛默飞科技公司),免疫组化试剂盒(武汉博士德生物公司),CCK-8试剂盒、活性氧检测试剂盒(上海碧云天生物公司),鼠抗人G6PD单克隆抗体、鼠抗人P53单克隆抗体、鼠抗人丙酮酸激酶M2(PKM2)单克隆抗体(美国圣克鲁斯生物公司),兔抗人己糖激酶2(HK2)单克隆抗体(美国CST公司),兔抗人乳酸脱氢酶(LDH)抗体(沈阳万类生物公司),兔抗人α平滑肌肌动蛋白(α-SMA)抗体(美国Bioword公司),HRP标记羊抗鼠(兔)IgG二抗(北京康为世纪公司)。Mini-PROTEAN Tetra电泳仪(美国Bio-Rad公司),LAS4000 Mini化学发光曝光系统(德国GE公司),BX41荧光显微镜(日本Nikon公司),800TS酶联仪(美国BioTec公司),CB171(A)半自动生化分析仪(上海合意检验设备公司)。
1.3方法
1.3.1细胞培养 胃癌细胞系培养于含10%胎牛血清的RPMI 1640培养基中,置于37 ℃、5% CO2条件下培养。新鲜胃癌组织切成约1 mm3小块,接种于细胞培养皿,加入10%胎牛血清α-MEM培养基,置于37 ℃、5% CO2条件下培养。待细胞融合度达80%时,收集细胞并传代培养。健康人骨髓经PBS稀释后,按照Ficoll试剂说明书操作分离单个核细胞,加入至含10%胎牛血清α-MEM培养基中,置于37 ℃、5% CO2条件下培养。待细胞贴壁并形成融合层时,收集细胞并传代培养。BMMSCs和GCMSCs细胞融合度达80%时,吸弃培养基,PBS洗涤3次并加入新鲜培养基,48 h后收集细胞条件培养基,800×g离心10 min获得条件培养基(BMMSC-CM、GCMSC-CM)。条件培养基与RPMI 1640培养基以1∶1比例混合后作用于胃癌细胞。
1.3.2胃癌细胞来源外泌体分离 取SGC-7901或HGC-27细胞系,加入至含10%去除外泌体的胎牛血清的RPMI 1640培养基中,置于37 ℃、5% CO2、饱和湿度的条件下培养,收集培养48 h后的细胞上清,2 000×g离心20 min去除细胞碎片,细胞上清液经10 000×g离心30 min,上清液转移至millipore滤器后1 500×g离心1 h,上清液经0.22 μm无菌滤器过滤后转移至EP管内,加入外泌体提取试剂,4 ℃静置过夜,1 500×g离心30 min,沉淀用适量PBS溶解。
1.3.3G6PD活性检测 取1×106个BMMSCs或GCMSCs细胞加入100 μL细胞非变性裂解液并超声碎裂,1 000×g离心5 min获取蛋白质裂解液。分别加入(6-磷酸葡萄糖酸盐、NADP+)溶液和(葡萄糖6-磷酸、6-磷酸葡萄糖酸盐和NADP+)溶液作为获取 6-磷酸葡萄糖酸脱氢酶(6PGD)活性反应体系及G6PD+6PGD总活性反应体系。底物浓度为:葡萄糖6-磷酸(0.2 mmol/L)、6-磷酸葡萄糖酸盐(0.2 mmol/L)和NADP+(0.1 mmol/L)。所有样品在缓冲液(50 mmol/L Tris, 1 mmol/L MgCl2, pH 8.1)内反应6 min。使用分光光度计检测在波长为340 nm处吸光度(A)值。实验重复3次。G6PD活性公式=(G6PD+6PGDA340 nm-6PGDA340 nm)/ 6。
1.3.4western blot 取BMMSCs、GCMSCs或siG6PD GCMSCs,每1×106个细胞加入100 μL RIPA裂解液,震荡15~30 s,冰上温育 4~5 min,重复5次,12 000×g离心10 min收集细胞总蛋白质。总蛋白质经12 %十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离(积层胶采用60 V电压,分离胶采用100 V电压)。电泳结束后在350 mA恒流条件下作用1.5 h,将凝胶上蛋白质转移至硝酸纤维素(PVDF)膜上。PVDF膜置于50 g/L脱脂牛奶中室温封闭1 h,分别加入鼠抗人G6PD单克隆抗体(1∶1 000稀释)、鼠抗人P53单克隆抗体(1∶1 000稀释)、兔抗人 HK2抗体(1∶1 000稀释)、鼠抗人PKM2单克隆抗体(1∶1 000稀释)及兔抗人LDH抗体(1∶1 000稀释),4 ℃温育过夜。PVDF膜经TBST洗涤,加入HRP标记羊抗鼠(兔)抗体(1∶3 000稀释),37 ℃温育1 h。PVDF膜经TBST洗涤后使用ECL试剂盒和化学发光凝胶成像系统检测蛋白质表达量。实验重复3次。使用Image J对条带进行灰度扫描。蛋白质相对表达量=目标蛋白灰度值/内参蛋白灰度值。
1.3.5活性氧检测 按照活性氧检测试剂盒说明书对BMMSCs和GCMSCs内活性氧进行检测。使用无血清培养液洗涤细胞3次,使用荧光显微镜在488 nm波长处观察荧光。以释放绿色荧光的细胞为表达活性氧阳性细胞。实验重复3次。
1.3.6台盼蓝染色法检测 取1×105个GCMSCs或siG6PD GCMSCs,经2%胎牛血清培养基或含200 μmol/L H2O2培养基培养48 h,经2.5 g/L胰蛋白酶消化,120×g离心5 min。细胞沉淀经PBS稀释后制备细胞悬液,并与0.4%台盼蓝染液以9∶1的比例混合。BX41荧光显微镜下观察细胞染色(细胞染成蓝色为死亡细胞)。细胞活力计算公式:活细胞率=活细胞数/(死细胞数+活细胞数)×100%。实验重复3次。
1.3.7siRNA细胞转染 根据Lipofectamine®2000说明书对GCMSCs进行siRNA转染。步骤:取对数生长期GCMSCs以1×105个/孔的细胞密度接种于6孔细胞培养板,待细胞融合度达50%~60%时进行细胞转染。在250 μL无血清α-MEM培养基中加入5 μL G6PD siRNA储存液或阴性对照siRNA。250 μL无血清α-MEM培养基中加入5 μL Lipofectamine®2000储存液,室温静置5 min。将稀释的siRNA和转染试剂混合,室温静置20 min。用PBS洗涤细胞,每孔加入1.5 mL无血清α-MEM培养基和相应的siRNA和转染试剂混合液,置于37 ℃、5% CO2、饱和湿度的条件下培养6 h。更换为常规培养基,取转染48 h后细胞用于后续试验。使用western blot对转染的有效性进行验证。
1.3.8细胞迁移试验 取生长状态良好的HGC-27或SGC-7901细胞与BMMSC-CM、GCMSC-CM、siG6PD GCMSC-CM共培养,置于37 ℃、5% CO2条件下培养48 h。细胞经2.5 g/L胰蛋白酶消化,120×g离心5 min,收集细胞沉淀。加入200 μL无血清培养基(含6×104个HGC-27或SGC-7901细胞)于Transwell小室的上室。小室下室加入600 μL含10%胎牛血清培养基。小室置于37 ℃、5% CO2条件下培养8 h。用棉签擦拭移除未迁移的细胞。BMMSCs、GCMSCs和siG6PD GCMSCs经2.5 g/L胰蛋白酶处理,120×g离心5 min,收集细胞沉淀。将200 μL无血清培养基(含8×104个BMMSCs或GCMSCs或siG6PD GCMSCs细胞)加入至Transwell小室的上室,小室下室加入600 μL含10%胎牛血清的培养基。小室置于37 ℃、5% CO2条件下温育10 h。用棉签擦拭移除未迁移的细胞。用4%多聚甲醛固定已迁移的细胞,结晶紫染色10 min。在光学显微镜下计数每个小室随机3个视野,实验重复3次。
1.3.9细胞增殖试验 取生长状态良好的BMMSCs、GCMSCs和siG6PD GCMSCs,以2×103/孔的细胞密度接种于96孔板。细胞置于37 ℃、5% CO2、饱和湿度的条件下培养。检测前吸除原培养基,每孔加入100 μL含10%增强型CCK-8溶液的培养基。细胞置于培养箱内继续温育1.5 h。使用酶联仪在450 nm测定吸光度(A)值。根据不同组A450 nm值分析细胞增殖情况。实验重复3次。
1.3.10免疫组织化学染色 取胃癌组织石蜡切片,脱蜡。3% H2O2温育5 ~10 min。PBS洗涤5 min,共3次。切片浸没在枸橼酸盐抗原修复液中抗原热修复30 min,5% BSA溶液封闭30 min,甩干。滴加鼠抗人G6PD 单克隆抗体(1∶100稀释)或兔抗人α-SMA抗体(1∶200稀释),4 ℃温育过夜。PBS洗涤5 min,重复3次。滴加生物素标记的鼠/兔抗人IgG,37 ℃温育30 min。PBS洗涤5 min,共3次。加入链霉亲和素-生物素复合物(strept avidin-biotin complex, SABC)试剂,37 ℃温育30 min。PBS洗涤5 min,共3次。滴加3,3-二氨基苯联胺(diaminobenzidine,DAB)染液在显微镜下显色,自来水冲洗1 min,苏木素染色3 min。在光学显微镜下观察并拍照。细胞被染成黄色或棕色为阳性细胞。
1.4统计学分析 数据分析采用GraphPad Prism 6软件及SPSS 20.0 统计学软件包。不同组采用单因素方差分析或t检验。采用四格表资料的Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1western blot检测糖酵解关键酶和磷酸戊糖途径关键酶在GCMSCs及BMMSCs中的表达 western blot结果表明,GCMSCs中G6PD表达明显高于BMMSCs,而GCMSCs中HK2、PKM2和LDH的表达水平与BMMSCs相比差异均无统计学意义(图1A、1B, G6PD:t=7.497,P<0.01)。酶活性检测结果发现,GCMSCs 内G6PD的活性明显高于BMMSCs(BMMSCs vs GCMSCs:0.030±0.001 vs 0.046±0.001,t=11.75,P<0.001)。活性氧探针检测发现GCMSCs细胞内的活性氧水平低于BMMSCs(图1C)。
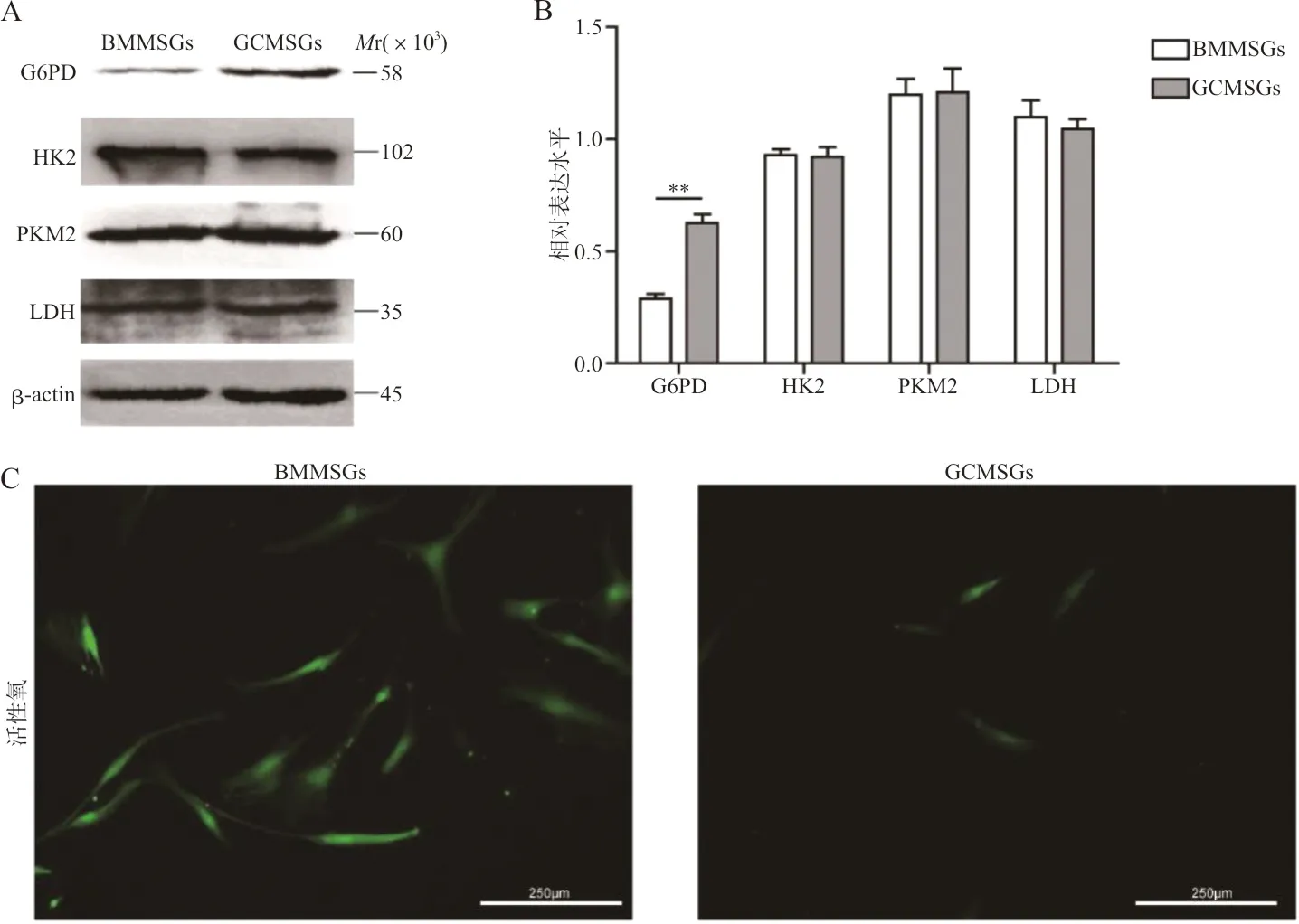
注:A,western blot检测BMMSCs和GCMSCs内 G6PD、HK2、PKM2、LDH蛋白的表达;B,G6PD、HK2、PKM2、LDH在BMMSCs和GCMSCs表达水平的柱状图;C,活性氧探针检测BMMSCs和GCMSCs内活性氧(×200); **,P<0.01。
2.2细胞迁移试验检测胃癌细胞的迁移 细胞迁移试验结果表明,抑制G6PD在GCMSCs的表达后,其促进HGC-27和SGC-7901细胞迁移能力降低(图2A、2B,HGC-27:F=33.53,P<0.05;SGC-7901:F=37.10,P<0.05)。
2.3western blot检测BMMSCs和经胃癌细胞exosome培养BMMSCs 中G6PD表达 western blot鉴定exosome结果证实其表达exosome特异蛋白CD9及CD63。胃癌细胞exosome培养BMMSCs 7 d后,经SGC-7901 exosome (图3A、3B,t分别为15.97、17.22,P均<0.01)和HGC-27exosome(图3C、3D,t分别为4.86、4.704,P均<0.01)处理后的BMMSCs P53蛋白的表达相对于未处理BMMSCs均明显降低,而G6PD蛋白的表达水平相对升高。
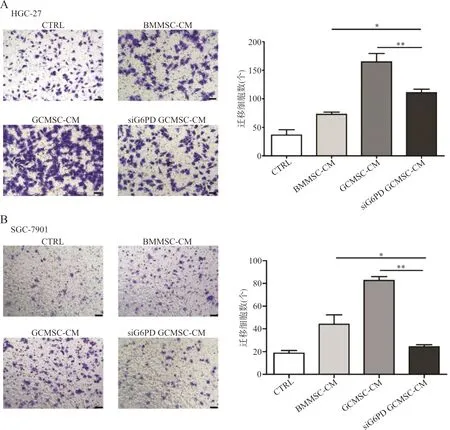
注:A,HGC-27经BMMSC-CM、GCMSC-CM或siG6PD GCMSC-CM处理48 h后细胞的迁移;B,SGC-7901经BMMSC-CM、GCMSC-CM或siG6PD GCMSC-CM处理48 h后细胞的迁移;*,P<0.05;**,P<0.01。
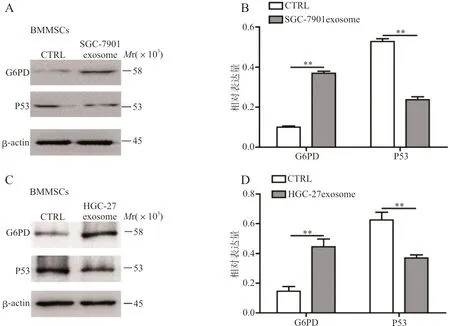
注: A,western blot检测BMMSCs经SGC-7901 exosome作用后 P53和G6PD的表达;B,G6PD、P53在对照组和SGC-7901 exosome组相对表达水平的柱状图;C,western blot检测BMMSCs经HGC-27 exosome作用后 P53和G6PD的表达;D,G6PD、P53在对照组和HGC-27 exosome组相对表达水平的柱状图;**,P<0.01。
2.4细胞增殖和迁移试验检测BMMSCs、GCMSCs及siG6PD GCMSCs的增殖和迁移 使用siRNA抑制GCMSCs内G6PD的表达(图4A),结果表明,干扰组G6PD的表达水平明显低于阴性对照组(NC vs siG6PD:0.283±0.012 vs 0.135±0.007,t=10.48,P<0.001)。台盼蓝染色结果证实,抑制GCMSCs内G6PD的表达可降低其在低胎牛血清环境中的生存(NC vs siG6PD:0.793±0.020 vs 0.457±0.022,t=11.29,P<0.001)。抑制GCMSCs内G6PD的表达可降低其在200 μmol/L H2O2环境中的生存(NC vs siG6PD:0.763±0.047 vs 0.527±0.050,t=3.444,P<0.05)。细胞增殖试验结果表明,GCMSCs增殖能力高于BMMSCs,抑制G6PD在GCMSCs内的表达可降低其增殖能力(图4B,P均<0.01)。细胞迁移试验结果表明,GCMSCs迁移能力明显高于BMMSCs。抑制G6PD在GCMSCs内的表达可降低其迁移能力(图4C,F=89.90,P均<0.01)。
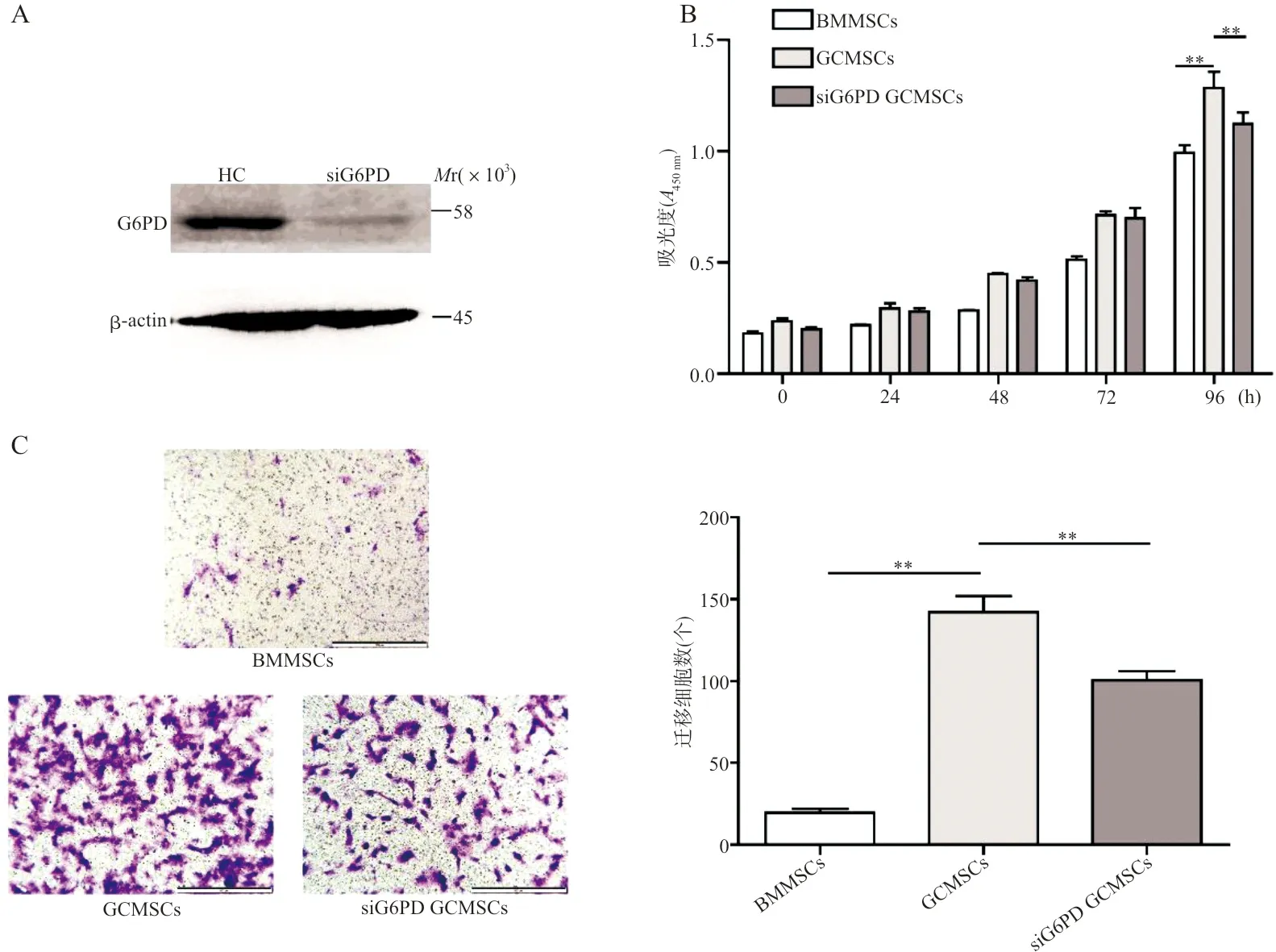
注:A,western blot检测G6PD在GCMSCs和siG6PD GCMSCs内表达;B,细胞增殖试验检测BMMSCs、GCMSCs和siG6PD GCMSCs细胞的增殖能力;C,细胞迁移试验检测BMMSCs、GCMSCs和siG6PD GCMSCs细胞的迁移(×200);**,P<0.01。
2.5免疫组织化学检测胃癌患者癌组织中G6PD的表达及与临床病理参数分析 采用免疫组织化学检测胃癌患者癌组织中G6PD表达,结果表明,基质细胞中G6PD表达水平较高患者的肿瘤直径较大,淋巴结转移增多,细胞分化程度降低(图5和表1)。

图5 免疫组织化学检测胃癌组织G6PD和α-SMA的表达(×400)
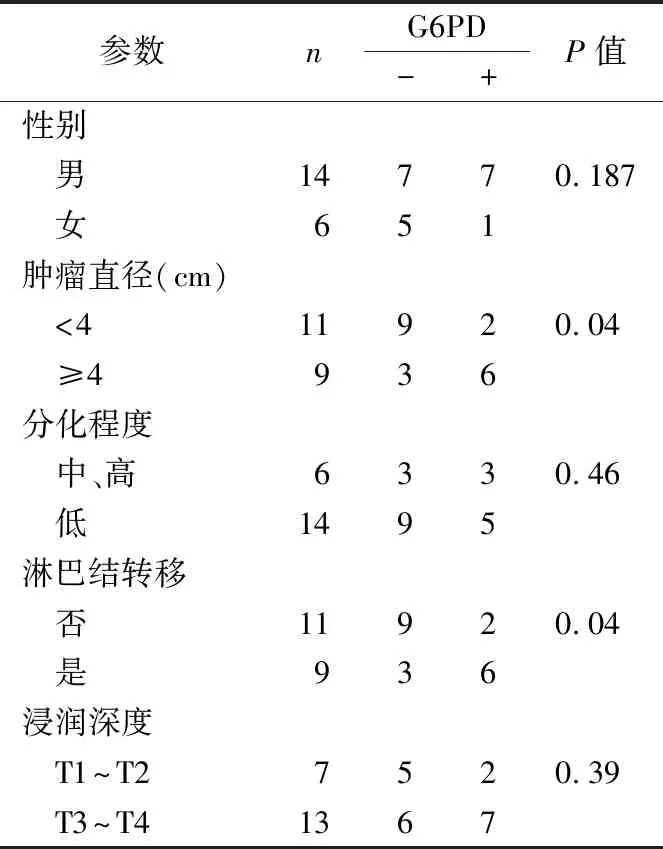
表1 胃癌患者临床病理参数与癌组织基质细胞G6PD的表达分析
3 讨论
本课题组前期研究发现,GCMSCs相对于BMMSCs在细胞生长、细胞因子产生和促进肿瘤生长作用等方面存在较大的差异[3]。G6PD是戊糖磷酸途径的限速酶。研究表明,G6PD水平升高可促进多种肿瘤的进展。G6PD在肿瘤细胞内的表达促进肿瘤细胞的增殖和迁移,抑制肿瘤细胞的凋亡[10]。然而,G6PD在肿瘤基质细胞中的表达对肿瘤进展的影响目前尚不明确。本研究发现G6PD在GCMSCs中的表达水平和活性明显高于BMMSCs,并证实胃癌细胞来源的exosome是调节BMMSCs内G6PD表达的重要因素。G6PD在GCMSCs内的表达不仅促进了GCMSCs的增殖和迁移,而且有利于细胞在缺血缺氧的肿瘤微环境中存活。G6PD在肿瘤细胞内表达通过激活细胞信号或降低基质金属蛋白酶的表达,促进肿瘤细胞的迁移[11]。本研究的结果表明,G6PD在GCMSCs内的表达促进胃癌细胞的迁移,其关键因素可能是调节GCMSCs细胞因子或exosome的产生,还可能是调节了GCMSCs代谢产物的产生,其具体机制有待进一步探究。
肿瘤细胞中G6PD表达对肿瘤进展的影响已被广泛研究,但肿瘤基质细胞中G6PD的表达在肿瘤诊断中的应用价值尚不明确。近期研究发现,磷酸甘油酸激酶1(PGK1)和G6PD检测被认为是循环肿瘤细胞最佳的糖代谢标志物,且证实循环肿瘤细胞PGK1和G6PD的表达与肿瘤转移相关[12]。本研究证实G6PD的表达是MSCs促进胃癌细胞迁移的调节因素。笔者进一步对胃癌基质细胞G6PD表达与胃癌患者临床病理参数进行分析,结果发现胃癌基质细胞高表达G6PD的患者发生胃癌淋巴结转移的概率更高。胃癌基质细胞G6PD检测可能成为胃癌转移的诊断标志物,但其临床应用还需经大样本论证。

