Dfg5 在酿酒酵母细胞壁合成中的功能分析
田贵花, 王 宁, 高晓冬, 藤田盛久*, 喜多岛敏彦
(1. 江南大学 生物工程学院,江苏 无锡214122; 2. 江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
酿酒酵母细胞壁由β-葡聚糖、甘露糖蛋白以及少量几丁质组成[1]。 葡萄糖通过β-1,3/1,6 糖苷键的方式结合形成葡聚糖构成细胞壁的内层,细胞壁外层则主要由甘露糖蛋白构成[2-3]。 细胞壁外层甘露聚糖蛋白与细胞壁内层葡聚糖的连接方式主要分为两类:一类甘露糖蛋白通过非共价键与细胞壁内层葡聚糖相连接,可以用SDS 抽提;另一类甘露糖蛋白通过共价键与细胞壁内层葡聚糖相连,不能用SDS 抽提, 但可以通过β-1,3-或β-1,6-葡聚糖苷酶处理释放出来[4]。 根据与葡聚糖相连的羧基端结构和连接键类型,甘露糖蛋白可被分为两类,即糖基磷脂酰肌醇锚定的细胞壁蛋白质(glycosylphosphatidylinositol anchored cell wall proteins,GPI-CWPs)和含有内部氨基酸重复序列的细胞壁蛋白质 (CWPs crosslinked by protein with internal repeats,PIR-CWPs)。 PIR 型细胞壁蛋白质由内部重复氨基酸序列直接与细胞壁β-1,3 葡聚糖相连,此类蛋白质可用温和碱(30 mmol/L NaOH,12 h,4 ℃)提取[5-6]。GPI-CWPs 型的细胞壁蛋白质则先连接在β-1,6-葡聚糖上, 再通过β-1,6-葡聚糖与β-1,3-葡聚糖相连。GPI-CWPs 在许多细胞生长过程中均发挥重要作用, 如参与细胞壁的合成、维持细胞形态、参与细胞与外界信号传递、介导细胞之间的黏附[7]。
酵母中GPI 锚首先在ER 中合成并连接到GPI前体蛋白质上, 随后预装的GPI 锚定蛋白质(glycosylphosphatidylinositol anchored proteins,GPIAPs)在ER 和高尔基体中进行包括糖基化修饰在内的进一步改造,经过囊泡运输至细胞质膜外层。 当GPI-APs 到达细胞质膜后,大一部分GPI-APs 会进一步转移到细胞壁[5]。 通常认为GPI 锚的N-乙酰葡萄糖胺和第一个甘露糖之间被割开,脂质部分被移除,含有甘露糖残基的GPI 蛋白质被共价连接至胞外β-1,6-葡聚糖上, 形成GPI 锚定的细胞壁蛋白质(GPI-CWPs)[7-8]。 但是目前仍不清楚GPI 被切割和转移至细胞壁是由一步转糖苷作用完成还是由多个单独的反应完成, 也不知道哪种形式的GPIAps 会被转移至细胞壁上。 由于GPI-CWPs 广泛存在于真菌中,其结构和生物合成可作为抗真菌药物的又一靶点。 通过阻碍GPI-CWPs 的生物合成,就可以阻止和破坏真菌的细胞壁合成,也就能达到抑制真菌生长的目的。
Dfg5 和Dcw1 都属于糖苷水解酶76 家族(GH76) 并且与α-1,6 甘露聚糖酶具有同源性,推测可能具有甘露聚糖酶活性,参与GPI-Aps 锚定至细胞壁的过程。 同时Dfg5 和Dcw1 是一对同源GPI锚定蛋白,dcw1Δ 和dfg5Δ 单突变株均可正常生长,同时敲除DFG5 和DCW1 基因的双突变菌株生长致死。 当Dfg5 和Dcw1 表达都受到抑制时,细胞形态变得又圆又大,几丁质不再以点状形式集中在牙痕, 而是均匀遍布整个细胞表面, 表明共价连接GPI-CWPs 到葡聚糖上对细胞生长至关重要[9-12]。
迄今为止,还不确定GPI 锚被切割并转运细胞壁是由转糖苷酶催化一步完成还是由多个单独的反应协同完成,以及何种形式的GPI-Aps 会被转移至细胞壁上。 Dcw1 和Dfg5 作为协助GPI-Aps 交联至细胞壁的必需蛋白质,其作用机制可能是:1)Dfg5和Dcw1 发挥着转糖苷酶的作用, 同时承担着GPI锚的切割和转移;2)Dfg5 和Dcw1 是只扮演糖苷酶的角色参与GPI 锚的切割, 存在其它蛋白质负责GPI-Aps 转移。 由于Dcw1 和Dfg5 是同源蛋白质,其功能有重叠。因此作者拟选取Dfg5 为研究对象在酿酒酵母中对其功能和酶活特性进行分析,其次拟构建具有活性的分泌型Dfg5,未来可用于体外研究。
1 材料与方法
1.1 实验材料
1.1.1 质粒构建酿酒酵母出发菌株W303-1A,质粒pRS315、pRS316、YEp352GAPⅡ、YEp352GAPⅡ-sDFG5:均由作者所在实验室保藏和提供。研究中使用PCR 引物见表1,质粒见表2。 引物合成和质粒测序在华大基因完成。

表1 本研究中使用的引物Table 1 Primers used in this study
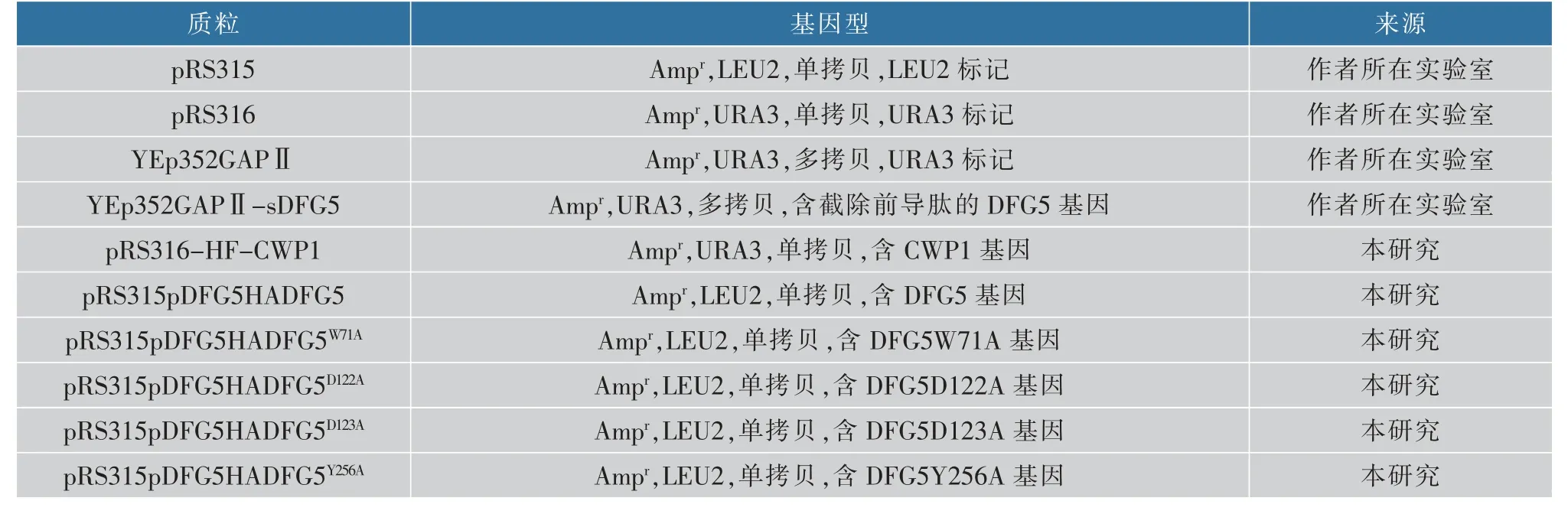
表2 本研究中使用的质粒Table 2 Plasmids used in this study
1.1.2 主要试剂和仪器DNA 连接酶、限制性内切酶: 购于TaKaRa 公司;PCR 引物、PCR 产物纯化试剂盒、琼脂糖凝胶电泳胶回收试剂盒、质粒小量抽提试剂盒:购置于上海生物工程公司;β-1,3-glucose:购置于Sigma 公司;相关抗体:购置于上海生工生物工程公司;SDS-PAGE 凝胶配制试剂盒、ClarityTMWestern ECL Substrate 显色剂: 购置于碧云天生物技术研究所。
1.1.3 培养基和溶液配制YPAD 培养基(1 L):酵母浸出粉10 g, 蛋白胨20 g, 腺嘌呤30 mg,加ddH2O 至900 μL,121 ℃高压灭菌15 min,培养基冷却至55 ℃,加入100 mL 单独灭菌的20 g/dL 葡萄糖。SD 缺陷型培养基 (1 L): 无氨基酵母氮源(YNB)6.7 g,加水至900 mL,121 ℃高压灭菌15 min,培养基冷却至55 ℃,加入100 mL 单独灭菌的20 g/dL的葡萄糖和2 g 缺少相应氨基酸的氨基酸混合物。
1.1.4 菌株构建基因敲除的具体方法参见文献[13]。质粒pFA6a-trp 为敲除DCW1 和DFG5 的模板,质粒pFA6a-his3MX-PMET3 为构建dfg5△PMET3DCW1菌株的模板,PCR 引物见表1。 在酿酒酵母中MET3基因编码ATP 硫酸化酶,能有效激活无机硫同时并入有机分子中,是蛋氨酸代谢中的关键步骤。 在外源甲硫氨酸作用下,MET3 启动子调控下的目的基因表达受到抑制。 在缺少甲硫氨酸的选择性培养基中,MET3 启动子变为增强型启动子,使其调控下的目的基因高效表达[14-17]。 本研究中使用菌的菌株见表3。
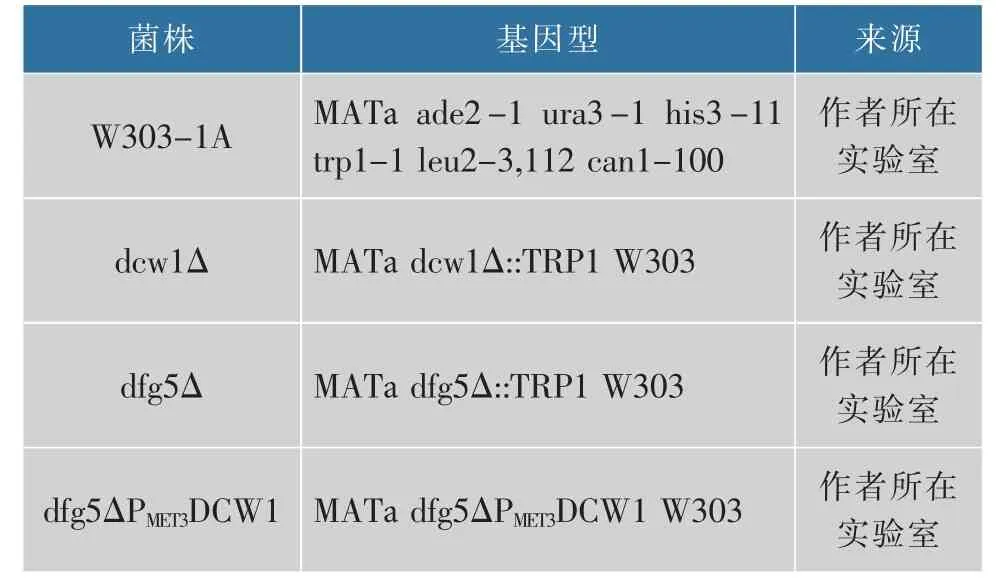
表3 本研究中所用的菌株Table 3 Strains used in this study
1.2 菌株表型验证
将W303-1A、dfg5△和dfg5△PMET3DCW1 在甲硫氨酸缺陷型葡萄糖选择性培养基(SD-Met)中30 ℃培养过夜,至OD660=1.0,取相同细胞数连续做4 次10 倍梯度稀释,在SD-Met 和含1 mmol/L 甲硫氨酸的葡萄糖选择性培养基(SD+Met)上点板,分别在30、41 ℃培养,观察细胞生长情况。
1.3 蛋白质提取
1.3.1 细胞膜蛋白质提取在相应培养中30 ℃培养过夜,离心收集10 mL OD660的酵母细胞,用1 mL预冷的2 mmol/L 苯基甲磺酰氟(Phenylmethanesulfonyl fluoride)洗涤2 次。重悬于150 μL 1×SDS-PAGE 上样缓冲液中,加入100 μL 玻璃珠(0.4~0.6 mm),65 ℃孵育5 min,振荡2 min。再次65 ℃孵育5 min,振荡2 min。 加入150 μL 1×SDS-PAGE 上样缓冲液,65 ℃孵育5 min。 20 000g离心5 min 除去细胞碎片和细胞壁杂质,收集100 μL 上清液,即可得到膜蛋白[18-19]。
1.3.2 细胞壁GPI-CWP1 蛋白质提取在相应培养基中30 ℃培养过夜, 离心收集10 mL OD660的酵母细胞, 用1 mL 预冷的10 mmol/L Tris-HCl(pH 7.5) 洗涤2 次。 重悬于100 μL 裂解缓冲液(50 mmol/L Tris-HCl(pH 7.5),1 mmol/L EDTA,1 mmol/L PMSF,SIGMAFSTTM Protease Inhibitor Cocktail Tablets)中,加入适量的玻璃珠。 振荡1 min 后冰浴1 min,重复上述振荡及冰浴5 次。 4 ℃、100g离心30 s,分离玻璃珠,收集细胞裂解液。加入100 μL 萃取缓冲液(4% SDS,100 mmol/L NaCl,40 mmol/L β-巯基乙醇)后充分混匀,100 ℃孵育10 min,16 000g离心5 min,去除上清液。 再次重悬于100 μL 萃取缓冲液中,100 ℃孵育2 min,16 000g离心5 min,去除上清液,重复上述循环3 次。 用1 mL ddH2O 洗涤3 次,16 000g离心5 min 去除上清液[19]。 沉淀所得粗细胞壁碎片重悬于100 μL、150 mmol/L 醋酸钠反应液,加入2 mg β-1,3-葡聚糖酶,充分混匀,37 ℃反应12 h 以上,即可得到细胞壁的GPI-CWPs[20]。
1.3.3 细胞外蛋白质提取在相应培养基中30 ℃培养过夜, 离心收集10 mL OD660的酵母细胞培养液,4 ℃、5 000 g离心5 min,去除细胞沉淀并收集上清液。将上清液于4 ℃、15 000 r/min 离心5 min,进一步除去细胞碎片。 收集的上清液中加入终浓度10%的三氯乙酸,振荡混匀,冰浴30 min 以上。离心去除上清液,沉淀用预冷的丙酮洗涤3 次后,溶解于1×SDSPAGE 上样缓冲液,95 ℃孵育5 min,-20 ℃保存。
1.4 蛋白质免疫印迹电泳
取100 μg 蛋白质样品上样跑电泳, 浓缩胶电压80 V,30 min;分离胶电压120 V,90 min;转膜:采用半干式转膜方式,电压25 V,电流1.0 A,时间30 min;封闭:5%的脱脂奶粉封闭1 h;孵育抗体:一抗1∶5 000,室温1.5 h 或4 ℃过夜;二抗1∶5 000,室温1 h;显色:ECL 显色液A 和B 混匀,涂于膜上,用ImageQuant LAS4000mini 显色。
1.5 生长曲线测定
从平板挑取单菌落接种于5 mL 葡萄糖型甲硫氨酸和尿嘧啶缺陷培养基(SD-Met-Ura)中预培养,离心收集等量对数生长期的细胞,并将其分别转接至50 mL SD-Met-Ura 和含1 mmol/L 甲硫氨酸的葡萄糖型尿嘧啶缺陷2 培养基 (SD+Met-Ura)。 每12 小时取1 次样品,在OD660下测定菌浓,培养至第72 h 停止测定。 以测定的OD660数值为纵坐标,培养时间为横坐标,得到不同菌株的生长曲线。
2 结果与讨论
2.1 MET3 启动子调控下的突变株表型验证
考虑到dcw1△和dfg5△双突变株存在严重的细胞壁缺陷使其生长致死[11,17]。 为便于研究这两个基因的功能,作者构建了dfg5△PMET3DCW1 条件突变株菌株, 即在dfg5△菌株中用MET3 启动子调控DCW1 基因的表达。 如图1 所示,dfg5△菌株能在41 ℃环境中正常生长, 具有耐高温的特性,与Nasution[21]等研究相符。 在甲硫氨酸培养基上dfg5△PMET3DCW1 菌株不生长,表明外源添加甲硫氨酸可诱导MET3 启动子抑制DCW1 表达。 此时由于Dfg5 缺失且Dcw1 表达受抑制, 从而引起细胞壁合成受损,导致细胞死亡。 在缺少甲硫氨诱导的情况下,MET3 启 动 子 调 控DCW1 高 表 达, 此 时dfg5△PMET3DCW1 菌株表型与dfg5△相似,无论是在30 ℃还是41 ℃条件下,菌株均可正常生长。 上述结果说明, 在酿酒酵母中Dfg5 和Dcw1 功能重叠,单突变株在平板上表型差异小, 双突变株致死。 与Kitagaki[11]等研究结果相同。 本研究使用的MET3 启动子可在甲硫氨酸诱导下有效调节DCW1 表达,为下一步分析这两个基因的作用机制创造条件。

图1 突变菌株表型Fig. 1 Phenotype of mutant strains
2.2 Dcw1 和Dfg5 对细胞壁蛋白质合成的影响
为了研究Dcw1 和Dfg5 蛋白质在细胞壁合成途径中的功能, 作者选取Cwp1 作为一种典型的GPI 锚定细胞壁蛋白质[11,19],在W303-1A、dcw1△、dfg5△、dfg5△PMET3DCW1 菌株中分别表达His-Flag标记的Cwp1 蛋白质,同时用W303-1A 原始菌株作为空白对照。 蛋白质印记结果发现,在含甲硫氨酸培养基中培养的dfg5△PMET3DCW1 双缺陷菌株细胞壁的Cwp1 蛋白质量明显减少(图2(b)),细胞膜上则可检测到大量Cwp1(图2(a)),所有菌株的培养基中均检测不到Cwp1。表明引起细胞壁中Cwp1 缺失的主要原因是细胞膜上GPI 蛋白质不能被有效的切割进而无法共价连接到细胞壁上。 由此推测Dcw1和Dfg5 在GPI 型细胞壁蛋白质合成中只扮演糖苷酶的功能, 负责识别和切割细胞膜上的GPI 蛋白质,同时酵母中可能存在另一种蛋白质可将切割下来的GPI 蛋白质连接至细胞壁β-1,6-葡聚糖上形成细胞壁蛋白质;或者Dcw1 和Dfg5 扮演糖苷转移酶的功能,可将切割后GPI 蛋白质连接至细胞壁上[10-11]。 总之,Dcw1 和Dfg5 的缺失使Cwp1 不能成功的从细胞膜的GPI 锚上释放,说明这两个蛋白质至少具有类似糖苷酶的作用。 单突变菌株细胞膜和细胞壁中Cwp1 蛋白质量只有少量的变化 (图2(a),(b)),可能因为DCW1 和DFG5 是同源基因,其编码的蛋白质是同工酶, 当其中一种蛋白质缺失时,另一种蛋白质仍可正常工作,但是Dcw1 或Dfg5 单独作用时效率下降,造成单突变株中细胞膜上积累少量Cwp1,细胞壁中Cwp1 蛋白质含量减少。
2.3 Dfg5 活性位点分析和保守氨基酸突变
普遍认为糖苷水解酶76 家族(GH76)成员具有α-甘露糖苷酶活性,但是只有少数蛋白结构和功能被解析清楚。 肠寄居多形拟杆菌基因组编码的BT2849 蛋白质是该家族中惟一被发表的已知结构的蛋白质。 尽管BT2949 与GH76 家族其他成员氨基酸序列的相似性仅16%~25%, 但其蛋白质整体结构是相对高度保守的。 与根据其蛋白质晶体结构解析和序列比对发现, 聚集在蛋白质中心位置的5个 氨 基 酸 位 点W82、D143、E144、D249、Y265 可 能是催化活性中心相关位点。 目前没有Dfg5 和Dcw1蛋白质结构和活性中心的报道。 本研究对包括Dfg5、Dcw1 和BT2949 在内的7 个GH76 家族成员假定的催化域进行序列比对, 发现BT2849 中除D249 外的其它四个氨基酸位点W82、D143、E144、Y265 在GH76 家族中高度保守[12], 由此推测Dfg5中对应四个氨基酸位点也可能是潜在的活性中心。
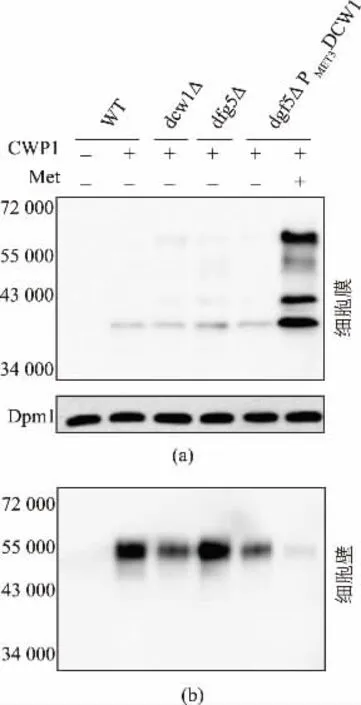
图2 模式蛋白质Cwp1 在突变菌株中的表达情况Fig. 2 Expression of Cwp1 in mutant strains
为了进一步探究酿酒酵母细胞壁合成过程中Dcw1 和Dfg5 是否承担着糖苷酶的功能及其活性中心的位置, 本研究选取Dfg5 蛋白质中对应的四个保守位点W71A、D122、D123、Y256 进行定点突变,成功构建突变子DFG5W71A、DFG5D122A、DFG5D123A、DFG5Y256A。 实验结果表明,在甲硫氨酸培养基中表达野生型DFG5 和突变DFG5Y256A 基因的菌株可回补dfg5ΔPMET3DCW1 条件突变株菌株的生长缺陷,而表达突变DFG5W71A、DFG5D122A、DFG5D123A基因的菌株不能回补其生长(图3(a)),说明突变后的Dfg5W71A、Dfg5D122A、Dfg5D123A 蛋白质失活。为进一步证明这些突变蛋白质失活是由于蛋白质降解还是催化活性消失引起的, 作者在dfg5Δ 株中表达了含有HA 标记的野生型DFG5 基因。 蛋白质印迹法分析细胞膜蛋白质和培养基中蛋白质发现,突变后的Dfg5W71A、Dfg5D122A、Dfg5D123A 蛋白质大小、表达水平和稳定性均无变化(图3(b))。 说明突变后Dfg5 没有降解,突变蛋白质失活极有可能是因蛋白质催化活性中心被破坏。 以上结果可推测W71、D122、D123 这三个氨基酸可能凝聚构成了Dfg5 的催化活性中心,Dfg5 可能具有甘露糖苷酶的活性。

图3 Dfg5 活性位点分析Fig.3 Analysis of the putative catalytic active sites of Dfg5
2.4 过表达可溶性Dfg5 蛋白质对dfg5△PMET3DCW1生长的影响
本研究从野生型菌株基因组中扩增出不含前导肽序列的DFG5基因片段(sDFG5),用于编码可溶性Dfg5(sDfg5)。在野生型和dfg5△PMET3DCW1菌株中表达sDfg5 后,用Flag 抗体可在培养基中检测到可溶性Dfg5, 其中野生型菌株的sDfg5 分泌量更少(图4(a))。 研究表明,去除前导肽序列的DFG5 基因片可段编码不含GPI 锚的可溶性Dfg5,并能成功分泌至培养基中。为了进一步检测sDfg5 的活性,研究选取dfg5△PMET3DCW1 菌株研究对象,在不同选择性培养基中检测其生长水平。 在未加甲硫氨酸的培养基中,MET3启动子诱导下的DCW1基因可高表达,突变株和野生型都正常生长(图4(b))。 用含有甲硫氨酸的培养基培养时,MET3 启动子调控下的DCW1 基因无法正常表达, 不表达sDfg5 的dg5△PMET3DCW1菌株生长始终受到抑制, 但过量表达sDfg5的dfg5△PMET3DCW1菌株在培养40 h 后生长得以回补(图4(c))。 这说明sDfg5 仍具有活性,GPI 锚的修饰不影响Dfg5 的功能。
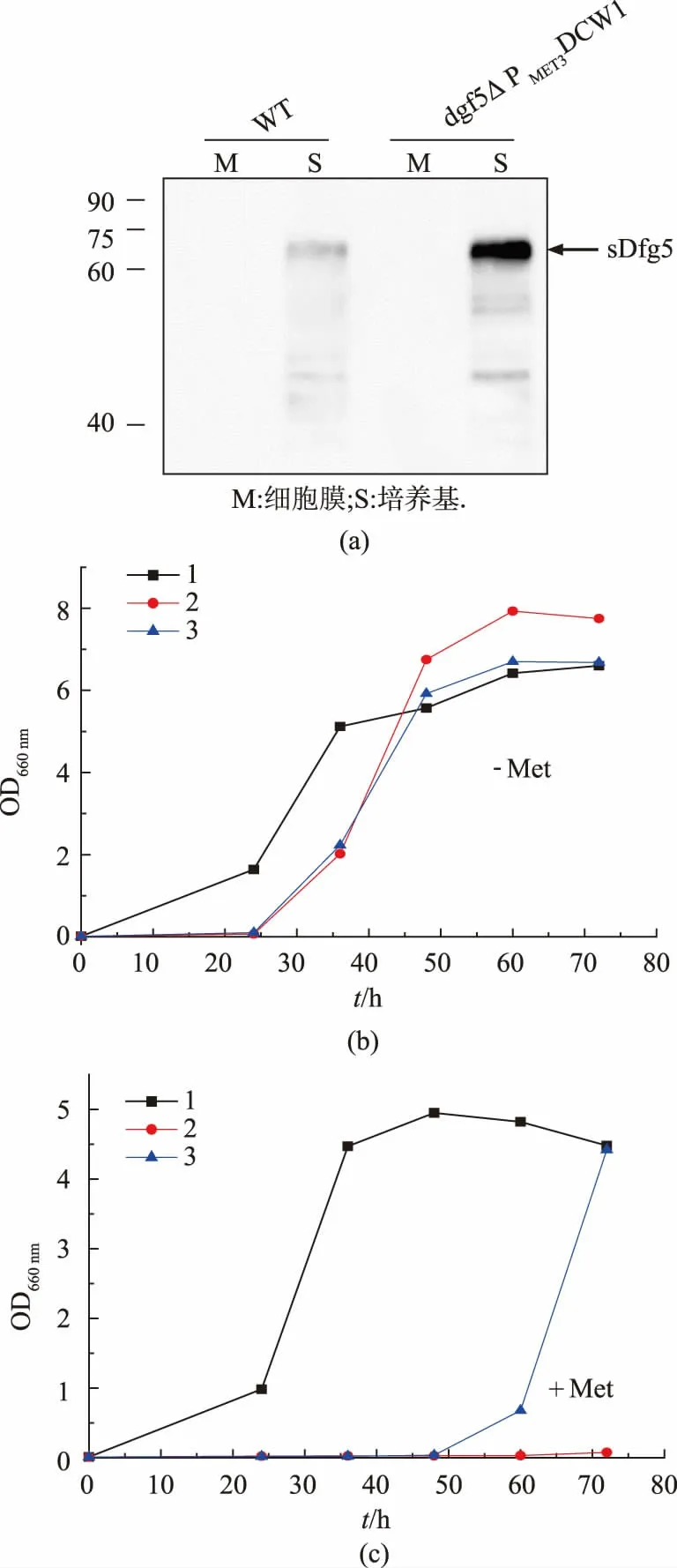
图4 可溶性Dfg5 在条件突变株中的表达情况Fig. 4 Expression of Soluble Dfg5 in condition mutant strain
3 结 语
Dcw1 和Dfg5 是一对同源的GPI 锚定膜蛋白质,据推测可能有糖苷酶活性,参与真菌细胞壁蛋白质合成,但其分子作用机制尚不清楚,也没有表征酶活的数据。作者通过在dfg5△PMET3DCW1条件突变株中表达模式蛋白质Cwp1, 证实在GPI-APs 锚定至细胞壁的过程中,Dcw1 和Dfg5 参与GPI 的切割。对Dfg5 中与甘露糖糖苷酶催化活性相关的四个保守氨基酸位点进行突变, 其中W71、D122、D123这三个位点的单突变蛋白质无法回补致死突变菌株的生长, 说明这三个位点对Dfg5 的活性至关重要,可以推测它可能具有α-甘露糖苷酶的活性。 去除GPI 锚的可溶性Dfg5 可成功从细胞膜分泌至培养中。 体内研究表明,在液体培养基中可溶性Dfg5可回补dfg5△PMET3DCW1条件突变株的生长,说明定位于细胞膜对Dfg5 活性不重要。从培养基中纯化出来的可溶性Dfg5 可进一步用于体外研究,作为筛选抗真菌药物的靶蛋白质。

