血尿酸水平与急性冠脉综合征患者短期预后的相关性分析
符武岛 李伟 郑茵 陈娟 冯光球 戴文鑫 管频 周菲
急性冠脉综合征(ACS)是动脉粥样硬化血栓形成的主要临床表现之一,包括ST 段抬高型心肌梗死(STEMI)、非ST 段抬高型心肌梗死(NSTEMI)和不稳定型心绞痛[1]。斑块表型、冠状动脉血流、内皮功能障碍、微血管功能障碍和炎症是导致ACS 发病的关键机制[2]。研究发现,血尿酸(UA)参与了血管内粥样硬化斑块的形成,并可以破坏斑块的稳定性[3],UA 水平升高可预测动脉高血压、肥胖和糖尿病的发展[4]。然而,UA 是否是心血管疾病的独立预测因素仍存在争议。最近的一项回顾性研究表明,在单一部位行经皮冠状动脉介入(PCI)治疗的ACS 患者中,UA 水平升高是1 年死亡率的独立预测因子[5]。本研究旨在探讨ACS 患者入院时UA 水平与180d 内预后的关系,现报道如下。
1 对象和方法
1.1 对象 回顾性分析2016 年1 月至2018 年5 月在本院心内科、医疗保健中心就诊的ACS 患者1548 例,其中男862 例,女686 例,年龄46~75(62.7±11.6)岁。纳入标准:(1)结合患者的病史、症状及临床辅助检查确诊,病因明确;(2)肾功能正常;(3)身体状况尚可,可耐受治疗;(4)未合并神经系统和精神系统疾病。排除标准:接受别嘌呤醇、苯溴马隆等降UA 药物治疗的患者;STEMI 患者左心室射血分数(LVEF)<30%、NSTEMI 患者LVEF<40%并且正在接受冠状动脉搭桥手术者。本研究经过医院伦理委员会审批通过,所有患者均签署知情同意书。
1.2 方法
1.2.1 资料采集 入院时所有患者均接受体格检查和标准12 导联心电图检查。血压在稳定期、急性期恢复后或出院前多次测量。记录患者心血管疾病的危险因素。收集血脂数据,测量身高、体重和腹围,记录是否有冠心病、外周血管疾病和慢性肾病等病史。
1.2.2 UA 水平检测及分组 入院后立即留取非空腹血样,迅速将血液标本离心,取血清在-80℃环境下冷冻,由检验科专业人员检测UA 水平,测量变异系数为2%。采用肾脏病饮食改良(MDRD)公式获得估算的肾小球滤过率(eGFR)。UA 范围为83.3~708.1μmol/L,根据第P25百分位数(P25=250.1μmol/L),中位数(303.4μmol/L)和第P75百分位数(P75=357.0μmol/L)将研究对象分成4组,A 组UA 水平<250.1μmol/L;B 组UA 水平250.1~303.4μmol/L;C 组UA 水平303.5~357.0μmol/L,D 组UA水平>357.0μmol/L。
1.2.3 随访 所有患者在出院后3、6 个月进行电话随访或门诊复诊,评估临床结果。主要研究终点为:入院后180d 的病死率,180d 内发生的主要不良心血管事件(MACE)。MACE 包括:死亡、心力衰竭、非致命性卒中、非致命性STEMI。评估STEMI 和NSTEMI 的复发情况。早发ACS 定义为≤55 岁的男性ACS 或≤65 岁的女性ACS 患者。新发ACS 定义为初次行PCI 治疗的ACS 患者。
1.3 统计学处理 采用SPSS25.0 统计软件,计量资料以表示,正态分布的计量资料多组比较采用ANOVA分析,两组比较采用独立样本t检验;非正态分布的计量资料以四分位数间距[P5(0P25,P75)]表示,多组比较采用Kruskal-Wallis 检验,两组比较采用Mann-WhitneyU检验。计数资料以百分率表示,比较采用χ2检验。采用Spearman 秩相关进行单因素分析,采用多因素logistic回归分析UA 水平与临床结果的关系。P<0.05 为差异有统计学意义。
2 结果
2.14 组患者入院时临床基线资料比较 见表1。
由表1 可见,4 组男性、高血压病、BMI、Framingham风险评分、代谢综合征、HDL-C、甘油三酯、血肌酐、eGFR 差异均有统计学意义(均P<0.01),余指标差异均无统计学意义(均P>0.05)。
2.24 组患者的随访结果 见表2。
由表2 可见,总体研究对象1548 例,新发ACS 1197 例,其中院内死亡29 例(28 例是院内新发ACS死亡),失访88 例。最终有180d 随访结果的为1431例,其中新发ACS 患者1088 例。在总体和新发ACS 患者中,D 组院内死亡率均最高(均P<0.05),而MACE发病率、死亡、心肌梗死及再发ACS 在各组中差异均无统计学意义(均P>0.05)。
2.3 总体人群和新发ACS 患者UA 水平与院内死亡率相关性的logistic 回归分析 见表3。
由表3 可见,将UA 作为变量,UA>357μmol/L,能明显增加总体人群和新发ACS 人群的院内死亡率风险(均P<0.01),校正相关变量(模型1、模型2)后仍有明显统计学意义(均P<0.05)。
2.4 UA 与C 反应蛋白(CRP)水平的相关性分析 见图1。
由图1 可见,院内死亡患者的UA 与CRP 水平呈正相关(r=0.41,P<0.05),而180d 存活患者和出院后死亡患者UA 与CRP 水平无相关性(r=0.045、0.048,均P>0.05)。
3 讨论
UA 在ACS 中的预后价值尚未得到明确评估[6]。但UA 与高血压、BMI、HDL-C、甘油三酯、代谢综合征和肾功能等危险因素显著相关[7]。Purnima 等[8]发现UA 在高血压、肥胖症和糖尿病患者的动脉粥样硬化过程中起着一定的作用。
本研究发现,ACS 患者入院时UA 水平升高(>357μmol/L)与住院死亡风险增加有关,与年龄、性别、肾功能、代谢综合征等无关。有学者报道,在接受PCI 治疗的STEMI 患者中,21.5%的患者UA 水平较高(>357μmol/L),与院内死亡率独立相关[9]。Ramirez 等[10]研究结果显示,UA 每升高60μmol/L,相当于1 年死亡风险增加12%。ACS 的不同临床表现的亚组分析显示:在UA 水平>416.7μmol/L 的情况下,所有类型的ACS中1 年死亡率的风险均显著增加。Gaubert 等[11]报道的1124例急性心肌梗死(AMI)队列研究中发现,UA(>416.7μmol/L)是预测30d 和长期死亡率的最佳截点值,优于Killip 分级[12]。
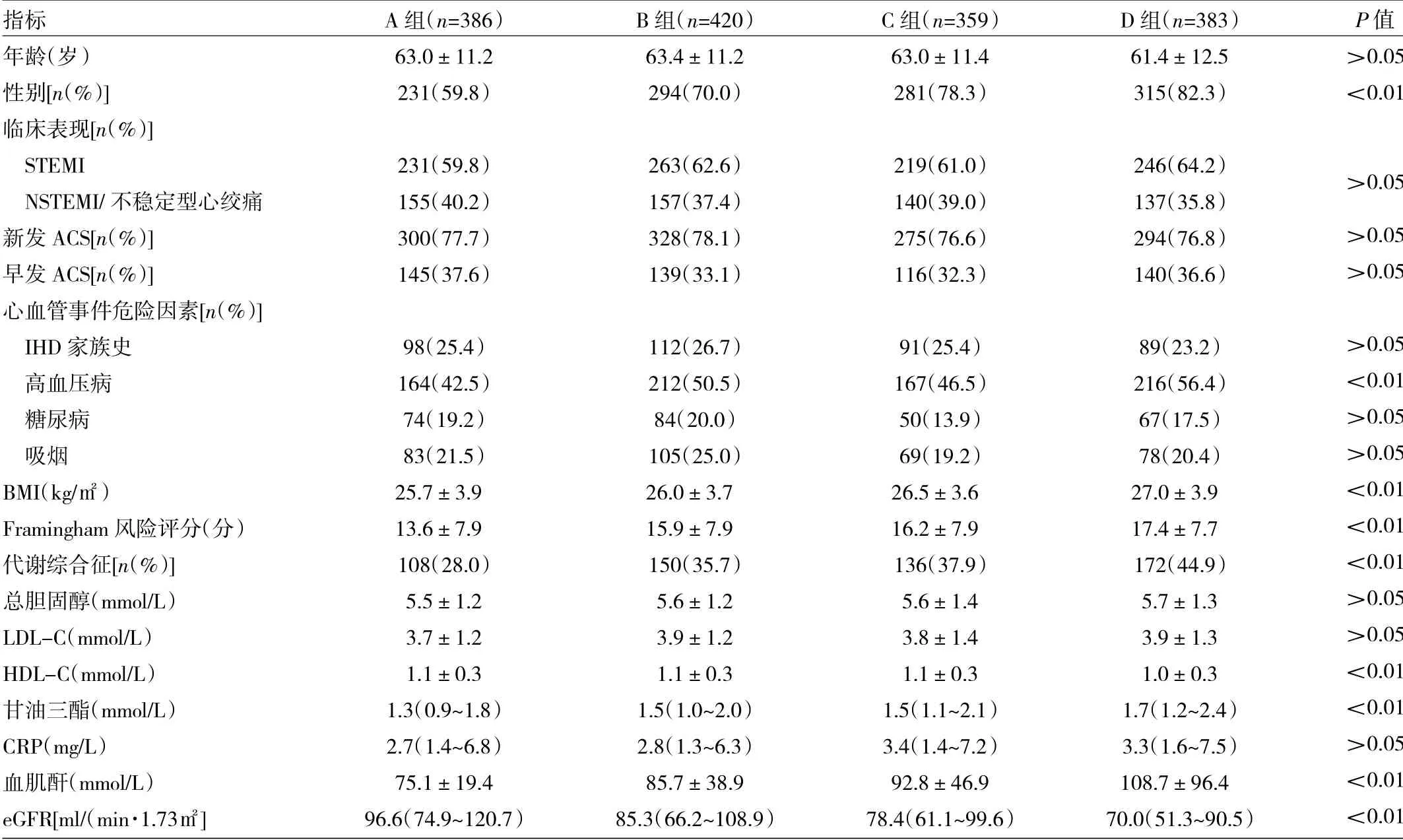
表14 组患者入院时临床基线资料的比较
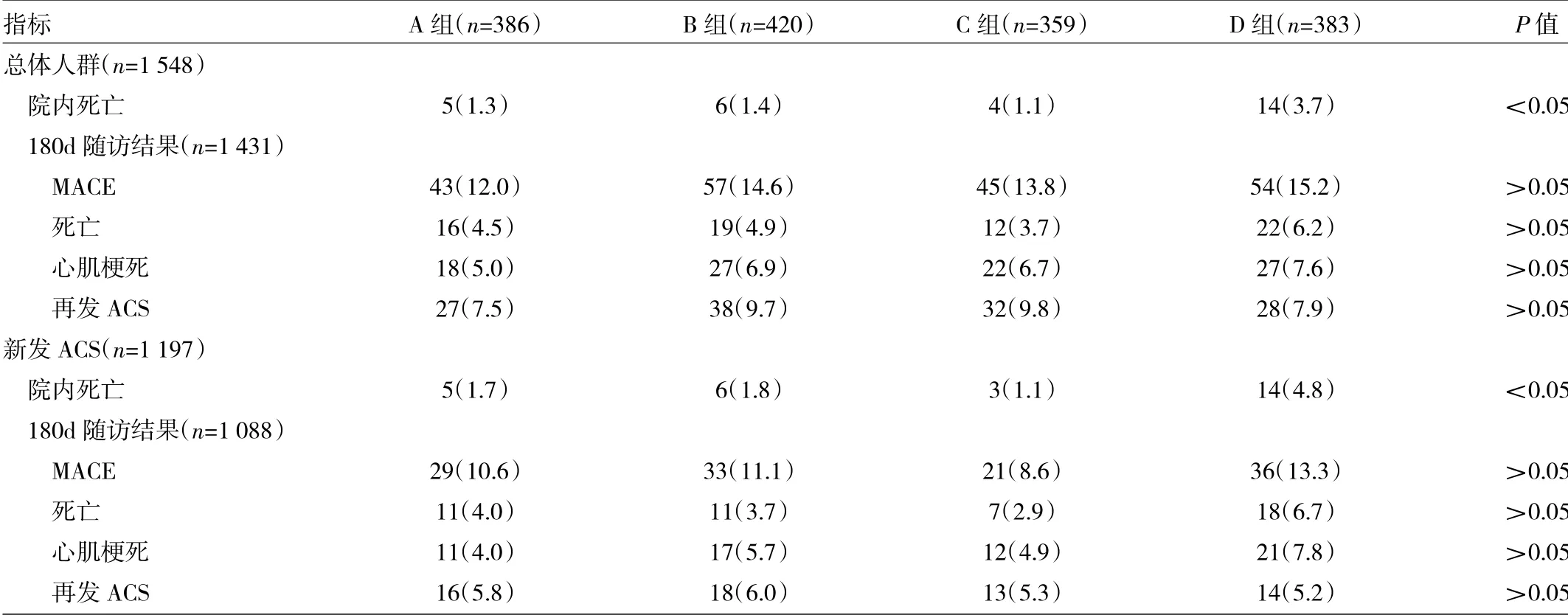
表24 组患者的随访结果[例(%)]
我们的研究将UA 作为变量,当UA 水平>357μmol/L时能明显增加总体人群和新发ACS 人群的院内死亡率风险,校正相关变量(模型1、模型2)后仍有明显统计学意义。目前UA 水平升高的患者院内死亡率增加的病理生理机制尚不完全清楚。有学者认为UA 是氧化应激增
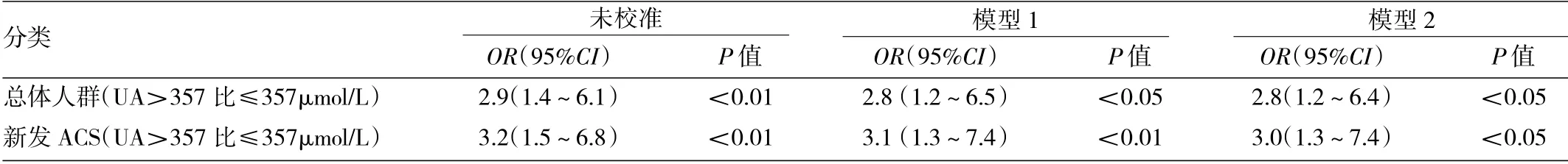
表3 总体人群和新发ACS 患者UA 水平与院内死亡率相关性的logistic 回归分析
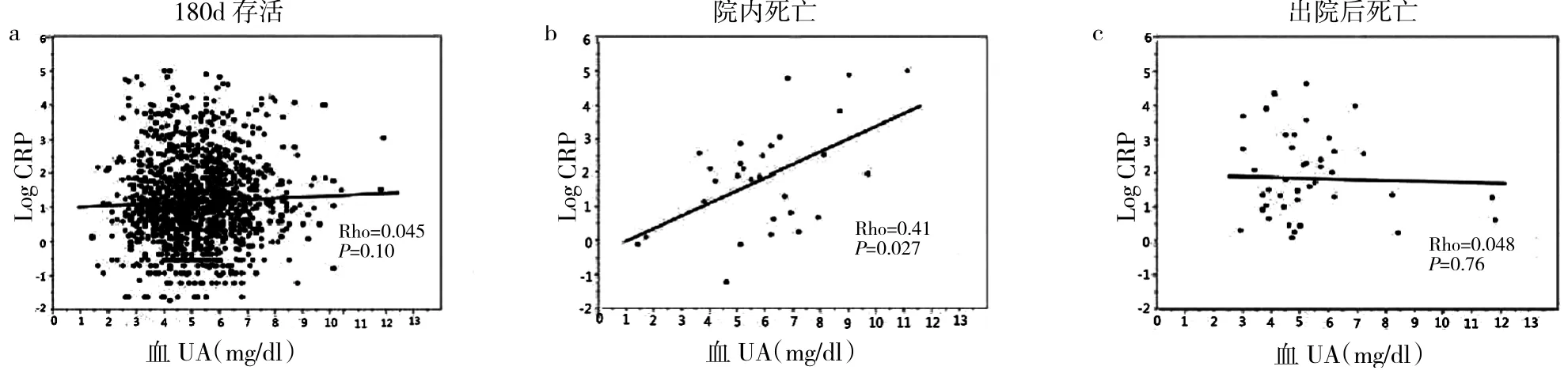
图1 UA 与CRP 水平的相关性分析散点图(a:180d 存活患者UA 与CRP 水平的相关性分析散点图;b:院内死亡患者UA 与CRP 水平的相关性分析散点图;c:出院后死亡患者UA 与CRP 水平的相关性分析散点图)
注:模型1:根据年龄、性别、eGFR[分类≥90,90~60 和≤60 ml/(min·1.73m2)]、代谢综合征进行校准;模型2:根据年龄,性别、eGFR、代谢综合征、血运重建进行校准加的标志物,而氧化应激增加可促进心肌缺血恶化[12]。同时,UA 作为一种具有抗氧化和促氧化双重作用的内源性抗氧化剂,代谢过程中黄嘌呤氧化酶活性增强,促使脂质过氧化反应,增强氧化应激,对细胞内皮产生毒性反应,导致血管内皮功能障碍[13]。另一方面,UA 可诱导单核细胞趋化蛋白(MCP-1)、白介素(IL)-1β、IL-6和肿瘤坏死因子(TNF)-α 的释放[14],而在体外,UA 可促进血管平滑肌细胞增殖,并诱导环氧合酶(COX)-2上调和CRP 的产生[15],从而导致炎症反应加重。UA 是机体内黄嘌呤氧化酶的最终产物,研究表明,UA 水平与冠心病关系密切,其每升高60μmol/L 患者死亡率风险可增加14%,冠心病患者心功能分级及不良预后风险愈高[16]。有学者证实,UA 水平与冠心病发生及冠状动脉病变程度呈正相关[17]。本研究结果表明,随着UA 水平的升高,不良事件发生率明显增多,其原因可能为动脉粥样硬化发生时,患者交感神经系统活性被激活,导致机体内核昔酸代谢活动增强,UA 合成增加。在ACS患者中,UA 水平高于357μmol/L 与短期不良预后密切相关。

