超高压处理对乳制品中蛋白质和酶的影响研究进展
程凯丽,胡志和*,赵旭飞,贾凌云,肖厚栋,丁新宇
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
牛乳富含碳水化合物、脂肪、蛋白质(如酪蛋白、乳清蛋白)、酶、维生素和矿物质等[1]。在原料乳生产和运输期间,由于不洁的挤奶器皿和水、粪便和灰尘、不卫生的车辆,原料乳常被微生物污染。一般采用巴氏灭菌法去除原料乳中的病原微生物,确保食用安全。但是,在热处理过程中,对热敏感的牛乳成分会发生许多物理和化学反应,从而对乳制品的感官特性(味道和风味)和营养价值产生负面影响[2]。这些影响促使人们在研究和工业环境中使用具有更短处理时间和最少热量的新技术,而超高压技术无需额外的热处理就可以杀死食品中的多种致病菌[3],同时延长牛乳保质期,提高牛乳可加工性[4]。鲍志英[5]针对鲜牛乳中的大肠埃希氏菌、猪霍乱沙门氏菌猪霍乱亚种和金黄色葡萄球菌,进行不同压力(100~600 MPa)、不同时间(5~20 min)的处理,分析测定鲜牛乳中几种病原菌经超高压处理前后菌数的变化,发现超高压处理可以快速、高效地杀死食品中的绝大多数细菌。Jermann等[6]也证明,超高压处理可以在环境温度下有效地灭活微生物。
从胶体角度来看,牛乳是蛋白质(主要是酪蛋白和乳清蛋白)、乳化脂肪滴、乳糖和矿物质在水介质中的稳定悬浮液[7]。酪蛋白是牛乳中最主要的蛋白质,占牛乳总蛋白质的80%左右[8],酪蛋白主要由αs1-酪蛋白、αs2-酪蛋白、κ-酪蛋白和β-酪蛋白组成,再经过α-螺旋、β-折叠等方式构成酪蛋白的空间结构。酪蛋白以酪蛋白胶束的形式存在于牛乳中,αs1-酪蛋白和β-酪蛋白在N末端和C末端均有疏水区域;αs2-酪蛋白是亲水性蛋白,其在N末端后疏水区与亲水区交替。虽然αs1-酪蛋白、αs2-酪蛋白、κ-酪蛋白和β-酪蛋白的氨基酸、磷和碳水化合物含量不同,但它们表现出的亲水性相似[9]。与酪蛋白相比,乳清蛋白的天然构象相对亲水,并以小球状蛋白形式存在[10]。在剧烈的环境(pH值、温度、剪切力等)变化中,牛乳蛋白会变性,埋在天然结构中并参与蛋白质间相互作用的疏水位点和活性氨基酸残基暴露。
为延长牛乳保质期并打破地域限制,牛乳被制成多种乳制品,如乳粉、干酪、炼乳和冰激凌等。有时,将牛乳转化为其他乳制品需要加入酶。例如,干酪加工过程中添加凝乳酶能够破坏酪蛋白胶束的稳定性,使副酪蛋白的微粒发生团聚作用而产生凝胶体副酪蛋白钙[11]。乳糖酶可用于生产低乳糖乳制品,供乳糖不耐受人群食用,使乳中营养成分易于被人体吸收并有较好口感[12]。乳清是生产干酪和干酪素的副产品,含有乳糖、维生素和乳清蛋白等营养成分,利用乳糖酶可将乳清中的乳糖分解为葡萄糖和半乳糖,用以制造乳清糖浆或作为添加剂添加到食品中,从而达到综合开发利用乳清资源、减少环境污染的目的[13-14]。
近年来,超高压技术在乳制品加工中的应用日益普及,超高压处理对乳制品中蛋白质和酶活性的影响也逐渐引起人们注意,但这方面的报道较少。本文总结乳制品加工中超高压技术应用的最新进展,重点论述其对乳制品中蛋白质和酶的影响。
1 超高压处理原理
超高压处理是在环境温度下施加100~1 000 MPa压力,以达到灭活包括营养细菌、酵母菌和霉菌在内的病原微生物、钝化酶的活性、延长食品保藏期的目的。超高压处理是一个物理过程,在食品加工中主要利用勒夏特列原理(Le Chatelier’s principle)和帕斯卡定律。根据勒夏特列原理,化学平衡是动态平衡,如果改变影响平衡的一个因素,平衡就向能够减弱这种改变的方向移动,以抗衡这种改变[15]。帕斯卡定律指的是压力的传递是均匀且瞬时的,与食物的大小和几何形状无关。在工业应用中,根据食物类型的不同,处理时间可能从2~30 min不等[16]。尽管压力是在环境温度下施加的,但由于绝热加热,压力每升高100 MPa,温度会升高3~9 ℃(取决于压力传递液和处理时间)[17]。在超高压处理中,压力容器中装有食品,并在所需的时间内施加压力,然后减压,可将流程简化表述为放入食品→加压→保压→卸压→取出食品。
高压处理可以分批,也可以采用半连续或连续模式进行。在分批处理过程,即静态超高压(high hydrostatic pressure,HHP)处理中,将预包装的食物放入压力室,然后密封,将水泵入腔室以排出所有空气,使腔室内积聚压力,直到达到指定的极限。在特定的时间-压力组合下,对产品进行加压和保压,并在完成后打开卸压阀,将腔室减压,然后取出加工食品(图1)。加压所需的时间受压力介质和食物材料的性质影响。一般以水作为压力传递介质,既可缩短加压时间,使产品中的压力保持均匀,又可保持压舱清洁[18]。与其他形式的处理相比,分批处理将预包装食品放入容器,防止了交叉污染的风险,与半连续和连续处理相比,不需要在运行过程中以及对设备与设备间进行清理,具有高效性和简便性,因此分批高压处理是首选。

图1 用于分批高压处理的典型设备[18]Fig. 1Schematic diagram of the typical equipment used for batch high pressure processing[18]
连续处理模式,即超高压均质(ultra-high pressure homogenization,HUPH)处理食品的时间很短,可能导致化学和物理化学性质的变化,包括亚微米/纳米颗粒的形成,也可能会影响食物的生理或毒理特性[19]。与HHP相比,HUPH过程中,液体食品通过移动的活塞被引入并在腔室内完成加压-保压-卸压(图2),在特定时间段内,减压液体食品传送到无菌罐进行贮存或装运[20-21]。

图2 用于半连续高压处理的多容器装置[22]Fig. 2 Schematic diagram of the multi-container unit used for semi-continuous high pressure processing[22]
2 超高压处理对乳蛋白结构及功能的影响
2.1 超高压处理对乳清蛋白结构的影响
在天然状态下,蛋白质之间通过共价键、静电相互作用、氢键和疏水相互作用而稳定。在相对较低的温度下(0~40 ℃),共价键几乎不受超高压处理的影响。因此,蛋白质的一级结构在超高压处理期间保持完整[23]。静电相互作用、氢键和疏水相互作用会影响乳蛋白的二级、三级和四级结构。不同作用力对高压处理的敏感性顺序为疏水相互作用>静电相互作用>氢键>共价键。刁小琴等[24]发现,高压均质处理能够改变蛋白质的二级结构,α-螺旋和β-折叠相对含量减少,β-转角和无规卷曲相对含量增加。Goyal等[23]研究压力对蛋白质溶液总体密度的影响时发现,压力增加了蛋白质周围水的密度,且改变了蛋白质与水分子之间的氢键网络结构。在200 MPa以上的压力下,水分子开始渗透到蛋白质内部,压力大于600 MPa时,蛋白质结构发生显著变化[25-27]。Best[28]、Moir[29]等通过模拟实验研究压力对蛋白质α-螺旋结构稳定性的影响,观察到随着压力的增加,尤其是在100 MPa以上时,压力与α-螺旋的稳定性呈正相关。
2.1.1 超高压处理对β-乳球蛋白(β-lactoglobulin,β-Lg)结构的影响
乳清蛋白在高压下的结构变化对于乳及乳制品尤为重要。β-Lg是牛乳中含量最丰富的乳清蛋白[30],是一种压敏性球状乳清蛋白(含有2 个分子内二硫键和1 个游离巯基),以二聚体形式存在于牛乳中。Vibeke等[31]曾提出压力对β-Lg的作用机理:当施加压力时,β-Lg天然结构展开,从而增加了蛋白质骨架对构象变化的灵活性,并允许水分子渗透到小球的疏水内部;在高压条件下,溶剂和蛋白质之间的水合作用将蛋白质构象转变为不具有三级结构的熔球,如果保持恒定的压力,熔球结构可能会持续存在,但随着压力的增加,蛋白质变性,形成聚集体(图3)。Blayo等[32]详细描述了高压均质处理对β-Lg产生的影响,同时发现蛋白质结构变化和蛋白质水解速率存在一定的关系;虽然β-Lg在生理条件下(0.1 MPa、pH 3~4)可以抵抗消化水解作用,但在300 MPa或更高压力下,其水解速率也会大大提高。Garcia-Mora等[33]发现,压力辅助的蛋白水解作用伴随着β-Lg抗原活性的降低和分离乳清蛋白水解产物的产生,蛋白酶在300 MPa时产生的水解物具有抗炎或抗氧化特性。Goyal等[34]指出,β-Lg在100~400 MPa压力下会展开,从而使游离巯基暴露,压力高于400 MPa时,β-Lg发生大量变性,暴露的巯基往往会与其他乳蛋白形成二硫键。Ambrosi等[35]也有类似发现,他们同时发现当HHP与酶水解结合使用时,蛋白质变性可能会诱导进一步的肽键裂解,从而对乳清蛋白抗原产生潜在的影响,进而对其抗原能力产生潜在影响。

图3 β-Lg的压力诱导变性示意图[31]Fig. 3 Schematic diagram of pressure-induced denaturation of β-Lg[31]
2.1.2 超高压处理对α-乳白蛋白(α-lactalbumin,α-La)结构的影响
α-La也是乳清蛋白的主要成分之一[36],含有5 个酪氨酸残基和3 个色氨酸残基[37]。牛乳中α-La的含量在1.2~1.5 g/L之间变化,α-La是乳清蛋白组分中仅次于β-Lg的第二大成分(20%)。与β-Lg相比,α-La含有4 个分子内二硫键,没有游离巯基,并且表现出特征性最强的熔球态,具有很高的稳定性,因此在压力下更不易变性[38]。Rodiles-López等[38-39]研究高压对α-La功能特性的影响时发现,在600 MPa、55 ℃条件下处理10 min,α-La的溶解度、发泡能力、泡沫稳定性、乳化活性指数和乳液稳定性均出现不同程度的提高;进一步研究HHP处理对α-La某些结构特性的影响,发现随着压力的增加,α-螺旋结构相对含量降低,而β-折叠结构相对含量增加,在不同pH值条件下,高压处理可获得具有不同功能特性的熔球结构。Zou Hui等[37]研究高压处理对α-La与天竺葵素-3-葡萄糖结合相互作用的影响,发现高压处理使α-La结合位点的卷曲结构和位置及残基结构受到影响,但没有改变α-La的典型Ca2+结合位点。
2.2 超高压处理对酪蛋白结构的影响
与高压诱导乳清蛋白展开(即二级和三级结构的变化)不同,酪蛋白在高压处理下的变化研究主要集中在胶束的解离。高压处理可以改变酪蛋白胶束的弹性结构。胶体磷酸钙负责交联酪蛋白并中和带负电荷的磷酸丝氨酸基团[40],在高压条件下会发生增溶,因此胶束的稳定性受到破坏;酪蛋白胶束结构中的疏水和静电相互作用遭到破坏,致使酪蛋白胶束中的酪蛋白单体分子无法结合[41]。赵正涛等[42]研究发现,乳清中的钙离子含量、蛋白质含量及种类均能对酪蛋白凝胶结构的形成及特性产生影响。Cadesky等[43]研究高压处理酪蛋白胶束引起的结构变化时发现,经过150~450 MPa压力处理后,可溶性钙结合的αs1-酪蛋白和αs2-酪蛋白含量增加,350 MPa条件下可溶性钙和磷含量增加,而450 MPa条件下可溶性钙和磷含量呈现降低趋势,可能是由于压力导致磷酸钙的解离,随后酪蛋白胶束变得不稳定。由于分子质量相似,使用常规分离技术分离β-Lg和α-La仍然具有挑战性。Marciniak等[44]研究发现,在高静水压下酪蛋白含量的增加对β-Lg的聚集具有显著影响,而α-La则不受影响,由此特性可分离β-Lg和α-La。
3 超高压处理对乳制品中酶活性的影响
牛乳中大约含有30多种酶类,这些天然酶类主要来源于乳腺细胞,包括脂肪酶、蛋白酶、黄嘌呤氧化酶和乳过氧化物酶等。同时,在乳制品加工过程中人工添加的酶类也有非常重要的作用,如干酪加工时添加的凝乳酶等。酶的本质是蛋白质,其生物学活性取决于分子3D结构产生的特异性位点。因此,酶结构的任何改变都可能改变酶的活性。实际上,HHP处理对疏水键和离子键的影响很大,而对共价键的影响很小,HHP处理会破坏相对较弱的化学键(图4),导致蛋白质解折叠或变性[45]。因此,HHP处理可以改变酶-底物(蛋白质)的相互作用和水解速率。Sakharam等[46]发现,较低的压力(通常为小于350 MPa,取决于酶的类型和处理温度)可以激活酶,而较高的压力(>400 MPa)会导致酶的失活,推测低压处理能够增加氢键数量,而较高的压力会破坏疏水键、氢键和离子键等弱键。因此,HHP能够特异性地影响蛋白质二级结构,并且结构修饰可以是可逆或不可逆的,这取决于加压参数和蛋白质的性质[47]。
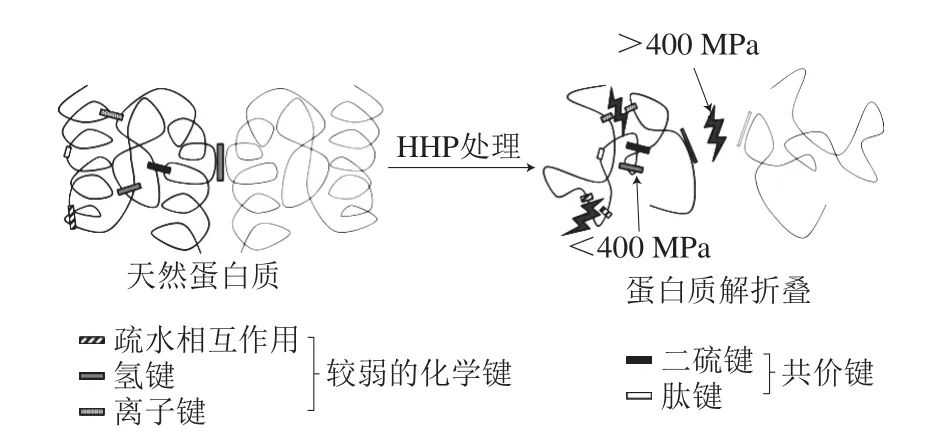
图4 HHP对蛋白质中弱键和共价键的影响[45]Fig. 4Effect of HHP on weak bonds and covalent bonds in proteins[45]
3.1 超高压处理对乳过氧化物酶活性的影响
乳过氧化物酶是一种存在于人和其他哺乳动物乳汁分泌物中的抗菌糖蛋白[48],在过氧化氢存在的条件下,乳过氧化物酶能将硫氰酸盐氧化成抗菌化合物,从而能够杀死革兰氏阳性和革兰氏阴性细菌,生产中一般用于牛乳保鲜。Mazri等[49]研究HHP对脱脂乳和乳清中存在的乳过氧化物酶变性的影响,发现牛乳中的乳过氧化物酶在400 MPa条件下缓慢变性,在高于700 MPa的压力下迅速变性。Pinho等[50]研究HUPH对生脱脂牛乳中乳过氧化物酶活性的影响时发现,在100~250 MPa压力下,酶活力增加约20%,而在300 MPa的压力下酶活力降低约30%。乳过氧化物酶活性的增加可能归因于酶三维结构的变化而导致的活性位点暴露,而酶活性降低可能由于处理过程中压力和温度的共同作用。
3.2 超高压处理对乳脂肪酶活性的影响
脂肪酶可水解乳脂肪中的甘油三酯为甘油二酯、甘油单酯、脂肪酸和甘油,这些成分是乳味香精中酸味和干酪味的主要来源,因此乳脂肪酶一般用于乳品增香[51]。脂肪酶可用于水解乳脂,制备天然乳味香基[52],在压力450 MPa、温度45 ℃、pH 7.5、保压时间10 min条件下,加压处理可使脂肪酶活性提高220%,随着保压时间的延长,经高压处理的脂肪酶活力先上升后下降,而随着贮藏时间的延长,酶活力先下降,之后保持稳定,高压解除后,脂肪酶构象能够部分恢复[53]。Serra等[54]研究HHP对酸乳贮藏过程中脂肪分解的影响,在200、300 MPa条件下对牛乳进行HHP处理,采用处理后牛乳制备的酸乳和采用常规牛乳制备的酸乳游离脂肪酸变化曲线相似,此外,HHP处理过的酸乳从贮藏第1天开始就观察到更高水平的游离脂肪酸。
3.3 超高压处理对乳中蛋白水解酶活性的影响
乳中有多种蛋白酶,牛乳中的蛋白酶水解乳蛋白生成肽和氨基酸,其中纤维蛋白酶对乳及乳制品的品质影响很大,其在乳中也起着水解乳蛋白的作用。Scollard等[55]在牛乳HHP处理后立即测定纤维蛋白酶活性,发现在400 MPa压力下处理过的牛乳纤维蛋白酶活性降低,在300~500 MPa压力下进行HHP处理可能会增加胶束结构,从而促进底物与纤维蛋白酶的结合,提高牛乳的蛋白水解能力。乳蛋白酶中的胰蛋白酶和糜蛋白酶都有分解蛋白质的功能,二者同时作用可将蛋白质分解为小分子的多肽和氨基酸。Izquierdo等[56]研究HHP处理后链霉蛋白酶和α-糜蛋白酶对牛乳中β-Lg抗体的影响,结果表明,在100~300 MPa之间进行高压处理,可增加链霉蛋白酶和α-糜蛋白酶的初始水解速率,在更高压力下,β-Lg抗体可被链霉蛋白酶和α-糜蛋白酶完全水解。Marciniak等[57]总结近年来文献报道的HHP相关研究认为,HHP可促进食品蛋白质的酶解和生物活性肽(bioactive peptides,BPs)的生产。酶促水解(enzymatic hydrolysis,EH)由于具有大众安全健康食品特性而被广泛应用,然而为提高BPs的产量和生物活性,EH需要减少酶水解的时间和数量。HHP能够提高蛋白酶的水解效率,并从各种复杂的生物质中产生高附加值的肽级分。利用HHP作为预处理来破坏牛乳蛋白的稳定性,以提高其对酶解的敏感性,高静压辅助酶解(high hydrostatic pressure-enzymatic hydrolysis,HHP-EH)会显著改变水解产物的肽谱,从而产生新的肽种类并增加特定肽的含量,且HHP-EH生成的肽具有更高的生物活性(图5)。

图5 不同作用条件下天然蛋白酶促水解产生肽的机制[47]Fig. 5 Mechanism of formation of peptides catalyzed by natural proteases under different conditions[47]
3.4 超高压处理对乳中凝乳酶活性的影响
凝乳酶是天冬氨酸蛋白酶的一种,可破坏酪蛋白胶束,使牛乳凝结,凝乳酶的凝乳能力及蛋白水解能力使其成为干酪生产中形成质构和特殊风味的关键性酶,被广泛应用于干酪和酸乳的制作。Mozhaev等[58]发现,对于胰凝乳蛋白酶,在360 MPa压力下,其活力可以提高将近30 倍。de Castro等[59]曾报道,25 ℃环境下,小牛凝乳酶在175~285 MPa的压力下保压14~23 min,其蛋白水解活性和凝乳活性分别提高23%和17%;此外,凝乳过程中,280 MPa压力下加压20 min的小牛凝乳酶储能模量(G’)高于未经处理的酶,加压90 min后G’增加25.8%,因此使用HPP预处理小牛凝乳酶可加速牛乳的凝结并产生更牢固、更均匀的凝胶;随后研究HHP对牛凝乳酶的影响时得出结论,在23 ℃条件下,经222 MPa压力加压5 min,凝乳酶活力最大;HPP在高温(40 ℃)高压(500 MPa)条件下促进凝乳酶失活,而在低压(325 MPa)条件下,相对蛋白水解活性和相对凝乳活性升高。
4 结语
食品工业转向新兴技术的原因主要是提高使用质量或增加附加值,以及改善食品安全问题和延长产品的货架期。HPP加工是一种相对成熟的技术,已广泛用于食品加工中,与其他新兴技术相比,HPP是未来10 年最具有商业价值的技术。牛乳蛋白的理化特性和功能特性可以通过HPP技术改变,与传统热加工相比,在杀灭乳中污染的微生物、灭活各种酶的同时,HPP技术可显著提高牛乳食用品质。尽管近年来HPP技术的应用已在许多国家取得相当大的进展,但是当前仍有许多待解决的问题,如设备庞大、基建费用高、成本较高等。乳业对新技术的适应是一个缓慢的过程,需要进一步研究,以在乳业和其他食品工业中有效实施这些技术。

