套种对浙贝母根际土壤细菌群落结构和功能基因的影响
浙江中医药大学生命科学学院 杭州 310053
浙贝母(Fritillaria thunbergii,F.thunbergii)为百合科多年生草本植物,以地下鳞茎入药,是浙江省道地药材“浙八味”之一[1]。浙贝母性味苦寒,有止咳化痰、清热散结等多种功效,在抗炎、抗肿瘤、降血压、抗氧化等方面具有显著的药理活性[2]。然而,长期种植后容易出现连作障碍,不仅影响了浙贝母的品质及产量,还会随着致病菌的大量增加,从而导致根腐病等引起鳞茎腐烂[1],限制了可持续性发展。为解决此问题,种植中往往采用套种的方法。套种是一种在收获第二季作物之前将另一种作物种植到第二季作物株行间的方法[3]。迄今为止,跟浙贝母套种的作物种类比较广泛,如油葵、玉米、甘蔗、四季豆、黄瓜、生姜,西瓜等。实践表明,套种不仅能够提高浙贝母品质及产量,还能防止浙贝母越夏期间种鳞腐烂,确保种苗数量,改善种苗品质[4-6]。虽然与浙贝母套种的作物种类较多,但不同的套种方式对浙贝母品质和产量的改善结果有所差异,其具体机制目前未知。
研究证实,套种能提高土壤肥力及土地使用率,使得作物产量、营养积累以及生物活性有所提升[7]。植物的生长受到许多因素的影响,包括土壤结构组成、pH、水分、光照、菌落等。在众多影响因素中,土壤中不仅含有植物所需的营养成分,还含有高丰度及巨大多样性的微生物群落[8]。植物与微生物之间的互作是植物生长发育的重要调节因素,介导了植物生理和病理过程[9]。土壤微生物的拮抗作用、对于植物自身代谢的影响以及协助植物抵抗非生物压力刺激的作用,介导了植物物理及化学性状的改变[10-12]。因此,本实验拟应用Miseq高通量测序技术探讨不同套种方式下植物根际土壤微生物群落结构多样性,结合土壤功能基因丰度差异展开深入分析,以了解套种对于浙贝母生长潜在的调节作用和微生态机制。
1 方法
1.1 实验设计与样品采集 以浙江磐安为实验基地,实验分5组,每组20株设置组别:A组即对照组(浙贝无套种)、B组(浙贝套种玉米)、C组(浙贝套种生姜)、D组(浙贝套种黄瓜)、E组(浙贝套种西瓜)。待浙贝成熟后收获,同时以5点采样法同时采收浙贝母根际土(粘附于浙贝母鳞茎周围2cm范围内定义为根际土)500g,过20目筛去除石块以及动植物残体后装入密封袋中,放入冰盒中保存,实验室-20℃冰箱保存,每组3个重复。
1.2 浙贝平均干重、贝母素甲以及贝母素乙含量的测定 将收集的浙贝鳞茎洗净,晒干至恒重后用称量天平称量其干重。同时将收集的浙贝打粉,样品粉末(过四号筛)约2.000g,加浓氨试液4mL浸润1h,精密加入三氯甲烷-甲醇(4:1)的混合液40mL,称定重量,混匀,置80℃水浴中加热回流2h。分别精密吸取对照品溶液 6μL、10μL、15μL,供试品溶液 5~15μL,注入液相色谱仪,测定,用外标两点法对数方程分别计算贝母素甲、贝母素乙的含量。
1.3 土壤总基因组DNA提取、PCR扩增及测序土壤样品预处理后,利用E.Z.N.A.Soil DNA Kit(Omega公司产品,批号:00M5635020000C02Q003)进行土壤总基因组DNA提取,具体方法详见E.Z.N.ASoil DNA Kit的使用说明书,利用琼脂糖凝胶电泳检测DNA完整性。利用Qubit2.0 DNA检测试剂盒(Life公司产品,批号:1759393)对基因组DNA精确定量,以确定聚合酶链式反应(Polymerase Chin Reaction,PCR)中应加入的DNA量。PCR所用的引物已经融合Miseq测序平台的V3-V4通用引物,其中341F 引物 5’-CCCTACACGACGCTCTTCCGATCTGCCTACGGGNGGCWGCAG-3’;805R 引物:5’-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACT-ACHVGGGTATCTAATC-3’。所有引物均由上海生工生物工程公司合成。反应条件:第1轮PCR,94℃预变性3min,前 5 个循环,94℃变性 30s,45℃退火 20s,65℃延伸 30s;后 20个循环,94℃变性 20s,55℃退火 20s,72℃延伸30s,最后72℃延伸5min;第2轮扩增过程引入Illumina桥式PCR兼容引物,95℃预变性30s,共 5个循环,94℃变性 20s,55℃退火 20s,72℃延伸30s,最后72℃延伸5min。PCR结束后,对PCR产物进行琼脂糖电泳检测。选用0.6倍的磁珠(Agencourt AMPure XP,批号:14403400)行 DNA 纯化回收,利用Qubit2.0 DNA检测试剂盒对回收的DNA进行精确定量。每个样品DNA量取10ng,上机进行Miseq测序。
1.4 数据处理 Illumina MiseqTM得到的原始图像数据文件经CASAVA碱基识别(base calling)分析转化为原始测序序列(sequenced reads)。去除引物接头序列,再根据配对末端(paired-end,PE)reads之间的overlap关系,将成对的reads拼接成一条序列,然后按照barcode标签序列识别并区分样品得到各样本数据,最后对各样本数据的质量进行质控过滤,得到各样本有效数据。使用Usearch去除预处理后序列中非扩增区域序列,而后对序列进行测序错误校正,并调用uchime鉴定嵌合体,再将去除嵌合体的序列与数据库代表性序列进行blastn比对,剔除掉低于阈值的比对序列。利用 Usearch、vegan、mothur、PICRUSt等软件进行样本多样性分析、聚类及功能预测分析,绘制样本聚类图、群落结构组分图、功能丰度热图、丰度柱状图等,并进行主成分分析/非度量多维尺度分析(primary component analysis/non-metric multi-dimensional scaling,PCA/NMDS)法进行分析。
1.5 统计学方法 根据功能分类丰度在样本之间的差异,利用元基因组谱的统计分析(Statistical Analysis of Metagenomic Profiles,STAMP)统计检验筛选样本组间的差异功能分类单元,采用方法为Welch’s t-test。最后将检验得到的P值采用FDR行Multiple test correction得到Q值。其余数据利用SPSS 19.0统计软件进行统计学分析,计量资料以±s表示,多组均数比较用单因素方差分析,以P<0.05为差异有统计学意义。本实验将丰度大于10%的细菌门定义为优势门,丰度大于3%的细菌属定义为优势属[13]。
2 结果
2.1 浙贝产量及有效成分含量 对各组浙贝样本进行称量并计算平均干重,结果表明对照组浙贝的平均干重最低,仅为5.316g。各套种组浙贝平均干重均高于对照组,其中以生姜套种组的平均干重最高,为7.875g。套种处理后浙贝中贝母素甲以及贝母素乙的百分含量较对照组有所提升,其中黄瓜套种组的提升最大。但由于各组平均干重的差异,因此各组贝母素甲以及贝母素乙的绝对含量差异较大,其中生姜套种组贝母素甲绝对含量最高,达53mg,而黄瓜套种组的贝母素乙绝对含量最高,为2.6mg。见表1及图1。
2.2 样本相似度分析主成分分析(principal component analysis,PCA) 结果表明,在PCA1贡献率49.5%,PCA2贡献率26.35%的条件下,对照组远离其余各组,表明对照组与各套种组之间样本的细菌结构差异较大。见图2。而Alpha多样性分析结果表明,对照组与玉米套种组的细菌多样性最低,生姜、黄瓜以及西瓜套种组的细菌多样性较高。见表2。
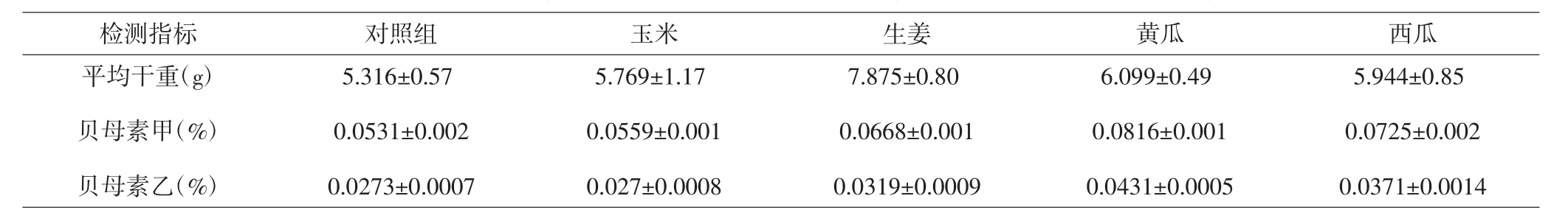
表1 不同套种方式浙贝产量及有效成分含量Tab.1 Yield and active ingredient content of F.thunbergii in different intercropping manners

图1 浙贝产量及有效成分含量柱状图Fig.1 Yield and active ingredient content of F.thunbergii
2.3 细菌群落分析 对浙贝母根际细菌在分类水平上进行检测,共检测出39门、77纲、103目、246科、956属。在97%的相似水平对各样本进行生物信息统计分析,共检测出运算的分类单位(operational taxonomix unit,OTU)数目21976条,各样品之间相似度为62.7%。共有的OTU为219条,约占各样品总量的50.3%~67.8%。各组细菌种类构成情况相似,但细菌种类所占比例有一定差异。门水平丰度前10的菌群占细菌总量的95.7%,分别为变形菌门(47.5%)、酸杆菌门(15.4%)、拟杆菌门(8.2%)、放线菌门(6.2%)、厚壁菌门(5.0%)、疣微菌门(4.4%)、浮霉菌门(3.6%)、芽单胞菌门(2.6%)、绿弯菌门(1.6%)、未分类菌门(1.2%)。其中变形菌门、酸杆菌门为优势门。经套种处理后,变形菌门以及芽孢杆菌门相对丰度下降(P<0.05),但酸杆菌门、放线菌门以及浮霉菌门的相对丰度都表现为升高。各样品在门水平上的细菌群落分布见表3及图3。

图2 PCA主成分分析图Fig.2 PCA principal component analysis
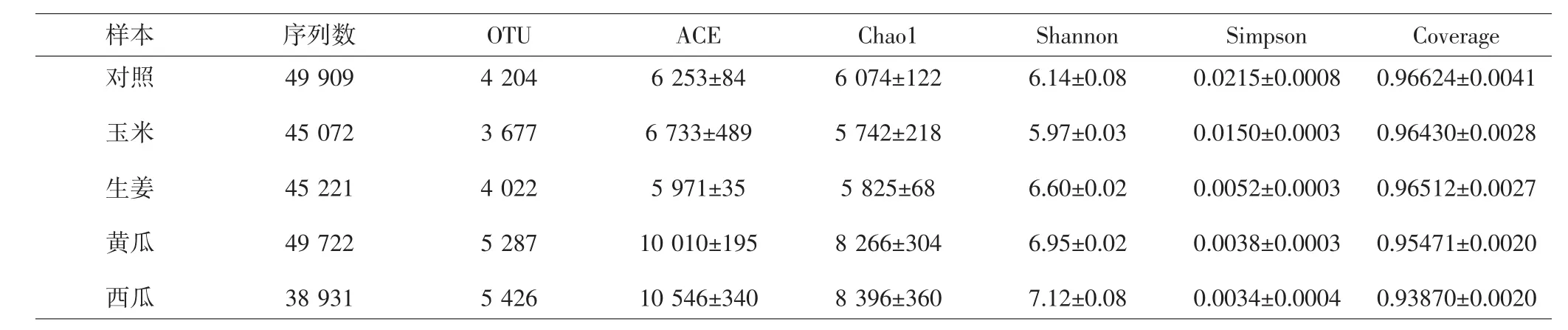
表2 浙贝母根际土壤样本中细菌Alpha多样性Tab.2 Bacterial Alpha diversity in rhizosphere soil of F.thunbergii

表3 不同套种方式浙贝母根际细菌门水平丰度前10位(%)Tab.3 Top ten(%)abundance of rhizobacteria in phylum level of F.thunbergii in different intercropping manners
属水平上相对丰度最大的为未分类菌,占14.6%,其余按丰度大小排名依次为鞘氨醇单胞菌属(4.5%)、Gp6属(3.0%)、Gp1属(2.8%)、芽单胞菌属(2.6%)、放线菌属(2.4%)、副球菌属(2.3%)、微小杆菌属(2.3%)、Gp2属(2.1%)、Subdivision3属(2.0%),共占细菌总量38.5%。其中未分类菌属(14.6%)、鞘氨醇单胞菌属(4.5%)以及Gp6属(3.0%)为优势属。经套种处理后,芽单胞菌属与鞘氨醇单胞菌属相对丰度下降,而Gp1属、Gp2属及副球菌属相对丰度明显升高。此外,套种处理还提高了放线菌属的相对丰度,各套种组与对照组相比具有显著差异(P<0.05)。值得注意的是,生姜套种组中Gp1属、Gp2属以及副球菌属的相对丰度均为各组最高(P<0.05),且具有较高水平的放线菌属。属水平上的细菌分布见表4及图4。
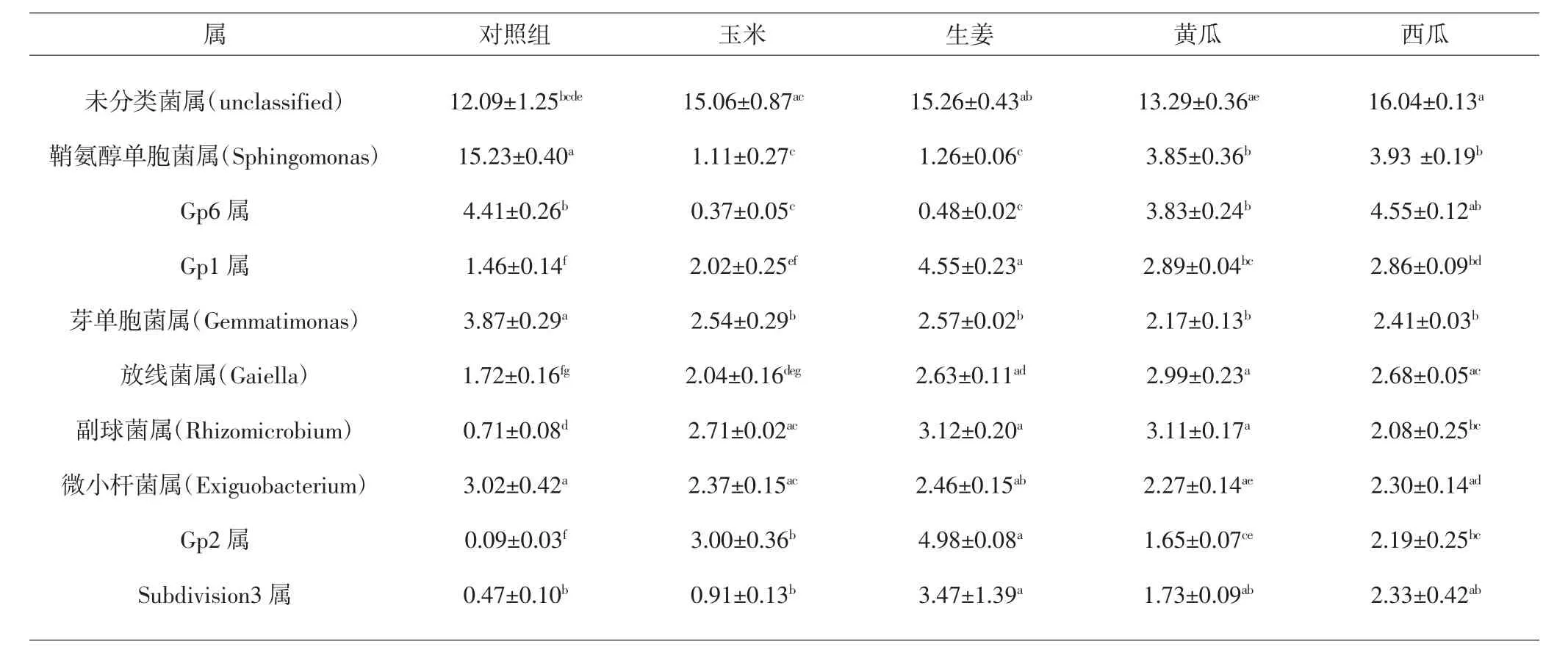
表4 不同套种方式浙贝母根际细菌属水平丰度前10位(%)Tab.4 Top ten(%)abundance of rhizobacteria in genus level of F.thunbergii in different intercropping manners
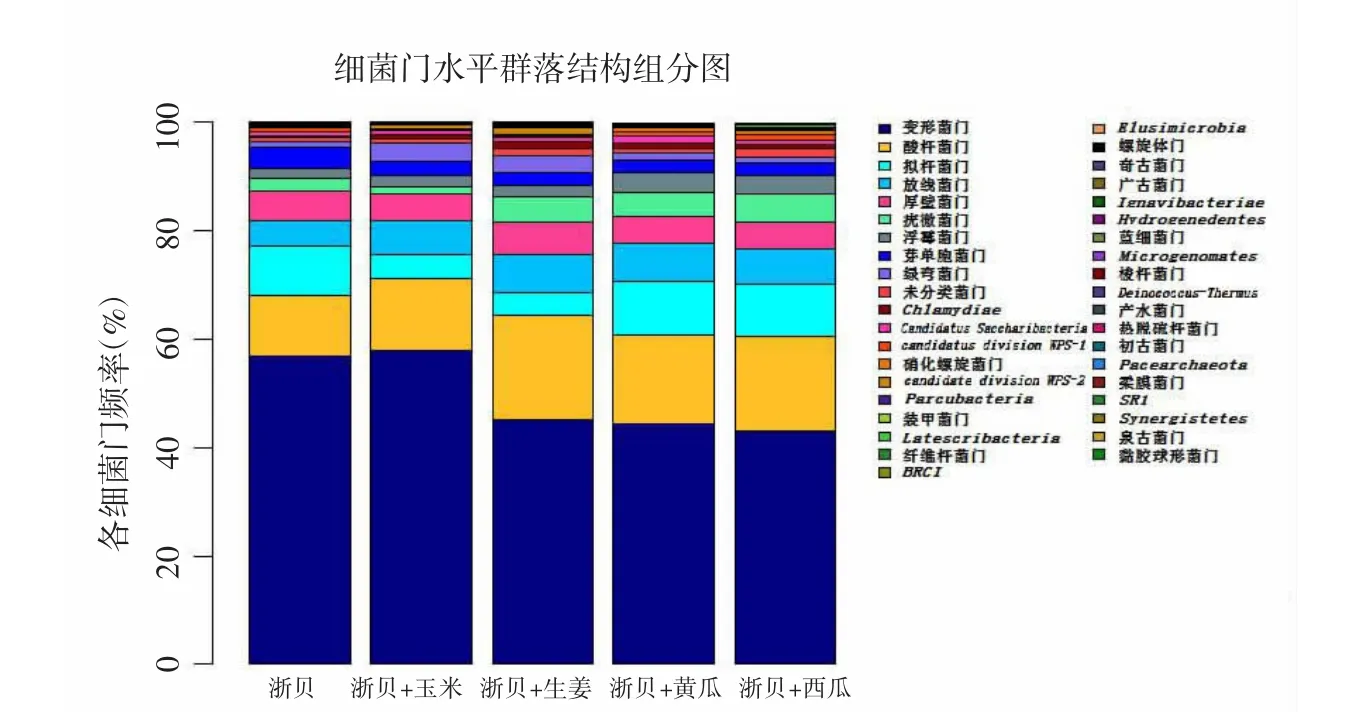
图3 不同套种方式浙贝母根际土壤细菌门水平群落结构组分图Fig.3 Composition of community structure of rhizobacterial in phylum level of different intercropping manners of F.thunbergii
2.4 根际土壤细菌功能基因 相对丰度差异分析基于蛋白相邻类的聚簇(Cluster of Orthologous Groups of proteins,COG)数据库的宏基因组测序数据功能分析以及对应16sPICRUSt预测功能分析根际细菌功能基因,将所得到的Unigenes经COG功能分类后归属到4个功能属性25个类别功能之中,分别为信息储存与处理(17.62%)、代谢(37.40%)、细胞进程及信号(24.92%)以及未表征功能方面(20.07%)。基于PI-CRUSt功能二级分类结果,利用Welch’s t检验比较组间丰度差异。在25个类别功能之中,对照组与各套种组在细胞壁/膜及内源物质合成(6.7%)、次级代谢产物合成/转运/代谢(2.5%)、无机离子转运/代谢(4.7%)以及防御机制(2.1%)方面功能基因丰度差异有统计学意义(P<0.05)。各套种组中细胞壁/膜/内源物质来源、次级代谢产物合成/转运/代谢、无机离子转运代谢以及防御机制这四个方面的功能基因丰度均高于对照组(P<0.05)。值得注意的是,生姜套种组中这4方面的功能基因丰度均为最高,与各组比较差异均有统计学意义(P<0.05)。见图5。

图4 不同套种方式浙贝母根际土壤细菌属水平群落结构组分图Fig.4 Composition of community structure of rhizobacterial in genus level of different intercropping manners of F.thunbergii

图5 基于COG的单种浙贝母与套种浙贝母之间根际土壤细菌功能基因丰度差异Fig.5 Differences in rhizobacterial functional genes abundance between single type and interplanted F.thunbergii based on COG database
3 讨论
本实验结果证明套种能够通过改变根际土壤微生物结构来提高浙贝产量及品质,但各组间具有一定差异。生姜、黄瓜、西瓜套种组的产量及有效成分含量较对照组以及玉米套种组的产量更高,同时也具有更高的细菌多样性,其中GP1、GP2以及副球菌属的含量明显高于对照组和玉米套种组。玉米套种组不管从产量还是有效成分含量方面与对照组相比都无明显差异,表明浙贝与玉米套种对其生长无明显调节作用。利用Pearson相关性分析来分析各菌属与浙贝产量以及有效成分含量之间的相关性,结果表明浙贝干重与GP1属之间呈显著相关(相关性系数为0.890,P<0.05)。虽然浙贝干重与GP2属以及Subdivision3属的相关性不显著,但也具有较高的相关性(相关性系数分别为0.770、0.827),表明这两种菌属可能对浙贝生长具有促进作用。而放线菌则与贝母素甲和贝母素乙呈显著相关(相关性系数分别为0.969、0.907,P<0.05)。值得注意的是,虽然生姜套种组的贝母素甲以及贝母素乙含量百分比不是最高,但生姜套种组的产量为各组最高,且Gp1属、Gp2属以及副球菌属的相对丰度均为各组最高(P<0.05),表明与生姜套种对于浙贝生长具有明显的促进作用。
研究表明,套种能够提高贝母产量,而本实验结果也证实了这个结论[5-7]。在浙江磐安地区,将贝母与其他作物套种是提高浙贝母产量的普遍做法,其中玉米、生姜、黄瓜、西瓜等是与浙贝母套种最常用的作物。浙贝药用部位为鳞茎,而根际则是植物根系周围大量微生物趋向的热点[14]。土壤中的植物生长促进微生物能够通过生物肥料、根系调节等机制促进植物生长[15-17]。经套种处理后,细菌多样性升高,其中GP1属、GP2属以及副球菌属的相对丰度上升,且生姜套种组中这三种菌的相对丰度最高。而Gp1属以及Gp2属以及副球菌属都与氮磷元素的代谢相关,能够促进植物的生长[18-19]。副球菌属能够产生铁载体,水解酶和IAA,并溶解磷酸盐[20]。Gp1以及Gp2属于酸杆菌门,能够促进植物激素吲哚-3-乙酸的产生和铁的吸收[21]。因此,套种可能通过提高氮磷代谢相关微生物的含量,使得根际中植物所需的营养物质浓度升高,从而有利于浙贝生长,而与生姜套种可能是促进贝母生长最有利的方式。
浙贝母主要的土传病害为根腐病及黑霉病,能够引起贝母鳞茎的腐烂。本实验中,套种后土壤中放线菌相对丰度明显上升,大约提高了19%~74%,其中生姜套种组提高了53%。研究表明,放线菌对于尖孢镰刀菌具有拮抗活性,而尖孢镰刀菌是贝母根腐病的主要致病菌[22]。此外,放线菌对于贝母黑腐病致病菌座盘菌也具有拮抗作用[23]。另有研究表明,小麦、玉米等作物可以释放苯丙恶嗪类防御性次级代谢产物,并改变下一代根际相关微生物群落以及提高植物防御[24]。因此,生姜、黄瓜以及西瓜很可能通过分泌次级代谢产物来提高浙贝母根际放线菌等生防菌的含量,从而增强对于致病菌的防御能力。而生物碱是植物用于抵御病原微生物的重要物质。最近的研究表明,细菌以及放线菌与生物碱含量之间具有相关性,可能参与了生物碱的合成[25]。本实验证明了放线菌与贝母素甲以及贝母素乙之间显著的相关性,而贝母素甲以及贝母素乙是浙贝生物碱类物质的药效指标成分。因此,套种可能通过提高土壤中细菌以及放线菌含量来促进浙贝贝母素甲以及贝母素乙的合成从而增强其抗病能力。
基于PICRUSt功能二级分类结果,比较组间功能丰度差异发现,套种提高了细胞壁/膜/内源物质合成、次级代谢产物合成/转运/代谢、无机离子转运代谢(代谢属性)以及防御机制4个方面功能基因丰度,而生姜套种组中这4个方面的功能基因丰度均为最高。土壤微生物在代谢过程中往往会产生许多代谢产物,如抗生素、亚硝酸盐等,这些化合物的产生都与代谢属性的功能基因有关[26-27]。本实验中,生姜套种组中的GP1属、GP2属以及副球菌属的相对丰度较其他套种组更高,同时也具有更高丰度的代谢属性功能基因。因此我们推测,合成代谢方面的功能基因丰度增加可能与这三种细菌有关。虽然生姜套种组的放线菌含量不是最高,但却具有最高丰度的防御功能基因,这可能是由于生姜套种组中还存在其他的生防菌,使得生姜套种组的防御能力优于其他各组,而代谢以及防御方面功能基因丰度的提高则意味着根际代谢能力以及对于致病菌预防能力的增强。
套种是在浙贝母种植过程中经过不断实践摸索出来的种植方式,对于浙贝连作障碍的改善作用已经在长时间的劳作实践中被广泛认可。本实验结果表明,套种能够改变根际菌群结构,提高细菌多样性,增加植物生长促进微生物及生防菌的含量,从而提高浙贝产量和品质。其中以生姜套种组的产量提升较大,而黄瓜与西瓜套种组的品质提升较大。但结合药效成分的绝对含量以及经济效益综合来看,生姜是与浙贝套种的最优选择。

