三氧化二砷联合丹参酮对肝癌的作用效果与机制研究
廖广辉张广顺楼招欢程汝滨张光霁
1.浙江中医药大学药学院 杭州 310053 2.浙江中医药大学基础医学院
原发性肝癌位居全球常见恶性肿瘤发病第5位,占恶性肿瘤相关死因的第2位[1]。2015年中国癌症统计数据显示,我国新发肿瘤病例为429.2万例,死亡病例为281.4万例,其中肝癌新发46.61万例(列第4位),死亡42.21万例(列第3位),因此,肝癌已成为当前我国面临的一个严峻的公共健康问题[2]。
化疗是中晚期肝癌的主要治疗手段,但现有化疗方案存在疗效差、不良反应重等问题。 三氧化二砷(arsenic trioxide,As2O3)是中药砒霜的主要成分,临床已用于复发急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)的治疗。尽管低剂量的As2O3已在2004年被国家药品监督管理局批准用于治疗中晚期肝癌,但单独使用低剂量As2O3治疗肝癌效果有限[3]。一些学者将低剂量的As2O3与冬凌草素、染料木素等药物联合使用,显示出了一定的抗肝癌效果[4-5]。
笔者前期研究发现,高剂量的As2O3可以抑制肝癌移植瘤的生长,但对血液系统的影响较大,As2O3与丹参的有效成分隐丹参酮配伍后,在降低As2O3使用剂量的同时,同样可以显著抑制肝癌裸鼠移植瘤的生长,而且能够减轻对血液系统的影响[6]。进一步探讨As2O3-丹参酮体外抗肿瘤的作用机制发现,As2O3-丹参酮作用于肝癌bel-7404细胞具有协同增效作用,其协同机制可能与线粒体途径和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路有关。本文拟重点研究As2O3-丹参酮抗肝癌裸鼠移植瘤的作用效果,以期为As2O3-丹参酮抗肝癌的临床应用提供实验依据。
1 材料和方法
1.1 主要试剂 As2O3注射液购于北京双鹭药业股份有限公司(规格:10mg/支,批号:20130503);丹参酮胶囊购于河北兴隆希力药业有限公司(规格:0.25g/粒,批号:20130610),使用时将丹参酮胶囊粉末进一步研磨,以0.9%氯化钠溶液溶解,加少许吐温80助溶,终浓度为50mg·mL-1,临用前充分混悬。靶向聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)、Bax、X 连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)抗体均购于 Cell Signaling Technology 公司(批号:9532、2774、2042);β-肌动蛋白(β-actin)抗体购于Sigma-Aldrich公司(批号:A1978)。
1.2 细胞株与实验动物 人Bel-7404肝癌细胞由浙江省中医院中心实验室提供。5周龄SPF级雄性BALB/C-nu裸鼠40只,体质量18~20g,购于上海西普尔-必凯实验动物有限公司 [实验动物生产许可证号:SCXK(沪)2008-0016],饲养于浙江中医药大学动物实验中心SPF级小鼠饲养室 [实验动物使用许可证:SYXK(浙)2008-0115]。
1.3 实验设备 全自动血液细胞分析仪购于拜耳医药保健公司;7020全自动生化分析仪为日立公司产品;STP120脱水机、AP280-2包埋机、HM335E切片机均购于德国Microm公司;Nikon eclipse 80i显微镜购于日本Nikon公司;DRP-9052型电热恒温箱为上海森信实验仪器有限公司产品。
1.4 方法
1.4.1 裸鼠人肝癌细胞移植瘤模型的建立及分组人肝癌细胞Bel-7404常规培养至对数生长期,消化制成5×106个/mL的细胞悬液,将0.2mL细胞悬液皮下注射接种于BALB/C-nu裸鼠右侧背部近前腋处皮下。待移植瘤生长至体积100mm3左右,将裸鼠随机分为5组,模型对照组、As2O3单用组(As2O3低剂量组,2.5mg/kg)、阳性对照组(As2O3高剂量组,5.0mg/kg)、丹参酮单用组 (500mg/kg)、As2O3-丹参酮组(As2O32.5mg/kg+丹参酮500mg/kg),每组8只。各组腹腔注射给药,1次/d,共19d,药物剂量依据前期实验确定。实验期间密切观察和记录各组动物体质量、摄食量、活动和精神状态的变化情况。每隔3d测量瘤体体积,并绘制肿瘤生长曲线,肿瘤体积计算公式如下:V=a×b2×π/6(V:肿瘤近似体积;a:瘤体长径;b:瘤体短径)。最后1次给药后1d,各组裸鼠摘眼球处死,收集外周血标本,分离瘤块,称量质量并计算肿瘤抑制率,计算公式如下:肿瘤抑制率(%)=(模型对照组平均瘤块质量-各治疗组平均瘤块质量)/模型对照组平均瘤块质量×100%。将肿瘤组织分为两部分,一部分以10%甲醛溶液固定,一部分液氮保存。
1.4.2 原位末端转移酶标记(TdT-mediated dUTP nick end labeling,TUNEL)法检测瘤体组织细胞凋亡10%甲醛溶液固定的瘤体标本经脱水、石蜡包埋并切片,玻片经预处理后,各组中加入TUNEL反应混合液50μL,阴性对照加入荧光素标记的dUTP液50μL,37℃湿盒中避光反应1h,PBS漂洗3次;待玻片干燥后再加入过氧化物酶(peroxidase,POD)转化剂 50μL,苏木素复染,显微镜下观察,每张切片随机选择3~5个高倍视野拍照。应用Image-Pro Plus 6.0软件分析图像,分析细胞凋亡情况并计算每张照片细胞凋亡率,细胞凋亡率(%)=凋亡细胞数/总细胞数×100%。
1.4.3 免疫组化检测凋亡相关蛋白表达 切片置60℃烤箱烘烤2h,脱蜡至水,蒸馏水洗2min,高压热修复2min,自来水冷却,3%H2O2溶液阻断10min;PBS洗涤3次后分别滴加一抗,模型对照组以PBS代替,37℃孵育60min后以PBS洗涤并滴加二抗,37℃孵育 60min,洗涤后 DAB 显色 5~10min,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树脂封片,显微镜拍照。镜下每张切片随机选择3~5个高倍视野拍照,应用Carl Zeiss Imaging Systems图像分析软件分析图像,计算各切片的光密度值并取平均值,以此评价凋亡相关蛋白的表达水平。
1.4.4 Wester blot检测凋亡相关蛋白表达 取少许肿瘤组织在液氮环境下充分碾磨,加入100μL细胞裂解液,冰上裂解30min。4℃下12 000r/min离心15min,收集上清液。蛋白定量后各组取总蛋白50mg,电泳后转膜,脱脂牛奶封闭1h,1:1 000一抗稀释液孵育,4℃过夜。TBST洗膜3次,再与相应的辣根过氧化物酶标记的二抗(稀释比例1:1 000)室温孵育2h,TBST洗膜3次,过氧化物酶法显色,凝胶纤维摄像系统拍照并处理图像。
1.5 统计学分析 应用SPSS 16.0统计软件进行统计学分析。计量资料以±s表示,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组裸鼠移植瘤生长情况比较 生长曲线表明,随着给药时间延长,As2O3单用组、丹参酮单用组、As2O3-丹参酮组以及阳性对照组均表现出明显的抑瘤作用。与模型对照组比较,给药19d后As2O3单用组、丹参酮单用组、As2O3-丹参酮组以及阳性对照组瘤体体积明显缩小(P<0.01);与阳性对照组比较,As2O3-丹参酮组的抑瘤效果更显著(P<0.05)。见图1、2。与模型对照组比较,给药19d后As2O3单用组、阳性对照组、丹参酮单用组及As2O3-丹参酮组平均瘤块质量显著降低(P<0.01)。见图3。
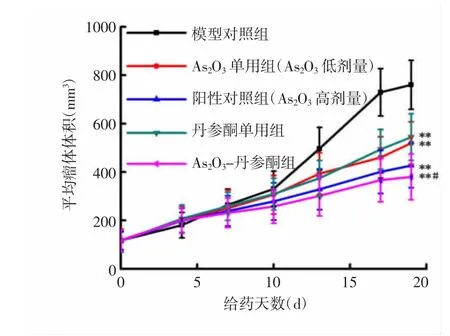
图1 各组裸鼠移植瘤生长曲线比较Fig.1 Comparison of growth curves of transplanted tumors in each group
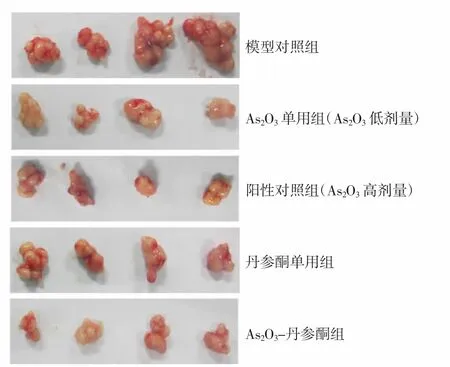
图2 各组裸鼠移植瘤体体积比较Fig.2 Comparison of the size of transplanted tumors in each group
2.2 各组裸鼠血常规指标比较 与模型对照组比较,As2O3单用组、阳性对照组、As2O3-丹参酮组白细胞(white blood cell,WBC)计数均上调,其中 As2O3单用组WBC计数差异具有统计学意义(P<0.05);与阳性对照组比较,As2O3-丹参酮组WBC计数上调,但差异无统计学意义(P>0.05)。与模型对照组比较,As2O3单用组、阳性对照组红细胞(red blood cell,RBC)计数显著下调(P<0.05,P<0.01);与阳性对照组比较,As2O3-丹参酮组RBC计数上调,但差异无统计学意义(P>0.05)。与模型对照组比较,各治疗组血红蛋白(hemoglobin,HGB)水平均下调,其中阳性对照组差异具有统计学意义(P<0.01);与阳性对照组比较,As2O3-丹参酮组HGB水平上调,但差异无统计学意义(P>0.05)。与模型对照组比较,As2O3单用组、阳性对照组、As2O3-丹参酮组血小板(platelet,PLT)计数均上调,其中As2O3单用组和阳性对照组PLT计数差异具有统计学意义(P<0.01);与阳性对照组比较,As2O3-丹参酮组PLT计数下调,但差异无统计学意义(P>0.05)。见表 1。
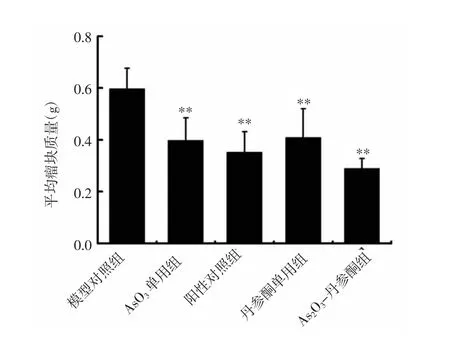
图3 各组裸鼠移植瘤瘤块质量比较Fig.3 Comparison of the mass of transplanted tumors in each group
表1 各组裸鼠血常规指标比较(±s)Tab.1 Comparison of blood routine indexes in each group(±s)
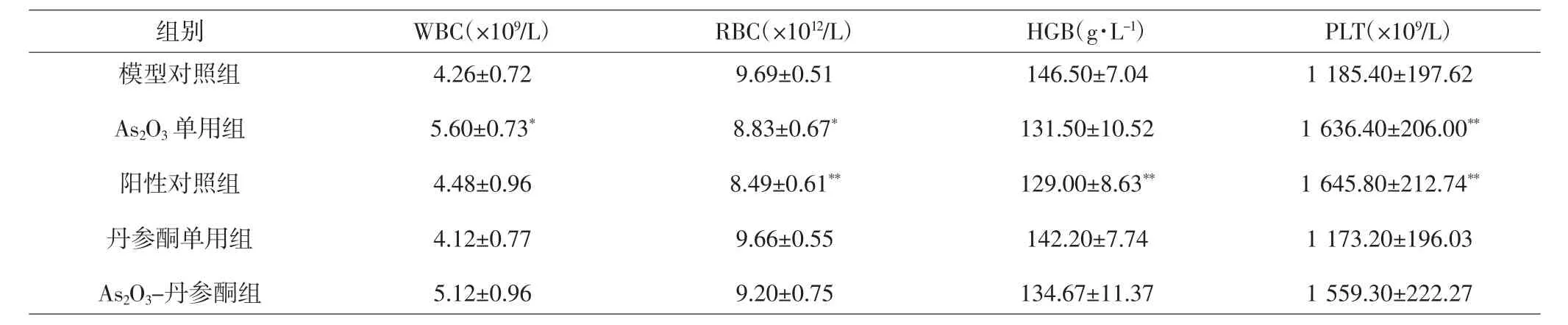
表1 各组裸鼠血常规指标比较(±s)Tab.1 Comparison of blood routine indexes in each group(±s)
注:与模型对照组比较,*P<0.05,**P<0.01Note:Compared with model control group,*P<0.05,**P<0.01
组别 WBC(×109/L) RBC(×1012/L) HGB(g·L-1) PLT(×109/L)模型对照组As2O3单用组阳性对照组丹参酮单用组As2O3-丹参酮组4.26±0.72 5.60±0.73*4.48±0.96 4.12±0.77 5.12±0.96 9.69±0.51 8.83±0.67*8.49±0.61**9.66±0.55 9.20±0.75 146.50±7.04 131.50±10.52 129.00±8.63**142.20±7.74 134.67±11.37 1 185.40±197.62 1 636.40±206.00**1 645.80±212.74**1 173.20±196.03 1 559.30±222.27
2.3 各组裸鼠肝肾功能比较 与模型对照组比较,As2O3单用组、阳性对照组与As2O3-丹参酮组丙氨酸氨基转移酶(alanine aminotransferase,ALT)水平上调,但差异无统计学意义(P>0.05);与阳性对照组比较,丹参酮单用组ALT水平下调,差异有统计学意义(P<0.05)。与模型对照组比较,各治疗组中天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平均下调,其中丹参酮单用组差异有统计学意义(P<0.01);与阳性对照组比较,As2O3-丹参酮组AST水平差异无统计学意义(P>0.05)。与模型对照组比较,各治疗组中尿素氮(blood urea nitrogen,BUN)水平下调,其中丹参酮单用组差异有统计学意义(P<0.05);与阳性对照组比较,As2O3-丹参酮组BUN水平上调,但差异无统计学意义(P>0.05)。与模型对照组比较,各治疗组肌酐(creatinine,CREA)水平均下调,其中阳性对照组、丹参酮单用组和As2O3-丹参酮组CREA水平差异有统计学意义(P<0.05,P<0.01);与阳性对照组比较,As2O3-丹参酮组CREA水平差异无统计学意义(P>0.05)。见表 2。
2.4 各组裸鼠肿瘤组织细胞凋亡情况比较 与模型对照组比较,各治疗组凋亡率均明显上调,具有统计学差异(P<0.01);与阳性对照组比较,As2O3-丹参酮组凋亡率显著上调(P<0.01)。见表3、图4。
表2 各组裸鼠肝肾功能比较(±s)Tab.2 Comparison of liver and kidney function in each group(±s)
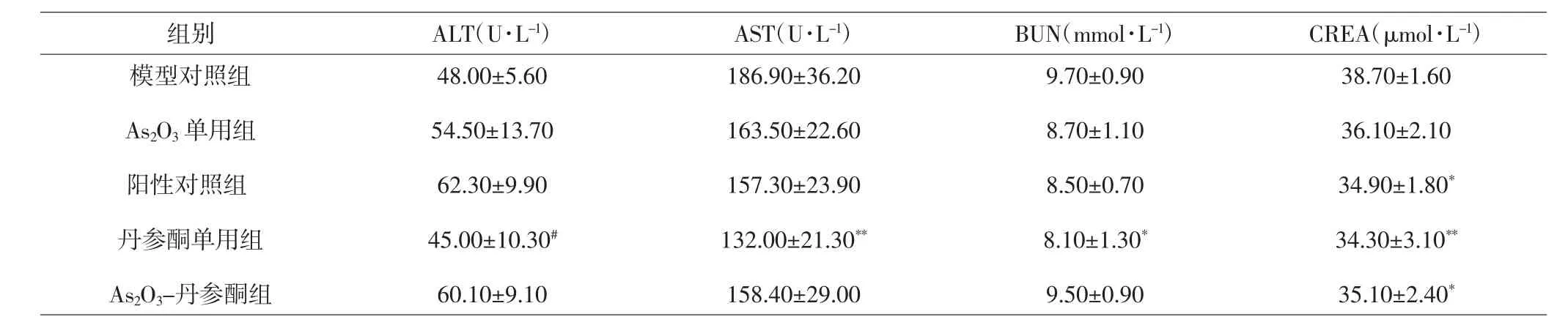
表2 各组裸鼠肝肾功能比较(±s)Tab.2 Comparison of liver and kidney function in each group(±s)
注:与模型对照组比较,*P<0.05,**P<0.01;与阳性对照组比较,#P<0.05Note:Compared with model control group,*P<0.05,**P<0.01;compared with positive control group,#P<0.05
组别 ALT(U·L-1) AST(U·L-1) BUN(mmol·L-1) CREA(μmol·L-1)模型对照组As2O3单用组阳性对照组丹参酮单用组As2O3-丹参酮组48.00±5.60 54.50±13.70 62.30±9.90 45.00±10.30#60.10±9.10 186.90±36.20 163.50±22.60 157.30±23.90 132.00±21.30**158.40±29.00 9.70±0.90 8.70±1.10 8.50±0.70 8.10±1.30*9.50±0.90 38.70±1.60 36.10±2.10 34.90±1.80*34.30±3.10**35.10±2.40*
2.5 各组裸鼠肿瘤组织凋亡相关蛋白表达比较 与模型对照组比较,各治疗组Bax表达明显上调(P<0.05,P<0.01);与阳性对照组比较,As2O3-丹参酮组Bax表达显著上调(P<0.01)。与模型对照组比较,各治疗组XIAP表达均明显下调(P<0.01);与阳性对照组比较,As2O3-丹参酮组XIAP表达下调,但差异无统计学意义(P>0.05)。与模型对照组比较,各治疗组PARP表达均明显上调(P<0.01);与阳性对照组比较,As2O3-丹参酮组表达上调,但差异无统计学意义(P>0.05)。见表 4、图 4。
表3 各组肿瘤组织细胞凋亡率比较(±s,%)Tab.3 Comparison of apoptotic rate of tumor tissue in each group(±s,%)

表3 各组肿瘤组织细胞凋亡率比较(±s,%)Tab.3 Comparison of apoptotic rate of tumor tissue in each group(±s,%)
注:与模型对照组比较,**P<0.01;与阳性对照组比较,##P<0.01Note:Compared with model control group,**P<0.01;compared with positive control group,##P<0.01
组别细胞凋亡率模型对照组As2O3单用组阳性对照组丹参酮单用组As2O3-丹参酮组6.20±1.43 9.70±1.37**20.96±2.29**15.90±1.60**28.99±2.70**##
2.6 各组裸鼠肿瘤组织凋亡相关蛋白表达比较 与模型对照组比较,阳性对照组、丹参酮单用组、As2O3-丹参酮组Bax表达显著上调(P<0.01);与阳性对照组比较,As2O3-丹参酮组Bax表达显著上调(P<0.01)。与模型对照组比较,丹参酮单用组、As2O3-丹参酮组PARP 表达显著上调(P<0.01),As2O3单用组、阳性对照组的表达显著下调(P<0.01);与阳性对照组比较,As2O3-丹参酮组PARP表达显著上调(P<0.01)。与模型对照组比较,阳性对照组、丹参酮单用组、As2O3-丹参酮组XIAP表达显著下调(P<0.01);与阳性对照组比较,As2O3-丹参酮组XIAP表达略上调,但差异无统计学意义(P>0.05)。见图 5、6。
表4 各组荷瘤裸鼠凋亡相关蛋白平均光密度比较(±s)Tab.4 Comparison of the average light density of apoptosis related proteins in each group(±s)
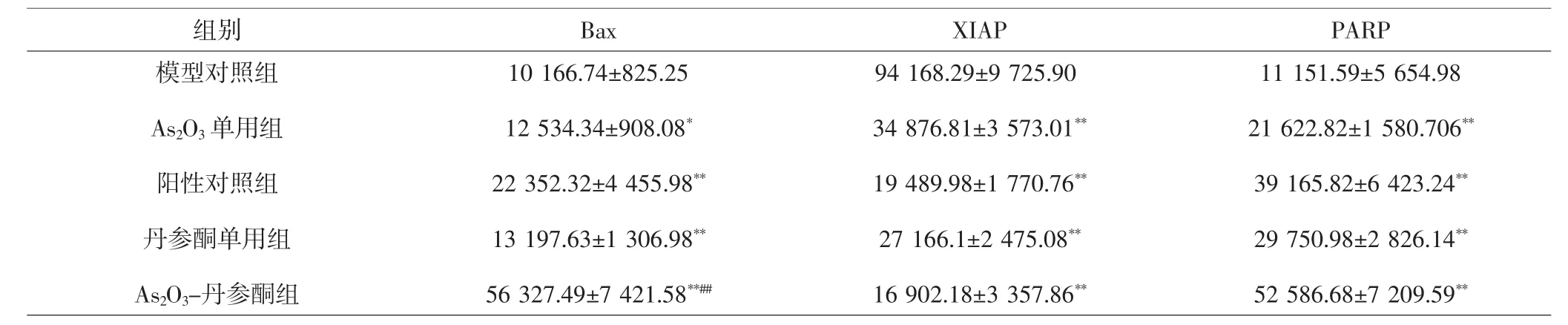
表4 各组荷瘤裸鼠凋亡相关蛋白平均光密度比较(±s)Tab.4 Comparison of the average light density of apoptosis related proteins in each group(±s)
注:与模型对照组比较,*P<0.05,**P<0.01;与阳性对照组比较,##P<0.01Note:Compared with model control group,*P<0.05,**P<0.01;compared with positive control group,##P<0.01
组别 Bax XIAP PARP模型对照组As2O3单用组阳性对照组丹参酮单用组As2O3-丹参酮组10 166.74±825.25 12 534.34±908.08*22 352.32±4 455.98**13 197.63±1 306.98**56 327.49±7 421.58**##94 168.29±9 725.90 34 876.81±3 573.01**19 489.98±1 770.76**27 166.1±2 475.08**16 902.18±3 357.86**11 151.59±5 654.98 21 622.82±1 580.706**39 165.82±6 423.24**29 750.98±2 826.14**52 586.68±7 209.59**
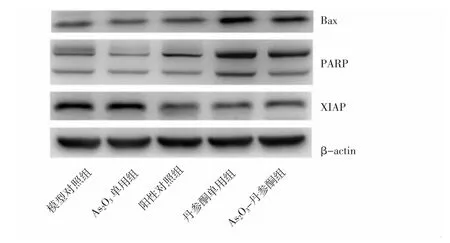
图5 Western blot检测各组肿瘤组织中Bax、PARP、XIAP的表达Fig.5 Expression of Bax,PARP,XIAP in tumor tissue detected by Western blot in each group
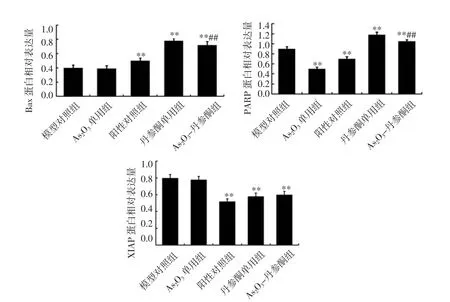
图6 各组肿瘤组织中Bax、PARP、XIAP表达比较Fig.6 Comparison of expression of Bax,PARP and XIAP in each group
3 讨论
中医药在肝癌治疗中有其独特的优势,临床实践证明,中医药治疗可延长肝癌患者的生存期,改善患者的生存质量,中药与放、化疗联合应用可发挥增效减毒的作用[7]。在临床上,顺铂和5-氟尿嘧啶等作为一线化疗药物被广泛用于肝癌、卵巢癌和非小细胞肺癌等恶性肿瘤的治疗,然而其发挥治疗作用的同时,也会损伤正常组织,最常见的不良反应为骨髓抑制、胃肠道反应,还有部分化疗药物可导致神经毒性、肝肾功能损伤等[8-9]。
As2O3是中药砒霜的主要有效成分,在2004年已被批准用于中晚期肝癌的治疗,但是其治疗剂量要求较高,不良反应亦明显增加[10]。丹参味苦,性微寒,归心、肝经,具有活血化瘀、通经止痛、清心除烦、凉血消痈等功效,作为活血化瘀中药常用于肿瘤转移的临床治疗[11-12]。丹参酮为丹参的乙醇提取物,包括隐丹参酮、异隐丹参酮等成分,具有抗菌消炎等功效。研究发现,隐丹参酮联合肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、顺铂、依托泊苷等能够增强抗癌效果[13]。本研究构建了裸鼠肝癌移植瘤模型,将高剂量的As2O3设置为阳性对照组,考察As2O3联合丹参酮抗裸鼠移植瘤的效果,以期能够降低As2O3的使用剂量并提高其临床疗效。结果发现随着给药时间的延长,As2O3单用组、丹参酮单用组、As2O3-丹参酮组以及阳性对照组均具有抑瘤作用,且与两个单药组比较,As2O3-丹参酮组的抑瘤效果更显著,证实As2O3-丹参酮联用较As2O3或丹参酮单用具有更好的抗肝癌效果。
As2O3的毒性作用主要由环境中慢性暴露或临床应用引起,可累及全身各个脏器,主要表现为心脏毒性、肝肾损伤、高白细胞血症、分化综合征等[14]。本研究初步检测了As2O3-丹参酮对血常规相关指标的影响,发现As2O3能够上调 WBC、PLT计数,下调RBC计数和HGB水平,但量效关系尚不确切,证实As2O3对血液系统具有一定的损伤作用,而丹参酮单用对相关的血常规指标没有明显影响,丹参酮联合As2O3则可以一定程度缓解As2O3对血液系统的损伤,表现出了一定的保护作用。
ALT、AST是反映肝脏功能的血清酶学相关指标。目前研究显示,ALT主要存在于细胞质内,当肝损伤较轻仅使细胞膜的通透性增加时,就会导致ALT大量释放入血中,此时以ALT升高为主,因此ALT是肝脏损伤的最敏感指标[15];而AST同时存在于肝细胞细胞质和线粒体中,并以线粒体中为主,当肝损伤较重,伤及线粒体时则血清中AST水平明显升高[16]。本研究表明,As2O3能够上调ALT的水平,下调AST的水平,但与模型对照组比较,差异无统计学意义,提示As2O3对荷瘤裸鼠肝功能造成了一定的影响,但程度并不严重。与As2O3单独使用比较,丹参酮联合As2O3能够一定程度上减轻肝损伤。
血清中BUN和CREA的水平反映了肾小球的滤过功能,是肾脏生理功能的重要反映指标。若血清中BUN和CREA水平增高,则表明肾功能可能受损[17]。本研究中,与模型对照组比较,各治疗组的BUN、CREA水平均偏低,其中丹参酮-As2O3组BUN、CREA水平略低于模型对照组,提示丹参酮联合As2O3并未对肾脏造成明显的不良反应。遗憾的是,在本研究设计时并未设置空白对照组,因此缺少模型对照组及各治疗组与正常小鼠比较的相关数据,有待于在以后的研究中进一步完善实验设计,使研究结果更加充实。
目前研究发现,As2O3抗肝癌的主要机制有诱导肝癌细胞凋亡、抑制肝癌细胞增殖和侵袭、抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)的生成等[18]。细胞凋亡为细胞的程序性死亡方式,TUNEL法是广泛应用于石蜡组织切片细胞凋亡的检测方法之一[19]。本研究采用TUNEL法检测各组肿瘤组织的凋亡情况,结果提示As2O3或丹参酮均能够诱导肝癌细胞凋亡,且As2O3-丹参酮组凋亡率显著高于As2O3或丹参酮单用组。
细胞凋亡的发生发展受多种基因调控,其中Bcl-2基因家族在细胞凋亡调节过程中起着重要作用,Bax则是细胞凋亡的促进基因,当Bax表达水平较高时,形成Bax-Bax同源二聚体,转位到线粒体膜,改变线粒体膜的通透性,促使细胞色素C释放入细胞质,启动含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)级联反应,从而导致细胞凋亡[20]。caspase-3最主要的底物是PARP,该酶与DNA修复、基因完整性保护有关[21]。XIAP作为凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族中作用最强的蛋白,通过干扰caspase的活性,从而抑制细胞凋亡[22]。免疫组化和Western blot检测凋亡相关蛋白Bax、PARP、XIAP的表达均发现,As2O3-丹参酮联用能够下调抗凋亡蛋白XIAP的表达,上调促凋亡蛋白Bax、PARP的表达。这些结果初步表明,As2O3-丹参酮联用能通过调控凋亡相关蛋白诱导肝癌细胞凋亡,进而发挥抗癌作用。然而,细胞凋亡的调控机制错综复杂,影响凋亡的信号通路亦有很多,As2O3-丹参酮联用诱导肝癌细胞凋亡的具体靶点值得进一步探索。
总之,本研究首次在裸鼠体内证明了As2O3-丹参酮联用具有协同增效、减毒的抗肝癌效果,诱导肝癌细胞凋亡并减低对血常规和肝肾功能的影响是其作用机制之一。本研究的结果为建立As2O3-丹参酮联用治疗肝癌的临床方案提供了实验依据。

