血清IGF-1和IGFBP-3水平检测在评价基因重组人生长激素治疗特发性身材矮小儿童的疗效分析
王俊慧,宋 爽,王德平
(1.辽宁省健康产业集团铁煤总医院a.内分泌科;b.神经内二科,辽宁铁岭 112700;3.黑龙江省牡丹江医学院附属红旗医院内分泌科,黑龙江牡丹江 157100)
特发性身材矮小(idiopathic short stature,ISS)是指身高低于同龄、同性别及同种族人群平均值2个标准差以上,且排除全身性、内分泌和营养性疾病或者染色体异常的一种生长障碍,患者出生体重和生长激素均为正常水平[1]。ISS在身材矮小儿童占比较高,约为60%~80%。基因重组人生长激素是美国FDA批准的ISS特效治疗药物,在未青春发育ISS患儿中取得较好的治疗效果[2-3],但在青春发育后期ISS患儿中是否有效仍少见报道。有研究表明,ISS患儿最主要受到GH-IGF-1轴调控影响,其中胰岛素样生长因子-1(IGF-1)和胰岛素样生长因子结合蛋白-3(IGFBP-3)是最为重要的监测指标[4]。但关于重组人生长激素对未青春发育及青春发育后期患儿疗效和IGF-1和IGFBP-3水平的影响迄今少有报道。本研究回顾性分析了40例未青春发育及青春发育后期ISS患儿的临床资料,探讨重组人生长激素对患儿血清IGF-1和IGFBP-3水平及临床疗效的影响,现将研究结果报道如下:
1 材料与方法
1.1 研究对象 回顾性分析2016年4月~2018年4月期间在我院接受治疗的40例未青春发育及青春发育后期ISS儿童的临床资料。25例接受为期6个月基因重组人生长激素治疗的儿童纳入观察组,余15例未接受任何药物治疗的儿童纳入对照组。观察组,男性15例,女性10例,年龄5~16岁,平均年龄10.56±4.36岁;未青春发育ISS患儿14例、青春发育后期ISS患儿11例。对照组,男性9例,女性6例,年龄5~16岁,平均年龄10.42±4.24岁;未青春发育ISS患儿8例、青春发育后期ISS患儿7例。两组患儿临床资料比较差异无统计学意义(P>0.05)。
纳入标准:①依据我国2005年儿童身高标准[5],身高低于同龄、同性别儿童平均身高≥2个标准差;②身材匀称;③甲状腺功能、心肝肾功能和血尿常规均正常;④无明显、严重的心理或者情感障碍,摄食正常;⑤GH激发试验显示峰值>10μg/L;⑥未青春发育标准:患儿未进入青春发育期,Tanner分期为Ⅰ期,男孩外生殖器G1期,女孩乳房B1期;青春发育后期标准:患儿已过青春生长加速期并进入生长减速期,Tanner分期为Ⅳ~Ⅴ期,男孩外生殖器G4~G5期,女孩乳房B4~B5期且已月经初潮。排除标准:宫内发育迟缓或患有各种遗传代谢疾病和营养不良者。
1.2 试剂与仪器 血清胰岛素样生长因子-1(IGF-1)和胰岛素样生长因子结合蛋白-3(IGFBP-3)酶联免疫法试剂盒均购自美国DSL公司;仪器为美国ThermoFisher公司MK-3型酶标仪。
1.3 方法
1.3.1 治疗:对照组患儿不采用任何药物治疗,仅建议其早睡、充分运动。给予观察组患儿基因重组人生长激素(长春金赛药业股份有限公司,国药准字S20173004,4.5 IU/1.5mg/0.9ml/支),0.15 IU/(kg·d)皮下注射,连续治疗6个月。
1.3.2 资料收集:分别于治疗前和治疗6个月后记录患儿体重、身高,计算生长速度(GV),采用Greulich-Pyle图谱法测定骨龄(BA)和预测成年身高(FAH)。统计观察组不良反应发生情况。
1.3.3 实验室检测:分别于治疗前和治疗6个月后采集患儿空腹静脉血2ml,3 000r/min离心10min后留取血清,待测样本保存在-70℃超低温冰箱内,检测血清胰岛素样生长因子-1(IGF-1)和胰岛素样生长因子结合蛋白-3(IGFBP-3)水平,所有操作均严格按照试剂盒说明书和仪器操作指南进行。
1.4 统计学分析 采用SPSS 17.0统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,同组治疗前后比较采用配对t检验;计数资料表示为n(%),组间比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿治疗前后生长相关参数比较 见表1。两组患儿治疗前BA、GV和FAH等指标比较,差异均无统计学意义(P>0.05);经过治疗,观察组GV和FAH均较治疗前显著增加(P<0.05),但对照组治疗前后BA,GV和FAH比较,差异无统计学意义(均P>0.05)。观察组患儿治疗后GV和FAH均显著大于治疗前(P<0.05),但两组患儿治疗后BA与对照组比较差异无统计学意义(P>0.05)。
表1 两组患儿治疗前后生长相关参数比较(±s)
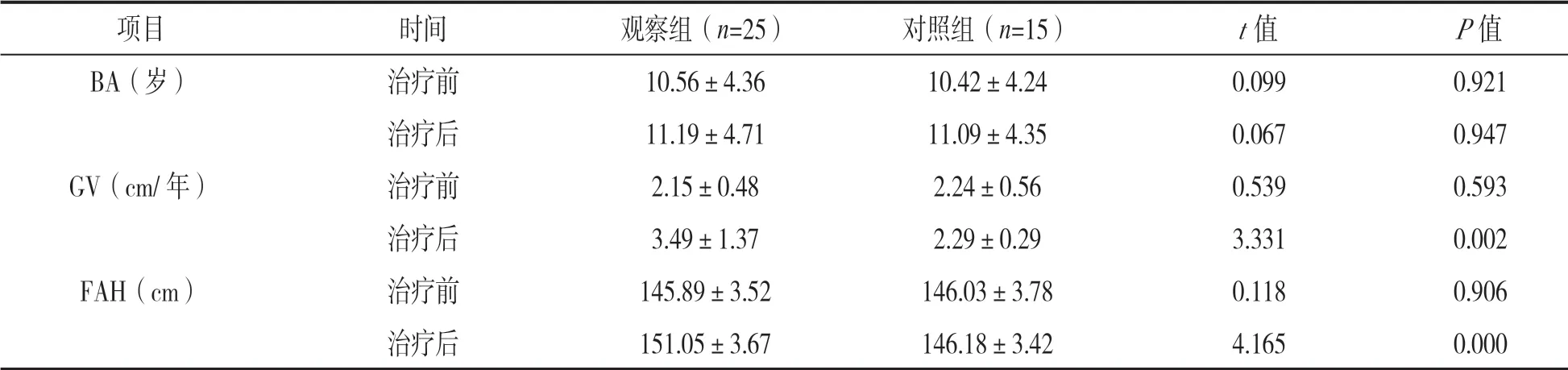
表1 两组患儿治疗前后生长相关参数比较(±s)
项目 时间 观察组(n=25) 对照组(n=15) t值 P值BA(岁) 治疗前 10.56±4.36 10.42±4.24 0.099 0.921治疗后 11.19±4.71 11.09±4.35 0.067 0.947 GV(cm/年) 治疗前 2.15±0.48 2.24±0.56 0.539 0.593治疗后 3.49±1.37 2.29±0.29 3.331 0.002 FAH(cm) 治疗前 145.89±3.52 146.03±3.78 0.118 0.906治疗后 151.05±3.67 146.18±3.42 4.165 0.000
2.2 两组患儿治疗前后血清IGF-1和IGFBP-3水平变化比较 见表2。两组患儿治疗前血清IGF-1和IGFBP-3水平比较,差异均无统计学意义(P>0.05)。经过治疗,观察组血清IGF-1和IGFBP-3水平显著升高,差异有统计学意义(均P<0.05),但对照组血清IGF-1和IGFBP-3水平变化差异无统计学意义(均P>0.05)。观察组患儿治疗后血清IGF-1和IGFBP-3水平显著高于对照组,差异有统计学意义(P<0.05)。
表2 两组患儿治疗前后血清IGF-1和IGFBP-3水平变化比较(±s)

表2 两组患儿治疗前后血清IGF-1和IGFBP-3水平变化比较(±s)
项 目 时间 观察组(n=25) 对照组(n=15) t值 P值IGF-1(ng/ml) 治疗前 204.26±45.47 209.25±49.32 0.325 0.746治疗后 395.49±103.58 215.78±72.14 5.902 0.000 IGFBP-3(ng/ml) 治疗前 3 125.68±1 125.63 3 131.81±1 098.71 0.017 0.987治疗后 5 012.71±1 126.72 3 109.25±1 047.36 5.307 0.000
2.3 不良反应发生情况 观察组1例发生月经周期延长1次;1例膝关节痛,补充钙制剂后好转。对照组患儿未见不良反应。
3 讨论
ISS是目前发生率较高的生长障碍疾病,由于身材矮小,ISS患者受到来自于社会各方面的歧视、疏远,导致其缺乏自信,多数患者有程度不一的心理疾病。ISS发病原因目前尚未完全清楚,有学者认为其可能是由多种潜在因素共同导致的结果,包括[6]:(1)生长激素分泌紊乱或者分泌过少;(2)生长激素活性不足或者存在生长激素抵抗;(3)生长激素受体水平降低或者因结构改变造成对生长激素敏感性降低;(4)生长激素结合蛋白(GHBP)水平升高造成生长激素无法与其受体结合,降低了生长激素的生物学作用;(5)基因突变,如IGF-1,GH1等基因突变。
基因重组人生长激素是目前治疗ISS效果最为理想的药物,多数研究结果表明对于未青春发育ISS患者效果较佳[7],但该药在青春发育后期ISS患儿中的应用效果报道较少。本研究结果发现,经过治疗观察组GV和FAH较治疗前显著增加(P<0.05),且显著大于对照组(P<0.05),但两组患儿治疗后BA比较差异无统计学意义(P>0.05)。与李想等[8]研究结果一致,提示基因重组人生长激素对于未青春发育期和青春发育后期ISS患儿具有良好的效果,这与基因重组人生长激素能够促进生长期骨骺软骨形成进而使躯体长高以及促进机体蛋白质合成和营养物质的吸收和利用有关。
生长迟缓患儿最重要的表现在于骨骼生长发育障碍,而骨骼生长受到甲状腺轴、性腺轴和GHIGF-1轴的调控,其中ISS患儿最主要受到GH-IGF-1轴调控影响。IGF-1是人体最重要的生长促进因子,GH发挥促生长作用要通过IGF-1介导,方能作用于软骨细胞,促进有丝分裂,使长骨不断生长;另一方面IGF-1能够对GH分泌起到反馈调节作用[9]。英国曾报道一例IGF-1基因外显子4和5缺失男童出生后生长受限。PENG[10]研究结果发现IGFBP-3是IGF-1的贮存和血液循环载运蛋白,能够调节体内IGF总体水平,进而调节IGF的作用。张宇等[11]分析了未青春发育ISS患儿经重组人生长激素治疗前后IGF-1和IGFBP-3水平变化,结果表明治疗后患儿IGF-1和IGFBP-3水平显著升高,和本研究结果一致,且治疗后IGF-1水平和治疗前后GV,按年龄的身高标准差积分(HtSDSCA)、按骨龄的身高标准差积分(HtSDSBA)的变化值呈正相关,提示IGF-1可作为评价ISS患者治疗效果的指标。
综上,基因重组人生长激素治疗未青春发育和青春发育后期ISS儿童疗效确切,安全性高,可通过血清IGF-1及IGFBP-3水平监测来评估治疗效果。

