粘液性铜绿假单胞菌的药敏现状及同源性分析
朱峰
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是医院感染中一种重要的革兰阴性非发酵病原菌,其中粘液性PA 因其形态、培养及生物被膜形成等方面的特点[1],在临床致病和感染治疗上具有独特性。但因为目前临床相对较低的检出,导致无论是实验室还是临床对粘液性PA 的重视程度不够,其体外药敏检测和临床治疗缺乏规范。为了解该菌对常用抗菌药物的敏感性情况以及在本院的临床分布,为该菌的临床防治提供依据,作者对本院2018 年临床检出的粘液性PA 的分离情况及药敏数据进行相关分析,并采用肠杆菌基因间重复共有序列PCR(ERIC-PCR)进行菌株同源性分析,现报道如下。
1 资料与方法
1.1 菌株来源 研究菌株分离自2018 年1 月至12 月期间本院住院患者细菌学检验标本,PA 达324 株,其中粘液性PA 31 株(非重复分离)。标本类型包括:痰液、支气管灌洗液、血液、清洁中段尿、伤口分泌物、腹腔引流液等。本次实验药敏检测质控菌株为大肠埃希菌ATCC25922 和铜绿假单胞菌ATCC27853。
1.2 主要仪器与试剂 实验菌株的鉴定采用BD 公司生产 Phoenix-100 型全自动细菌鉴定仪。非粘液性PA的药敏检测采用BD Phoenix 100 及配套药敏卡;粘液性PA 的药敏检测全部采用纸片琼脂扩散法(K-B),药敏纸片由英国OXOID 公司生产,分离培养基哥伦比亚血琼脂平板和药敏检测培养基MH 琼脂平板购自郑州安图公司。菌株同源性分析采用美国Bio-RAD 公司生产的全自动荧光定量PCR 仪反应体系进行,实验中使用的Taq 酶及配套试剂由日本TaKaRa 公司生产,同源性检测扩增引物ERIC2 均由上海生工生物有限公司合成。
1.3 细菌分离与鉴定 所有实验菌株的临床分离纯化均依据《全国临床检验技术操作规程》(第三版)操作。菌种的鉴定按照Phoenix-100 型全自动微生物分析仪标准操作指南,先挑取待鉴定实验菌株单个菌落,使用含4.5%NaCl 的无菌水调制菌液至0.5 麦氏浊度,使用BD 配套的细菌鉴定卡片进行菌种鉴定。粘液型PA在哥伦比亚血平板上,37℃环境下,培养18~24h,菌落呈现为水滴样、无色透明、不溶血的小菌落,易漏检。48h 后逐渐形成溶血性不明显、胶冻样、粘稠的菌落,接种环常不易挑起,油镜下为革兰氏阴性杆菌,有类荚膜样物质包裹菌体,氧化酶有时可为阴性,非粘液性PA 无此现象。粘液型PA 的鉴定和药敏时间以培养48~72h 为准[2]。药敏结果判断依据CLSI 2018 标准。
1.4 同源性检测方法 采用煮沸法进行PCR 模板制备,将ERIC-PCR 反应溶液(去离子水9μl、RTaq DNA 聚合酶反应体系12.5μl、引物ERIC2 1.5μl 和模板2μl)25μl,放置于PCR 仪中,扩增条件为94℃预变性4min,随后94℃下变性40s、再40℃退火1min、接着72℃延伸5min,需运行40 个循环,最后在72℃下延伸10min 结束。ERIC-PCR 产物进行电泳成像后,根据与Marker 的对应位置,具有相同图谱的视为相同基因型,具有不同图谱的视为不同。
1.5 统计学方法 菌株数据的整理和处理采用WHONET5.6 分析软件,运用SPSS17.0 软件进行抗菌药物敏感性的统计分析,敏感率的比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 粘液性PA 分离情况 2018 年度本院从临床非重复分离菌株共3326 株,其中PA 为324 株(9.74%),粘液性PA 为31 株,占比为9.57%。
2.2 粘液性PA 临床分布 31 株临床分离的粘液性PA 来源主要集中于下呼吸道标本,其中痰液29 例、支气管灌洗液1 例、尿液1 例。主要来源于呼吸内科(67.7%)、ICU(9.7%)、急诊内科(6.5%)、消化内科(6.5%)、门诊(6.5%)和感染科(3.1%)。
2.3 粘液性PA 和非粘液性PA 敏感性差异比较 见表1。
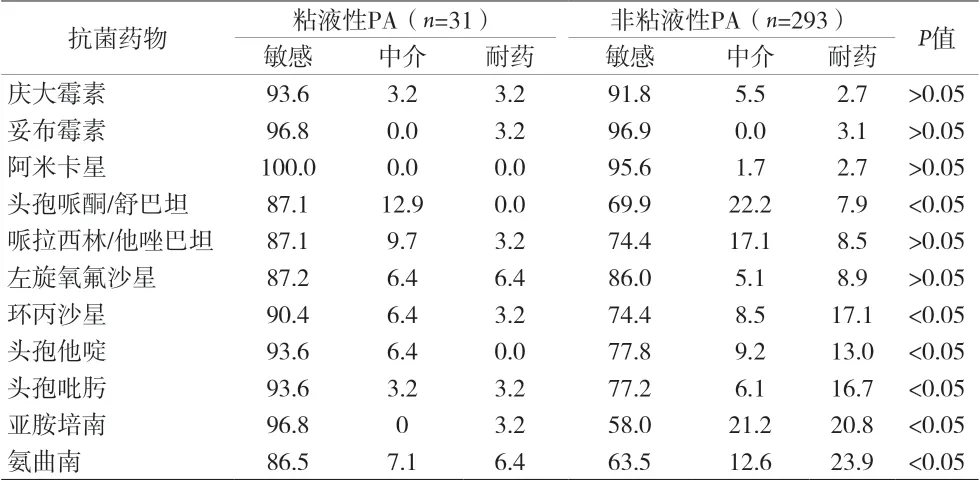
表1 粘液性PA和非粘液性PA敏感性差异比较(%)
2.4 粘液性PA 同源性分析 31 株粘液性PA 经ERIC-PCR 基因分型,主要分为A、B、C、D 4 型,其中A 型20 株,B 型5 株,C 和D 型各3 株。部分菌株ERIC-PCR 分型图谱如图1 所示。
3 讨论
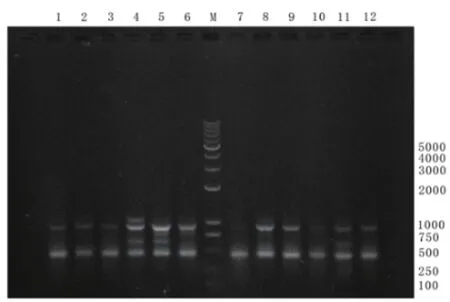
图1 部分实验菌株ERIC-PCR分型图谱。注:M为DNA Marker;泳道1、2、3、6、7、8、9、10、12菌株为A型;泳道5、11菌株为B型;泳道4菌株为C型。
本资料结果显示,2018 年本地区粘液性PA 检出31 例,占比为9.57%。非粘液型PA 通常不产生粘液和生物膜,但在缺少磷酸盐、氯化钠含量较多、高渗透压等环境下非粘液型PA 易转化为粘液型。因此,对于粘液性PA 的形成条件和检出率的动态关注,也尤为重要。统计结果表明,31 例粘液型PA 主要来自痰液等呼吸道标本,其科室来源于呼吸科和重症监护等呼吸道疾病集中病区。这也进一步证实了本菌与呼吸道疾病间的相关性。也有较多报道[3-4]显示,粘液型PA 在慢性支气管炎、慢性阻塞性肺炎患者标本中检出率高。这可能与粘液型PA引起的感染清除较困难,容易反复有关。由于产粘液型PA 的粘液减少和阻断了细菌的外界营养供应,使该菌生长明显减慢,一般需要48h 才能生长,并且在生理盐水中不容易形成均匀的菌悬液,导致在使用自动化仪器鉴定和药敏试验时,无法鉴定或者结果不准确。因此对于产粘液型PA的鉴定应该在仪器鉴定的基础上,再结合菌落形态和附加生化反应加以确认。其药敏检测应当选择>48h生长菌落,采用标准纸片扩散法进行[2]。但目前国内较多微生物实验室由于人员配备少、工作量繁重以及认识不够等因素,对于粘液型PA 的检测和报告缺乏规范性,甚至和非粘液性PA 根本不做区分,从而给临床治疗带来诸多困难。
由于粘液性PA 不易形成均匀菌悬液的特点,导致在使用仪器药敏检测时,药敏卡片上各抗菌药物检测孔中菌液浓度分布不均,引起药敏检测结果出现偏差,而纸片法使用较为直观的琼脂扩散方法,避免了菌液浓度不均引起的误差。本资料结果表明31 株粘液性PA 对目前临床常用抗假单胞菌药物如亚胺培南、头孢他啶、头孢吡肟、头孢哌酮/舒巴坦和环丙沙星的敏感性明显高于同时期临床分离的非粘液性PA。虽然粘液性PA 对临床常用抗假单胞菌药物具有较好敏感性,但目前在治疗粘液型PA 引起的感染时,临床治疗效果不佳,这主要可能是因为粘液性PA 表面的脂蛋白、纤维蛋白、藻酸盐等多糖蛋白复合物,包裹在细菌周围粘连成膜状物,即生物被膜,这种生物膜处于类凝胶状态,目前较为统一的认识为大环内酯类抗菌药物可以抑制和破坏生物被膜,作为联合用药使用时具有较好疗效[5]。
粘液性PA 因其易定植的生物学特性,常能够引起医院内感染的发生,尤其容易在如呼吸科、老年康复、ICU 等病区发生克隆传播,因此对其实施及时的监控相当必要。作者运用ERIC-PCR 方法对本院粘液性PA进行了同源性分析,发现31 株粘液性PA 的基因型主要为A 型,具有较高的同源性,说明可能存在院内的克隆传播。其原因可能与临床的隔离消毒、无菌操作、侵入性诊疗等密切相关。因此采用确实有效的措施对于预防和控制此类病原菌的院内传播与感染至关重要。

