NLRP3炎症小体及其下游分子在缺氧缺血新生大鼠海马中的表达及作用
胡兴 苟知贤 王幽梦 黄林 周月 鲁利群
成都医学院第一附属医院儿科(成都610500)
缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是指围生期窒息导致的脑组织缺氧缺血(hypoxic-ischemic,HI)性损害[1-2]。研究[3]显示,HI后神经炎症是新生儿脑损伤演变的关键因素。NLRP3炎症小体在中枢神经系统炎症反应的发生发展中起关键作用[4],其过度活化介导下游信号通路的激活参与了多种神经系统疾病[5]。目前,NLRP3炎症小体信号通路在HIBD中的表达情况及作用相关报道较少。本实验通过建立HIBD新生大鼠模型,检测NLRP3炎症小体信号通路相关分子在HIBD新生大鼠海马中的表达情况,以阐明引起HIBD新生大鼠神经细胞死亡的可能机制,为新生儿HIBD疾病的防治提供实验依据。
1 材料与方法
1.1 实验动物健康SPF级7日龄新生SD大鼠(动物合格证号:SCXK(川)2015-030成都达硕实验动物公司),体质量(15±2)g,雌雄不限。
1.2 方法
1.2.1 HIBD新生大鼠动物模型制备将50只7日龄新生SD大鼠随机分成为假手术(Sham)组(n=20),模型(HIBD)组(n=30),Sham组将颈部正中皮肤切开分离出左颈总动脉不结扎,后缝合皮肤,不进行缺氧处理。HIBD组参照文献[5-7]采用改良Rice法进行HIBD模型制备,让50只新生大鼠休息0.5 h后放入氧浓度为8%的透明缺氧舱内,予以2.5 h缺氧处理。缺氧结束后大鼠若出现自发夹尾左旋表明造模成功,将造模成功的新生SD大鼠纳入下述实验中。
1.2.2 WesternBlot 将7日龄新生SD大鼠干预至相应的时间节点,按照RIPA组织裂解液(Solarbio,中国北京)说明书提取总蛋白,使用增强型BCA蛋白质测定试剂盒(Solarbio,中国北京)进行蛋白浓度测量后按照Western Blot的步骤进行电泳、转膜、5%脱脂牛奶封闭2 h,一抗 NLRP3(1∶1 000),ASC(1∶500),Pro-Caspase-1(1∶500),Caspase-1(1∶100),GSDMD(1∶500),IL-1β(1∶500),IL-18(1∶300)、Gapdh(1∶2 000),4 ℃冷库孵育过夜,洗膜后二抗室温孵育2 h,洗膜后ECL显影。
1.2.3 实时荧光定量PCR(Real-timeqPCR,RT-qPCR) 引物由上海生工生物公司式设计、合成和生产。用RNA试剂盒(Solarbio,中国北京)参照说明书提取术后72 h Sham组和HIBD组新生大鼠左侧海马组织中RNA,取2 μg的总RNA用逆转录试剂盒逆转录为cDNA,操作按照试剂盒说明书进行,以1 μL cDNA链为模板进行PCR反应,上下游引物各0.15 μL,反应总体积为20 μL,PCR反应体系:95℃,10 min后,95℃变性15 s,60℃退火30 s,72℃延伸10 min,共40个循环。引物序列如下:Gapdh:上游5′-ATGACATCAAGAAGGTGGTG-3,下游 5′-CATACCAGGAAATGAGCTTG-3′;NLRP3:上游 5′-ACCAATGCGAGATCCTGACAACAC-3′,下游 5′-GAGCTGGACCTCAGTGACAATGC-3′;ASC:上游 5′-GGACCAACACAGGCAAGCACTC-3,下游5′-ACAAGTTCTTGCAGGTCAGGTTCC-3′;Caspase-1:上游 5′-ATGGCCGACAAGGTCCTGAGG-3′,下游5′-GACATGATCGCACAGGTCTCGT-3;GSDMD:上游5′-GTCTGCTTGCCGTACTCCATTCC-3′,下游 5′-TGAAGAGCCTGCCTCCACCTC-3′;IL-1β:上游 5′-AATCTGTACCTGTCCTGCGTGTTG-3′,下游 5′-GAGAGGTGCTGATGTACCAGTTGG-3′;IL-18:上游 5′-ATGGCTGCCATGTCAGAAGAAGG-3′,下 游 5′-TGCTCCGTATTACTGCGGTTGTAC-3′。
1.2.4 HE染色、尼式染色及免疫组织化学染色检测术后72 h将Sham组和HIBD组新生大鼠断头取脑组织、固定、脱水、石蜡包埋、脑组织石蜡块沿冠状面进行4 μm切片,HE染色观察海马DG区病理形态学变化;尼氏染色(1%硫堇溶液)观察海马DG区神经元数目;免疫组织化学染色检测海马DG区NLRP3、ASC、Caspase-1蛋白表达情况,光镜下观察新生大鼠左侧海马DG区神经元细胞核染色情况,显微成像系统图像扫描,采用Image-Pro Plus软件测定阳性细胞平均吸光度值(average optical density,AOD)值。
1.3 统计学方法采用GraphPad Prism 7.0软件进行统计学数据分析。计量资料采用均数±标准差表示,组间差异显著性采用单因素方差分析,组间两两比较用Student′st检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同时间节点左侧海马组织中NLRP3炎症小体及Caspase-1蛋白表达水平Western Blot法检测Sham组、HIBD组新生大鼠术后24、48、72 h左侧海马组织中NLRP3、ASC、Pro-Caspase-1、Caspase-1蛋白水平变化。Western Blot条带(图1A)及灰度值(图1B)显示,与Sham组相比,HIBD组新生大鼠术后24 h和48 h NLRP3表达水平升高,差异有统计学意义(P<0.05),术后72 h表达水平差异无统计学意义(P>0.05);术后24 h和48 h ASC表达水平差异无统计学意义(P>0.05),术后72 h表达水平升高,差异有统计学意义(P<0.05);术后24、48、72 h Pro-Caspase-1表达水平差异均无统计学意义(P>0.05);术后24 h及48 h Caspase-1表达水平差异无统计学意义(P>0.05),术后72 h表达水平升高,差异有统计学意义(P<0.05)。
2.2 左侧海马DG区HE染色、尼式染色结果及NLRP3、ASC、Caspase-1蛋白表达情况术后72 h,与Sham组相比,HE染色结果显示,HIBD组新生大鼠左侧海马DG区细胞层数明显减少,差异有统计学意义(P<0.05,图2)。细胞排列疏松、散乱,细胞轮廓及形态发生改变,核仁偏移、碎裂、不清晰,膜染色不均匀;尼氏染色结果显示,HIBD组新生大鼠左侧海马DG区神经元丢失较为严重,差异有统计学意义(P<0.05,图3);免疫组织化学染色检测结果(图4)显示,新生大鼠左侧海马DG区神经元中NLRP3、ASC、Caspase-1在细胞质表达,呈棕黄色;HIBD组新生大鼠左侧海马DG区神经NLRP3、ASC、Caspase-1蛋白表达增强(表1),差异有统计学意义(P<0.05)。
2.3 左侧海马组织中NLRP3炎症小体信号通路相关分子蛋白及mRNA表达水平术后72 h,与Sham组相比,Western Blot条带(图5A)及灰度值(图5B)、RT-q PCR检测结果(图6)显示,HIBD组新生大鼠左侧海马组织中NLRP3、ASC、Caspase-1、GSDMD、IL-1β、IL-18的蛋白及mRNA表达水平均升高,且差异具有统计学意义(P<0.05)。

图1 各组新生大鼠左侧海马组织NLRP3、ASC、Pro-Caspase-1、Caspase-1的蛋白表达条带(A)及灰度值(B)Fig.1 Protein expression bands(A)and gray value(B)of NLRP3,ASC,Pro-Caspase-1 and Caspase-1 in the left hippocampus of neonatal rats in each group
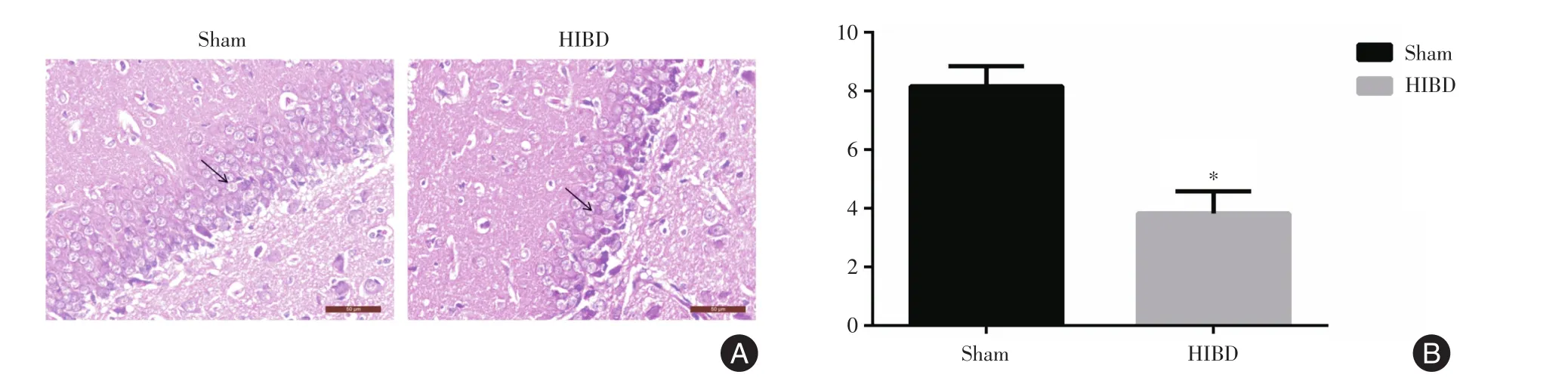
图2 新生大鼠脑组织HE染色结果Fig.2 HE staining results in neonatal rat brain tissue
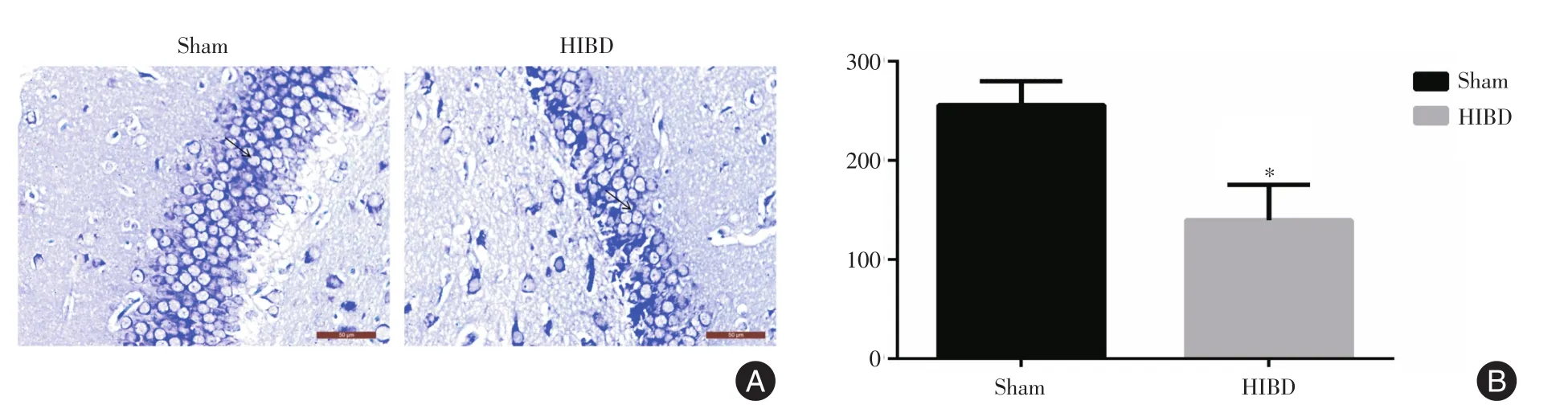
图3 新生大鼠脑组织尼氏染色结果Fig.3 Nissl staining results in brain tissue of newborn rats
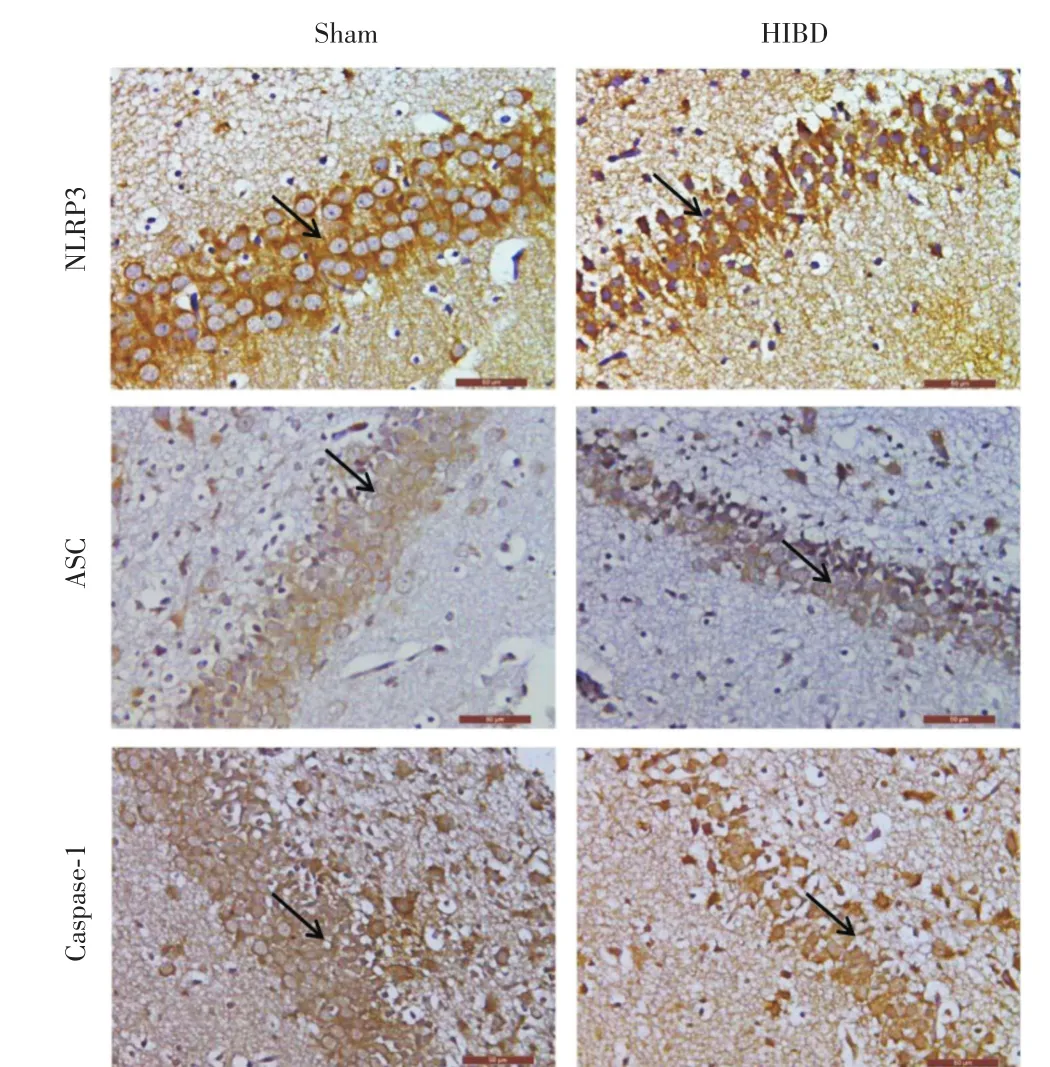
图4 新生大鼠脑组织免疫组织化学染色结果比较(×400)Fig.4 Comparison of immunohistochemical staining results in brain tissue of neonatal rats(× 400)
表1 不同组新生大鼠左侧海马DG区神经元NLRP3、ASC、Caspase-1的表达(AOD值)Tab.1 Expression of NLRP3,ASC and Caspase-1 in hippocampal DG neurons of different groups of neonatal rats(AOD value)±s
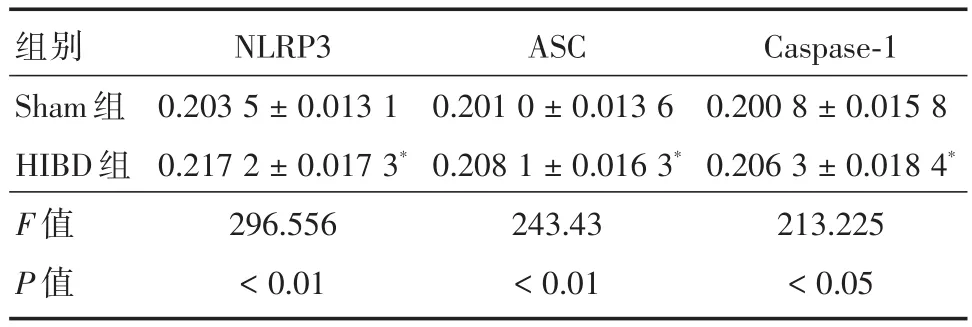
表1 不同组新生大鼠左侧海马DG区神经元NLRP3、ASC、Caspase-1的表达(AOD值)Tab.1 Expression of NLRP3,ASC and Caspase-1 in hippocampal DG neurons of different groups of neonatal rats(AOD value)±s
注:与Sham组相比,*P<0.05
组别Sham组HIBD组F值P值NLRP3 0.203 5±0.013 1 0.217 2±0.017 3*296.556<0.01 ASC 0.201 0±0.013 6 0.208 1±0.016 3*243.43<0.01 Caspase-1 0.200 8±0.015 8 0.206 3±0.018 4*213.225<0.05
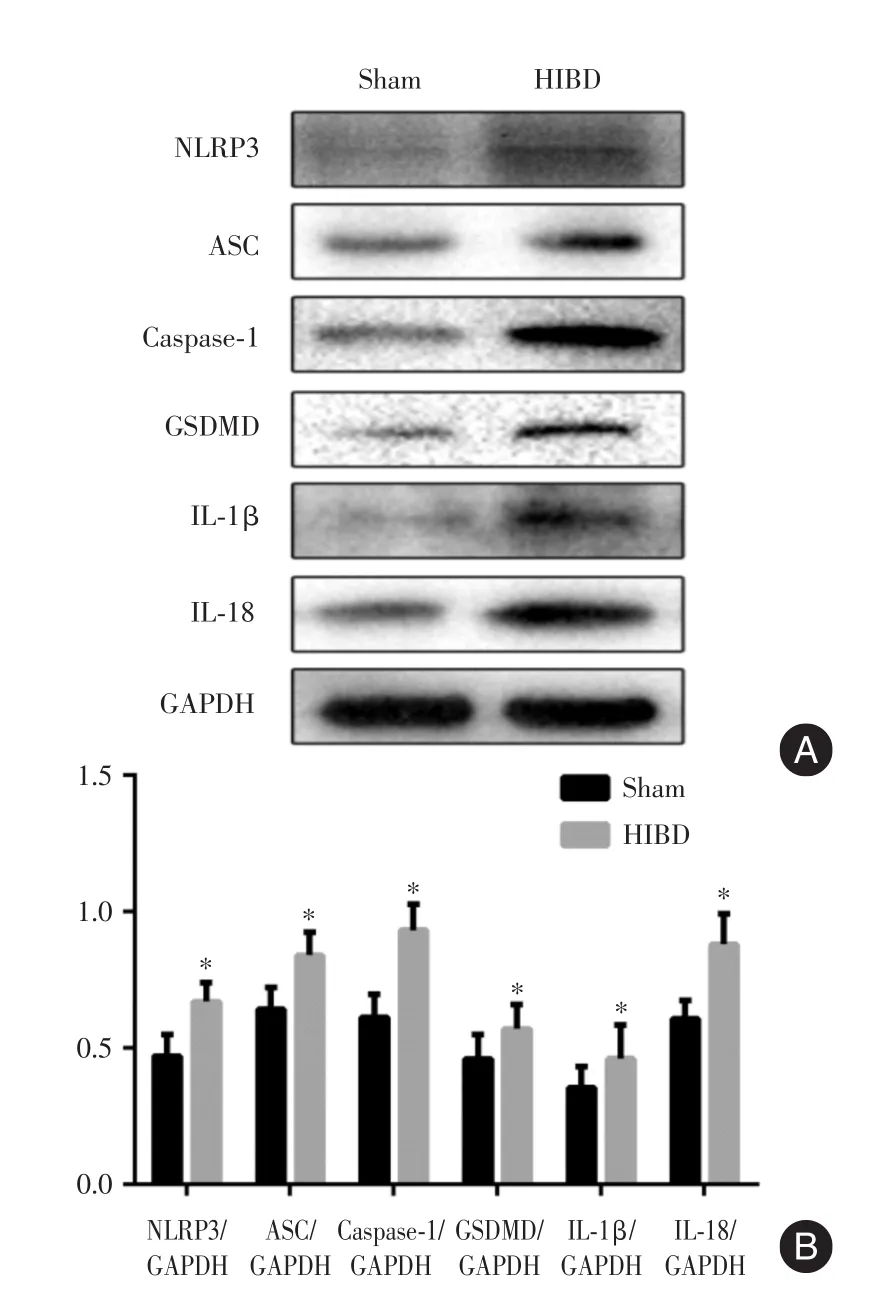
图5 各组新生大鼠左侧海马组织NLRP3炎症小体信号通路相关分子的蛋白表达条带及灰度值Fig.5 Protein expression bands and gray value of NLRP3 inflammatory corpuscle signaling pathway in the left hippocampus of neonatal rats in each group
3 讨论
新生儿HIBD全球发病率约为2‰~4‰,在罹患HIBD的新生儿中约有25%~30%出现永久性神经发育障碍或认知缺陷,15%~20%左右的患儿死亡[8]。亚低温治疗是目前唯一公认有效的治疗方式,但即使接受亚低温治疗的HIBD新生儿仍会出现较多的后遗症。HIBD通常以神经细胞死亡为特征[9],炎症反应是造成HIBD后神经细胞死亡的主要原因之一[10]。细胞焦亡作为一种新型的伴有炎症反应的程序性细胞死亡方式,在HIBD中的作用尚不十分清楚。海马在人类学习、记忆等高级神经活动中起到了重要的作用,同时海马也是缺氧缺血损伤中最敏感的部位之一[11-12]。海马各区在信息的处理过程中都扮演着重要角色,信息进入海马时由DG区流入其他各区。因此,积极寻找引起海马DG区神经细胞死亡的原因,对新生儿HIBD的防治至关重要。

图6 RT-qPCR检测新生大左侧海马组织NLRP3炎症小体信号通路相关分子mRNA水平Fig.6 RT-qPCR detection of NLRP3 inflammatory signaling pathway-related molecular mRNA levels in newborn large left hippocampus(n=8)
NLRP3炎症小体由NLRP3、凋亡相关斑点样蛋白(ASC)和pro-Caspase-1组成,其激活后导致pro-Caspase-1的募集和活化,形成活性的Caspase-1[13-14]。HIBD新生小鼠模型中发现,HI后24 h NLRP3炎症小体在海马中的表达上调2.6倍[15]。同时,NLRP3炎症小体激活可介导包括新生儿HIBD在内的多种中枢神经系统疾病引起的神经损伤[16]。本实验研究发现,HIBD新生大鼠左侧海马组织中NLRP3、ASC、活性Caspase-1蛋白的表达高峰时间分别在术后24、72 h,NLRP3的表达高峰时间先于活化Caspase-1的表达高峰时间,由此推测,本实验过程中HI作为刺激因素,可能引发NLRP3炎症小体的激活,进而介导Caspase-1的活化。本实验研究显示,术后72 h,与Sham组相比,HIBD组新生大鼠左侧海马DG区细胞层数相对减少、细胞排列相对紊乱,神经元数目丢失增多,NLRP3、ASC、活性Caspase-1蛋白表达增强。上述实验结果进一步证实,新生大鼠HI后可能引起NLRP3炎症小体的激活,进而介导Caspase-1的活化,最终可能引起神经细胞死亡。
细胞焦亡是一种新的促炎程序性细胞死亡方式,其经典途径是依赖Caspase-1的活化。当机体受到外来刺激时,NLRP3与ASC结合并募集pro-Caspase-1组装形成NLRP3炎症小体,NLRP3炎症小体调控Caspase-1的激活,活性Caspase-1能将胞内无活性的IL-18和IL-1β前体剪切为成熟的IL-18和IL-1β,放大炎症反应,如同发生级联效应,最终引起细胞焦亡[17-18]。活性Caspase-1还可以激活GSDMD使成熟的IL-1β和IL-18分泌到胞外发挥相应的作用[19]。目前,活化的Caspase-1切割GSDMD底物被认为是细胞焦亡的关键执行环节[20]。本实验研究显示,术后72 h,与Sham组相比,HIBD组新生大鼠左侧海马组织中NLRP3、Caspase-1、ASC、GSDMD、IL-1β、IL-18蛋白及 mRNA表达水平均升高且差异具有统计学意义。上述实验结果表明,NLRP3炎症小体信号通路相关分子在HIBD新生大鼠左侧海马组织中表达上调,表明新生大鼠HI后可以激活NLRP3炎症小体信号通路,提示NLRP3炎症小体信号通路激活介导的细胞焦亡可能引起HIBD新生大鼠神经细胞死亡,并在新生大鼠HIBD发病机制中发挥重要作用。但目前NLRP3炎症小体是通过何种途径被激活,细胞焦亡在HIBD中的作用以及抑制细胞焦亡能否为新生儿HIBD的防治提供新思路,需进一步深入研究。

