反亚油酸诱导人脐静脉内皮细胞的转录组学及生物信息学分析
邱 斌 刘 玮 刘丽娜 宗爱珍 贾 敏 徐同成
(山东省农业科学院农产品研究所 山东省农产品精深加工技术重点实验室农业部新食品资源加工重点实验室 济南 250100)
食品中的反式脂肪酸主要是植物油在工业氢化加工过程中产生的,这类产品主要以氢化植物油为主,其反式脂肪酸含量在40%以上[1]。有研究报道,反式脂肪酸是动脉粥样硬化和冠心病的诱导因素[2-4]。研究发现,反式脂肪酸摄入与多个内皮损伤因子过量表达成正相关,如细胞间黏附因子-1,细胞内黏附因子-1,E选择素等[3-5]。另外,研究还发现反式脂肪酸与炎症因子(包括白介素-6和C-反应蛋白)的激活呈正相关[6]。反亚油酸(9t,12t-C18:2)在反式脂肪酸中含量高达 25%,它的摄入对于研究反式脂肪酸的危害有重要意义。与反油酸相比,反亚油酸在9和12位有两个反式双键,其生物活性比反油酸高,参与的生物进程也更复杂[7]。前期有研究报道,反亚油酸通过caspase、NF-κB等信号通路导致内皮细胞和肝癌细胞发生损伤和凋亡[8-9]。作者采用转录组学的手段研究反油酸(C18:1)对内皮细胞相关基因及其信号通路的影响[10]。鉴于当前国内外尚无关于反亚油酸诱导内皮细胞相关RNA、信号通路等变化的研究报道,本研究通过反亚油酸(9t,12t-C18:2)单体诱导内皮细胞,探寻其通过哪些靶基因及其相关信号转导通路作用于内皮细胞,为研究反式脂肪酸与人体动脉粥样硬化等心血管疾病提供理论依据。
1 材料与方法
1.1 材料与试剂
人脐带静脉内皮细胞HUVECs,山东大学药学院惠赠。
总RNA提取试剂盒,中国天根生化科技(北京)有限公司;TruseqTM RNA sample prep Kit试剂盒,美国Illumina公司;TBS380 Picogreen试剂盒,中国北京索莱宝科技有限公司;Certified Low Range Ultra Agarose,美国Bio-Rad公司;cBot Truseq PE Cluster Kit v3-cBot-HS试剂盒、Hiseq-Truseq SBS Kit(300cycles)试剂盒,美国Illumina公司;高糖DMEM培养基、胰蛋白酶、胎牛血清,美国赛默飞 Gibco公司;9t,12t-C18:2(反式-9,12-十八碳二烯酸),美国Sigma公司。
1.2 仪器与设备
Eppendorf AG CO2培养箱,美国Sheldon公司;2K15型冷冻离心机,美国Sigma公司;cBoT簇生成系统、Hiseq2500测序仪,美国Illumina公司。
1.3 试验方法
1.3.1 细胞培养及样品处理[8]将细胞以1×105/mL的数量接种于培养瓶中,待细胞贴壁生长至融合状态后。将细胞分为对照组和反亚油酸组(9t,12t-C18:2),反亚油酸组(9t,12t-C18:2)的最终浓度为200μmol/L,加入后继续培养24 h,最后消化收集细胞,并用总RNA提取试剂处理后冻存于-80℃冰箱留作转录组学检测,重复3次。
1.3.2 转录组测序 在进行建库时,将总RNA的起始量设定为5 μg;然后采用磁珠法分离mRNA,通过试剂盒将mRNA的离子打断;双链cDNA的合成在最后进行,同时完成的还有补平、3'端加A、连接index接头;待文库富集完成后,首先进行15个循环的PCR扩增;为满足定量测定的需要对利用2%琼脂糖胶进行回收目的条带;按一定的比例要求来对定量测定的TBS380进行混合上机;通过桥式PCR扩增对cBot进行操作,促进 clusters的生成;2×150 bp测序在 Illumina Hiseq测序平台完成。
1.3.3 RNA差异表达分析[10]在测序分析基因/转录的过程中,以所有样本与参考基因比对的结果作为分析依据,计算每个基因/转录本在样本中的FPKM值(百万外显子的碱基片段值),以FP KM值作为基因/转录本在样本中的表达量。为了能够做到可视化分析,使分析结果更易于理解,通过差异显著性分析,找出相对差异表达的基因/转录本。显著差异基因/转录本的标准阈值参照P值≤0.05&FC(倍数)≥2进行筛选,显著性差异表达结果以火山图进行展示。
1.3.4 生物信息学分析[11]使用OmicsBean(http://www.omicsbean.com:88/)软件进行生物信息学分析,其中包括基因本体GO(Gene ontology)富集分析、KEGG通路分析、PPI(Protein-protein interaction)互作分析。另外,GO富集分析还结合使用了数据库 David 6.7(http://david.abcc.ncifcrf.gov/)和QuickGO(http://www.ebi.ac.uk/QuickGO/)对筛选的差异表达基因进行GO分类注释和富集分析。KEGG通路分析结合使用了 KEGG(http://www.kegg.jp/kegg/pathway.html)数据库。
2 结果与分析
2.1 基因表达分析结果
作为特定的基因或转录本的代表,图1中,显著上调的基因用红色点表示,显著下调的基因用蓝色点表示,非显著差异基因用黑色点表示;在映射完所有基因和转录本之后,结果显示:表达差异下调的基因是位于左边的点,表达差异上调的基因是位于右方的点,表达差异的显著性会随着点靠左和靠上的变化愈发明显。结果显示:反亚油酸(9t,12t C18:2)诱导内皮细胞 24 h之后,与对照组相比,共发现有126条基因发生显著变化,其中基因表达上调的有28条,表达下调的有98条基因。
2.2 生物信息学汇总分析
生物信息学汇总分析包括GO富集和KEGG信号转导通路富集,结果总数以及显著(P-value<0.05)数目分别通过柱形图(图2)进行直观展示,其中蓝色柱条代表富集的总数目,橙色柱条代表富集差异显著的数目。
通过生物信息学分析,反亚油酸(9t,12t C18:2)作用于内皮细胞后,与对照组相比,其中生物进程共检测到2 201条,显著性差异表达基因共759条;关于细胞组成的基因共发现249条,其中显著表达性差异表达基因共54条;关于分子功能的基因共发现421条,其中显著表达性差异表达基因共118条;共富集到99条相关信号通路,其中具有显著性差异的信号通路7条。
2.3 GO分析
GO分析是基于基因本体联合会(Gene ontology consortium)所建立的一套生物信息学数据库,它通过建立一套具有动态形式的控制字集(Controlled vocabulary),以角色描述来帮助理解基因及蛋白质在细胞内所发挥的作用,从属性的角度进行分析,并对生物体中基因及其基因产物进行全面描述。共有3个本体存在于GO当中:(1)生物过程(Biological process,BP)——主要是用来描述分子功能的有序组合;(2)细胞定位(Cellular component,CC)——描述亚细胞结构、位置及其某些大分子复合物;(3)分子功能(Molecular function,MF)——详细的描述某基因及产物个体的相关功能。

图1 差异基因火山图Fig.1 Differential gene volcanic map
图3富集分析显示了生物过程、细胞定位和分子功能3种属性具有显著性差异的排名前20的功能条目。GO中3个本体都有层级之分。层级是对每个过程(组分、功能)进行层层划分,通常层级越大,划分越细,生物功能等信息会更明确。在生物过程分析中,主要以生物合成和代谢为主,其中包括胆固醇生物合成、胆固醇代谢、脂质代谢等,说明反亚油酸诱导内皮细胞后,反亚油酸显著改变了涉及胞内和胞外脂质合成及代谢等生物过程。细胞定位富集分析结果显示,其中参与细胞膜定位等相关生物进程共计11条,而参与细胞外区域定位和涉及胶原蛋白锚定的生物进程共5条,细胞内生物进程包括bcl3-10复合物和过氧化物酶等共4条。分子功能富集分析结果显示,其中参与蛋白、细胞外基质等绑定功能12条,包括C-4甲基固醇氧化酶、7-去氢胆固醇、角鲨烯合成活性等相关功能8条。
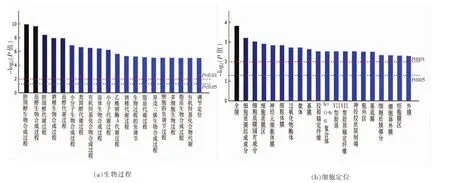
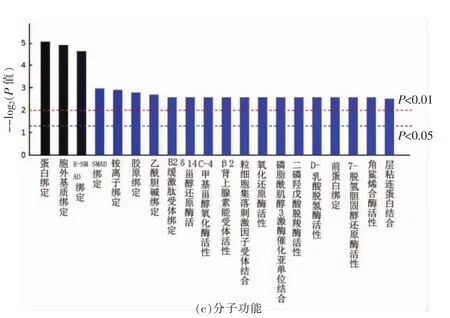
图3 GO注释分析图Fig.3 GO annotation analysis chart
2.4 KEGG通路分析
差异表达基因/转录本相关信息被映射到KEGG数据库后,可以富集到相关KEGG通路。
图4信号通路富集分析显示:反亚油酸诱导内皮细胞后,能清晰的发现细胞内类固醇生物合成通路(Steroid biosynthesis)激活,胆固醇从细胞内转运进入线粒体。结合GO分析中生物进程富集结果,类固醇生物合成和代谢相关进程都有显著表达,这与KEGG类固醇合成通路结果一致。同时,还发现反亚油酸在细胞内代谢过程中,还激活了包括肿瘤坏死因子TNF信号通路(TNF signaling pathway)、细胞凋亡(Apoptosis)及PI3K-AKT等信号通路。

图4 KEGG通路富集分析图Fig.4 KEGG pathway enrichment analysis chart
Downar等[12]报道了反油酸(9t C18:1)和反亚油酸(9t,12t-C18:2)能够通过激活 Caspase-3 诱导内皮细胞凋亡。研究者发现反油酸能够通过死亡受体通路和线粒体通路诱导内皮细胞凋亡[13]。饶欢等[14]发现反式脂肪酸能够通过FAS/FASL通路诱导内皮细胞凋亡。在内皮细胞中,TFA能够通过激活PI3K-Akt通路进而增加NO的产生[15]。TFA能够造成系统炎症及其相关炎症因子的表达,包括TNF-α、TNF 受体、IL-6 等[16-18]。
2.5 PPI基因互作分析
基因互作是通过对已知蛋白质/基因之间和预测蛋白质/基因之间的关系进行分析,并借助数据库得到准确的搜寻结果,预测蛋白质/基因的相互关系。这种关系既是相关性的体现,也是相互作用的显现,充分说明了包括蛋白质/基因等之间的关联。
通过图5发现某个基因或蛋白参与了多个生物进程和多条信号通路。这些基因或蛋白在整个信号转导通路网络中起到至关重要的作用,它的表达上调或下调,能够使多条信号通路发生激活或静默。因此,通过对信号通路中的这些靶蛋白或靶基因的检测,能够为了解反式脂肪酸调控内皮细胞生物进程机制提供重要思路。其中,研究发现CSF3基因同时参与疟疾通路(Malaria pathway)和PI3K-Akt信号通路。TRAF1基因同时参与凋亡途径(Apoptosis pathway)和肿瘤坏死因子通路(TNF signaling pathway)通路;TRAF1作为TNF通路受体家族一员,有研究发现TRAF1的激活,会导致TNF信号通路的下调[19]。本试验中TRAF1下调,相反可能会导致TNF信号通路的激活和上调。MMP3基因同时参与了肿瘤坏死因子通路(TNF signaling pathway)和类风湿关节炎通路(Rheumatoid arthritis);有研究报道,在类风湿关节炎细胞模型中,TNF通路会通过激活PI3K-Akt信号通路,进而激活MMP3等炎症因子[20]。通过PPI互作图发现,反式脂肪酸能够诱导TNF通路激活,进而激活MMP3炎症因子,而PI3K-Akt信号通路并没有参与TNF通路。FOS、CTSK同时参与了类风湿关节炎通路(Rheumatoid arthritis)和凋亡途径(Apoptosis pathway);有报道发现 CTSK mRNA表达上调与凋亡成正相关[21]。FOS既可以作为转录激活因子,又可以作为转录抑制因子。而c-fos作为转录抑制因子,在诱导细胞凋亡后,c-fos基因的表达会受到抑制[22]。本研究发现,当反式脂肪酸诱导内皮细胞发生凋亡后,CTSK的mRNA表达上调,同时FOS的mRNA表达受到抑制,与报道研究一致。HMGCS1基因同时参与了萜类骨架合成通路(Terpenoid backbone biosynthesis)、酮体合成和降解通路(Synthesis and degradation of ketone bodies)。HMGCS1是胆固醇合成过程的关键酶,有研究报道显示,在超声波诱导的细胞凋亡中,HMGCS1基因表达及其胆固醇合成通路下调[23]。HMGCS1所涉及的萜类骨架合成通路及其酮体合成和降解通路有可能作为下游通路,参与到反式脂肪酸诱导的内皮细胞凋亡进程中,需要后续试验进行验证。

图5 信号通路网络基因互作图Fig.5 Signal pathway network gene interaction map
3 结论
本研究考察了反亚油酸(9t,12t-C18:2)对内皮细胞转录组学的影响,发现共计126条基因发生显著变化,研究还重点针对表达显著差异的基因进行GO富集分析和讨论。最后根据基因互作通路分析发现:反亚油酸作用于内皮细胞所涉及相关信号通路主要包括类固醇生物合成通路、凋亡通路、肿瘤坏死因子通路和PI3K-Akt信号通路等,还发现多个参与多个通路的靶基因,包括TRAF1、HMGCS1、FOS和CTSK。本研究为后续全方位研究反亚油酸在内皮细胞的作用机制研究提供了方向。

