肝脓肿致内源性眼内炎1例△
吴晨冕 杜皓 邓超华 徐玲娟
(华中科技大学同济医学院附属同济医院眼科 武汉 430030)
资料患者男性,49岁。因发热6 d、右眼视力骤降4 d于2018年1月14日收入我科。入院前曾于当地医院静脉滴注抗生素(头孢菌素类,具体不详)治疗,发热缓解,但眼部红肿加重。既往史:糖尿病病史5年,未规律治疗。否认眼部手术史及外伤史。视力:右眼FC/50 cm,左眼0.4。眼压:右眼27.5 mmHg(1 mmHg=0.133 kPa),左眼20.5 mmHg。右眼睑红、高度肿胀,右眼混合充血,球结膜水肿,角膜透明,前房闪辉(+),前房下方积脓约0.5 mm,瞳孔药物性散大,直径约6 mm,玻璃体呈白色浑浊,眼底窥不清(图1、2)。左眼前后节未见明显异常。血常规:白细胞计数为10.57 ×109/L,中性粒细胞计数为7.09 ×109/L,中性粒细胞百分比为67.1%。尿常规:葡萄糖(+++),酮体(++)。空腹血糖:18.31 mmol/L。巨细胞病毒IgG抗体(+),乙肝病毒、丙肝病毒、人类免疫缺陷病毒、梅毒螺旋体抗体、风疹病毒抗体、弓形虫抗体、单纯疱疹病毒抗体均为阴性。入院后初步诊断为右眼全葡萄膜炎、右眼眼内炎(可疑)、2型糖尿病。患者右眼眼内炎可能性大,但自眼部无法探其病因,且其患2型糖尿病此前未治疗,因此行进一步检查。眼部CT:眼环完整,球内未见异物影。眼睑软组织肿胀,右侧眼球表面软组织增厚,考虑感染性病变可能性大。腹部B超:肝右叶囊实混合性病灶,脓肿可能。上腹部增强CT及磁共振成像(MRI):肝右前叶占位,炎性病变可能(图3)。修正诊断:右眼眼内炎、肝脓肿、2型糖尿病”。

图1 患眼前节段照相 A.右眼睑、球结膜水肿;B.前房闪辉。

图2 右眼眼底照相
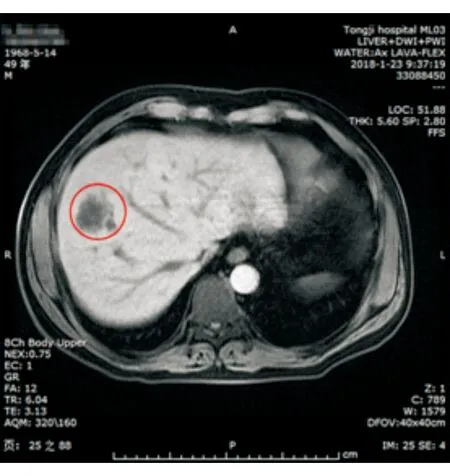
图3 MRI所见肝脏病灶
2018年1月15日行右眼前房冲洗+结膜下万古霉素注射(5%万古霉素0.5 mL)。取前房水及结膜囊分泌物送细菌培养+药敏。培养结果:阴性。请肝脏外科会诊:肝脓肿暂不需切排,建议给予注射用头孢曲松钠他唑巴坦钠(3 g,每8 h 1次)、注射用替考拉宁(400 mg,qd )治疗,5 d后眼部症状无明显缓解。遂于2018年1月19日行右眼玻璃体切除+晶状体摘除+视网膜切开+视网膜下脓肿切除+视网膜光凝+硅油填充术。术中见睫状突表面浓厚渗出膜,玻璃体白色絮状混浊,12:00~5:00方位视网膜球形隆起,其下白色黏稠积脓,范围从锯齿缘至视盘周围。术中取玻璃体液及视网膜下积脓行细菌培养+药敏。术后给予局部抗感染(妥布霉素地塞米松滴眼液,1次/d)、扩瞳(复方托比卡胺滴眼液,1次/d),静脉给予注射用美罗培南(1 g,每12 h 1次)、注射用头孢曲松他唑巴坦钠(4.5 g,每12 h 1次)、注射用替考拉宁(400 mg,1次/d)抗感染。术中玻璃体液、视网膜下积脓做微生物学培养:肺炎克雷白杆菌,药敏结果显示美罗培南、头孢哌酮/舒巴坦、妥布霉素均敏感。抗感染治疗10 d后出院。出院时右眼矫正视力为0.02(+10.0 DS),眼压为13 mmHg,前房渗出吸收,玻璃体腔硅油填充,视网膜平伏。
2018年5月25日复诊。视力:右眼0.02,左眼0.4。右眼角膜透明,前房闪辉(+),瞳孔圆,直径4 mm,晶状体缺如。玻璃体腔硅油填充,视盘色淡,视网膜平伏。2018年5月29日行右眼硅油取出+人工晶状体悬吊术。2018年6月4日出院,右眼视力0.25,右眼最佳矫正视力0.5。
讨论
眼内炎通常指细菌或真菌进入眼内累及玻璃体和(或)房水的感染性炎症。根据感染途径可将眼内炎分为外源性和内源性2类。外源性眼内炎是由内眼手术后、开放性眼外伤及眼内残留异物等因素将致病菌直接种植于眼内所致。内源性眼内炎由致病菌经血源性播散穿透血-眼屏障所致。虽然内源性眼内炎发病率较低,但部分患者起病隐匿,缺乏特异性眼部表现和全身表现,易误诊、漏诊,造成永久性视力损害甚至眼球摘除。
内源性眼内炎的发病率占眼内炎发病率的2%~15%[1]。近年来,肺炎克雷白菌感染引起的内源性眼内炎在世界范围内呈上升趋势[2-4]。而在亚洲,肺炎克雷白菌所致内源性眼内炎占主导地位(60%以上)。肺炎克雷白菌所致眼内炎患者预后视力差于其他眼内炎患者[5-7],被认为是内源性眼内炎预后差的独立危险因素[8]。高达47.4%的患者被迫行眼球摘除或眼内容物剜除[9]。
普通肺炎克雷白菌是导致院内感染的常见病原菌,主要感染抵抗力较弱的人群。然而,自1986年报道以来,高毒力肺炎克雷白菌(hypervirulent Klebsiella pneumoniae,HVKP)导致的内源性眼内炎引起了临床医师和研究者的关注。HVKP主要感染健康人群,导致社区获得性感染,包括肝脓肿、脑膜炎、坏死性筋膜炎、眼内炎和严重肺炎。与普通肺炎克雷白菌相比,HVKP主要导致流动性、健康人群严重感染;易发生感染的远处转移和扩散;肝脓肿患者常无肝、胆疾病史[10]。流行病学资料表明,HVKP在亚洲人群中高发。有研究[5, 11-12]表明,糖尿病是HVKP肝脓肿的主要危险因素。Coburn等[13]报道,动物模型显示糖尿病会增加血管通透性,从而增加血-眼屏障等通透性,加大了内源性眼内炎的发生机会。糖尿病患者易并发眼内炎且视功能较差,严格控制血糖可阻止HVKP导致的转移性并发症的发生[10]。此外,恶性肿瘤、肾脏疾病和肺炎患者也是HVKP的易感人群,。
HVKP一般为社区获得性感染,且对大多抗生素敏感。然而随着抗菌药物的广泛应用,碳青霉烯耐药的肺炎克雷白菌(carbapenem-resistant hypervirulent Klebsiella pneumoniae,CR-HVKP)导致的内源性眼内炎比例有所上升[14-15],需格外注意。
肺炎克雷白菌性眼内炎(endogenous K.pneumoniae endophthalmitis ,EKPE)表现多样,通常可表现为前房积脓、玻璃体浑浊、视网膜及视盘苍白、黄斑梗死或水肿、视网膜血管广泛闭塞等,早期诊断比较困难,可能与虹膜睫状体炎、急性坏死性视网膜炎、全葡萄膜炎等相混淆[15]。部分病例有特征性的瞳孔处脓性渗出 ,形成瞳孔领积脓[16-18]。在肝脓肿患者中,内源性眼内炎的发病率为0.84%~6.9%[19]。EKPE以右眼受累为主,肺炎克雷白菌性肝脓肿的细菌栓子经眼后段血管到达,右眼因经右侧颈动脉更易受侵犯,但双眼受累者也近26%[20]。
EKPE的诊断遵从内源性眼内炎诊断的一般原则。病原体的检出多来自于血、肝抽取液和玻璃体液。眼内液的微生物学检查是确诊眼内炎最有意义的诊断方法。对于怀疑EKPE者,全身系统检查,寻找易感因素和原发感染灶是非常必要的,常用的手段包括血、尿常规,超声心动图,胸、腹部CT等。
一旦怀疑眼内炎,应尽早治疗。治疗前需完成必要的实验室检查,因全身应用抗生素会显著降低微生物学培养的阳性率。有文献[21]报道,药敏结果显示所有革兰阳性菌株均对万古霉素敏感,89.5%革兰阴性菌株同时对阿米卡星和头孢他啶敏感。故经验性用药宜选择广谱强效抗革兰阴性菌抗生素如万古霉素和头孢他啶等。给药方式有全身静脉给药及玻璃体腔注射。全身给药在内源性眼内炎的治疗中具有重要意义,能够同时治疗眼部感染和全身菌血症,可有效降低严重感染者的死亡率。推荐用法为至少1种碳青霉烯类联合大剂量美罗培南(2 g,每8 h 1次)[15]。Jackson等[22]报道,玻璃体注射抗生素联合全身应用抗生素者,相较仅全身使用抗生素者具有更低的眼球摘除率和更好的远期预后。
EKPE的眼部损伤机制主要是由细菌包膜和产生的内毒素引起抗原抗体反应导致视网膜损害[23-24]。部分学者认为加用糖皮质激素利于炎症消退,是有效的辅助疗法。但因糖皮质激素无法提高最终视力,大多数学者不主张应用。
普遍共识认为,炎症比较轻的可以进行药物治疗,而较严重的眼内炎需要手术治疗。玻璃体切除术能够直接清除致病菌、毒性产物和炎性物质,便于药物渗透到视网膜,有利于控制炎症反应,是治疗眼内炎的重要手段。玻璃体切除术中常同时进行玻璃体腔药物注射和玻璃体液微生物检测的取样。目前的主流观点认为,早期行玻璃体切除术有助于改善患者的视力预后[9, 25-27]。王红等[1]主张,无论是否存在视网膜裂孔,均应行硅油填充,原因是硅油对微生物的增殖有一定的抑制作用。但也有研究[15, 19, 21]显示,早期玻璃体切除对于改善EKPE患者眼部的最终结局无显著意义。
EKPE的预后差于其他病原体所致内源性眼内炎。前房积脓、单眼受累、全眼内炎是EKPE预后不良的主要因素。对于CR-HVKP引起的EKPE,早期诊断和及时的眼内及静脉使用碳青霉烯类抗生素仍是目前能够提高预后的最好方法[14]。
综上所述,EKPE是一类较少见但后果严重的内源性眼内炎,在亚洲人群中较常见,早期诊断困难,且CR-HVKP对抗菌药物反应差,及时进行早期玻璃体切除,EKPE的预后仍然不尽如人意。及时的诊断和治疗对于预后具有重要意义。因此眼科医师在临床工作中应对EKPE保持高度警惕,尤其对高龄、糖尿病患者及具有免疫缺陷或免疫抑制者更应全面考虑。在患者出现疑似眼内炎症状或体征时,要积极从局部及全身寻找病因。情况需要时,应当机立断选择手术治疗,以尽可能挽救患者视力及眼球。

