摄食不同种类饵料的鲤肝脏组织miRNA表达谱分析及验证
罗 杰,杨 淞,杜 杰,刘 巧,杜宗君,杨世勇,李胜杰,赵柳兰
(1.四川农业大学动物科技学院,成都 611130;2.中国水产科学研究院珠江水产研究所,热带亚热带鱼类选育与养殖重点开放实验室,广州 510380)
MicroRNA(miRNAs)是一类内源性的、长度为18-25nt的非编码单链小RNA,是一种重要的转录后调控因子,广泛存在于真核生物中[1]。MiRNAs参与调控主要是与mRNA的3′非翻译区(3′UTR)结合,最终引起靶基因翻译受阻或者直接导致靶基因降解[2]。在真核细胞中,miRNA可调控30%以上的靶基因,参与多种调控途径,包括代谢、发育、分化、免疫等过程[3]。目前miRNA与饵料相关的研究较少,主要集中在一些miRNAs与一些重要的营养因子的调控关系上,包括脂肪酸、葡萄糖、维生素等[4-5]。
肝脏是鱼类消化系统的重要组成部分,能分泌大量的消化酶[6]。肝脏是参与生物新陈代谢的重要器官,能参与营养物质代谢过程。肝脏还能通过合成尿素参与到生物体的排泄中。肝脏能通过生物转化的作用将一些非营养物质,如药物、毒物等通过新陈代谢彻底分解或以原形排除体外,具有解毒功能。
鱼类食性一般分为杂食性、草食性、肉食性三种。鱼类对生活环境中的饵料具有一定的选择能力,这种选择能力是由鱼类对饵料生物的需求、环境中这种饵料生物丰度和可获得程度来决定的[7]。当季节发生改变时,水环境pH会发生改变,从而影响水环境饵料生物,影响鱼类食性形成[8]。不同饵料所含营养物质具有差异,能影响鱼类生长、免疫和代谢能力[9-10]。鲤,属于鲤科(Cyprinidae),以藻类、水生植物以及底栖动物为主要食物,是典型的杂食性鱼类。稻田养鱼属于生态农业,稻田养殖密度相对较低,且稻田中同时含有植物性和动物性饵料,鱼类可以选择水环境中的饵料生物。在四川、重庆、云南等地区渔民通常将1-2龄的鲤放入稻田中以提高鱼质量获得更高的经济效益。本团队研究发现稻田养殖下的大鳞副泥鳅肠道具有更高的免疫酶活性[11],然而稻田中存在的饵料对鱼类的影响尚未研究。本实验以摄食不种类饵料的鲤肝脏组织为研究材料,采用Illumina HiSeq深度测序技术结合生物信息学方法,比较 miRNA 及各组样品间差异表达的miRNAs,并分析这些miRNAs可能的靶基因及相关的调控通路,为深入了解它们对鲤摄食不同种类饵料的调控作用奠定基础。
1 材料与方法
1.1 实验鱼
实验鱼购自通威水产工程技术研究中心(成都),同一批次的健康鲤(498.7±21.9) g。饲养于四川农业大学,在直径1 m、高1 m的圆形鱼缸中进行试验,鱼缸水体约1 m3。保障供氧(溶解氧>6 mg/L)、控制温度在(21±1) ℃。
1.2 实验设计
将90尾鲤分为A、B、C三组,每组30尾,保证每组鱼体重差异不显著,随机分配至3个水桶中。
试验开始前暂养2周,并进行驯食,投喂量为鱼总体重的4%。A组投喂蚯蚓(动物性饵料)、B组投喂蚯蚓+浮萍(动物性饵料∶植物性饵料=1∶1)、C组投喂浮萍(植物性饵料),每天定时(9 ∶00、13 ∶00、17 ∶00)投喂。为保障B组鲤摄食饵料为蚯蚓+浮萍,在驯化及试验过程中,根据B组鱼总体重计算其投喂量,然后按动物性饵料∶1植物性饵料=1∶11先投喂1/2总量的蚯蚓,待蚯蚓吃完后再投喂总量1/2的浮萍,以此类推。暂养结束后,停饲24 h后,正式实验8周,饥饿24 h取样。将鱼用MS-222(80 mg/L)麻醉,快速解剖实验鱼取肝脏组织,-80 ℃保存备用。
1.3 肝脏总RNA提取及质量检测
将备用的肝脏组织取出后在研钵中加入液氮研磨充分,然后参照总RNA提取试剂盒(Invitrogen,美国)使用说明进行RNA提取。1%的琼脂糖电泳检测 RNA 样品是否有降解以及杂质,NanoPhotometer®分光光度计检测样品纯度(IMPLEN,CA,USA),Qubit® 2.0 Fluromete(r Life Technologies,CA,USA)检测 RNA 样品浓度,安捷伦 2100 RNA Nano 6000 Assay Kit(Agilent Technologies,CA,USA)检测 RNA 样品的完整性。
1.4 MicroRNA文库的建立与测序
每组分别取1尾鱼完整性和纯度较好的RNA样品(c≥200 ng/μL;RIN≥8.0;28S/18S≥1.5) ,分别作为动物性饵料组、植物性饵料组和混合饵料组的 RNA 用于后续分析。Total RNA样本,采用15% PAGE胶进行小RNA(18-30 nt)分离;分离后的小RNA经乙醇沉淀离心富集;富集后的小RNA样本,根据TruSeq Small RNA Sample Preparation Kit(Illumina,RS-200-0048)方法及流程进行文库制备。文库构建完成后,先使用Qubit2.0进行初步定量,稀释文库1 ng/μL,随后使用 Agilent 2100对文库的insert size进行检测,insert size符合预期后,使用Bio-RAD CFX 96荧光定量PCR仪,Bio-RAD KIT iQ SYBR GRN 进行Q-PCR, 对文库的有效浓度进行准确定量(文库有效浓度>2 nmol/L),以保证文库质量。检测合格的文库,在HiSeq 2500测序平台上运行单端测序程序(SE50),得到50 bp的序列reads。HiSeq深度测序由安诺优达基因科技中心完成。
1.5 miRNA测序数据的处理和映射
将HiSeq测序获得的total reads进行筛选,剔除3′端接头缺失、插入片段缺失、5′端污染、长度小于18 nt长于32 nt及含polyA的reads后,将测序质量较高的reads去接头、去污染后得到干净的序列(clean reads)。
1.6 已知 miRNA 的鉴定与差异分析
使用bowtie2(2.2.3)将高质量的clean reads映射到miRBase数据库中列出的鲤基因组[12],鉴定出已知miRNA。
已知miRNA的差异表达分析使用edgeR软件[13],筛选标准是基因表达差异倍数大于2、并且FDR≤0.05为显著差异的基因。
1.7 实时荧光定量qRT-PCR分析验证差异miRNA
为了消除个体间差异和增加数据代表性,每组随机选取6个样本进行荧光定量qRT-PCR验证。参照1.3提取总RNA,提取的总RNA用miRcute Plus miRNA First-Strand cDNA Synthesis反转录试剂盒(Tiangen)进行miRNA-cDNA反转录,具体操作步骤参考说明书。每组6个样本,每个样本设置3个重复,同时设不加模版cDNA的作为阴性对照。在CFX Connect荧光定量PCR仪上进行扩增反应,反应条件为:95 ℃ 15 min 预变性;94 ℃ 20 s,退火30 s,72 ℃延伸30 s,循环 40 次。最后,通过融解曲线验证PCR扩增的特异性。U6作为内参基因,选取了2.2中共同差异表达的5个与代谢相关的miRNA验证其表达趋势,包括ccr-miR-375-3p、ccr-miR-217-5p、ccr-miR-182-5p、ccr-miR-153c-3p和ccr-miR-129b-5p。结果采用2-ΔΔCT法计算基因的相对表达量[14]。用Primer Premier 5.0 软件设计引物并由北京六合华大基因科技有限公司合成相关引物,引物序列及退火温度见表1。

表1 qRT-PCR的引物序列及退火温度Tab.1 Primer and annealing temperature for qRT-PCR validation
1.8 靶基因GO分析及KEGG通路分析
差异表达miRNA的靶基因预测使用mirPath v.3[15],利用GO和KEGG数据库对预测的靶基因进行功能分析。通过超几何检验确定了差异表达miRNA中显著富集的GO项和KEGG通路。当GO条目和KEGG通路P<0.05时,定义为显著富集的GO条目和KEGG通路。
2 结果
2.1 miRNA测序结果
通过深度测序后动物性饵料组,混合饵料组和植物饵料组组获得的干净reads,映射Reads,映射率以及每组鉴定出已知miRNAs如表2所示。

表2 鲤肝脏小RNA测序结果汇总Tab.2 Summary statistics of miRNA sequencing results for the C.carpio libraries
2.2 差异表达miRNAs分析结果
分别比较A与B,C与B,A与C两两之间的差异表达miRNAs,结果显示A与B比较共有差异表达miRNA 109个,其中71个上调表达,38个下调表达;C与B比较共有差异表达miRNA 126个,其中90个上调表达,36个下调表达;A与C比较共有差异表达miRNA 34个,其中11个上调表达,23个下调表达(图1a)。三种饵料组两两比较共表达的差异miRNAs有13个,分别为ccr-miR-129-3p,ccr-miR-129-5p,ccr-miR-132a-3p,ccr-miR-153c-3p,ccr-miR-182-5p,ccr-miR-183-5p,ccr-miR-187-3p,ccr-miR-196a-5p,ccr-miR-217-3p,ccr-miR-217-5p,ccr-miR-218a-3p,ccr-miR-218a-5p和ccr-miR-375-3p(图1b)。挑选了5个已有研究证明的与代谢相关的miRNA验证其表达趋势,qPCR结果显示这些miRNA表达趋势与测序结果基本一致(n=6),表明测序结果可信。
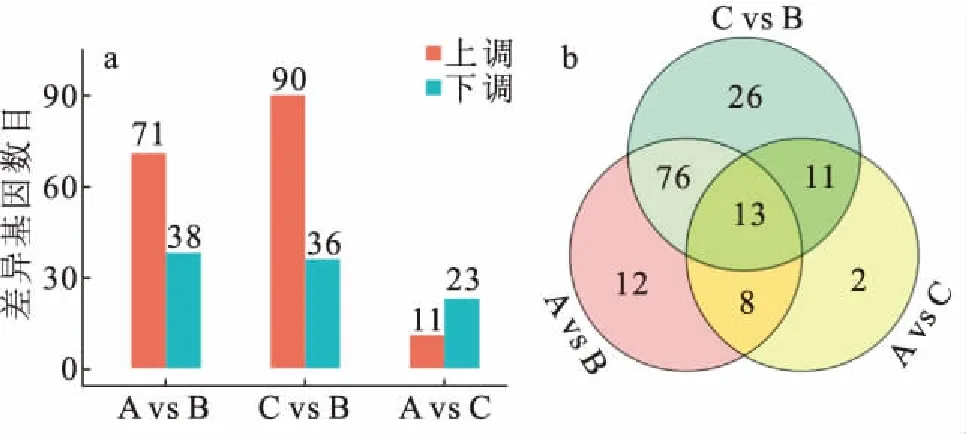
图1 鲤肝脏组织已知miRNAs 差异基因分析Fig.1 Differential miRNA expression analysis of C.carpio(a)A vs B、C vs B以及A vs C的差异表达基因数量(P<0.05);(b)各比较组重叠差异表达的miRNA的维恩图
2.3 靶基因预测及功能分析
使用mirPath v.3预测靶基因,13个共同差异表达的miRNAs共有10个miRNAs预测到了靶基因,分别为ccr-miR-129-3p(39个),ccr-miR-129-5p(7个),ccr-miR-132a-3p(40个),ccr-miR-153c-3p(38个),ccr-miR-182-5p(83个),ccr-miR-183-5p(108个),ccr-miR-196a-5p(22个), ccr-miR-217-5p(100个),ccr-miR-218a-3p(102个)和ccr-miR-375-3p(6个),共预测到了530个靶基因。
对靶基因进行GO及KEGG分析,GO分析结果显示这些共表达的差异miRNAs主要参与发育过程、脂类代谢过程和细胞分化等生物过程;参与内质网、细胞外间隙、细胞核等细胞组成;酶活性调节、分子功能调节、转移酶活性等分子功能调节(图2)。KEGG分析结果显示,差异表达miRNAs主要参与2-羰基羧酸代谢、糖基磷脂酰肌醇(GPI)-锚定生物合成、硫胺素代谢、糖肽类生物合成、柠檬酸循环(TCA循环)、脂肪代谢等通路的调节(图3)。
3 讨论
本研究中我们以三组投喂不同类型饵料的鲤的肝脏为研究材料,通过深度测序技术和生物信息学分析miRNA,分别鉴定出219个,226个和223个已知miRNAs。对摄食不同种类饵料的鲤已知miRNAs进行差异分析,共表达的差异miRNAs有13个,其中表达量最高的3个共同差异表达miRNAs分别为ccr-miR-375-3p、ccr-miR-217-5p和ccr-miR-182-5p,且三个miRNA均有研究表明与鱼类糖代谢和脂代谢相关。

图2 差异表达miRNA的GO分析Fig.2 Analysis of GO on the differential expression of the miRNAs
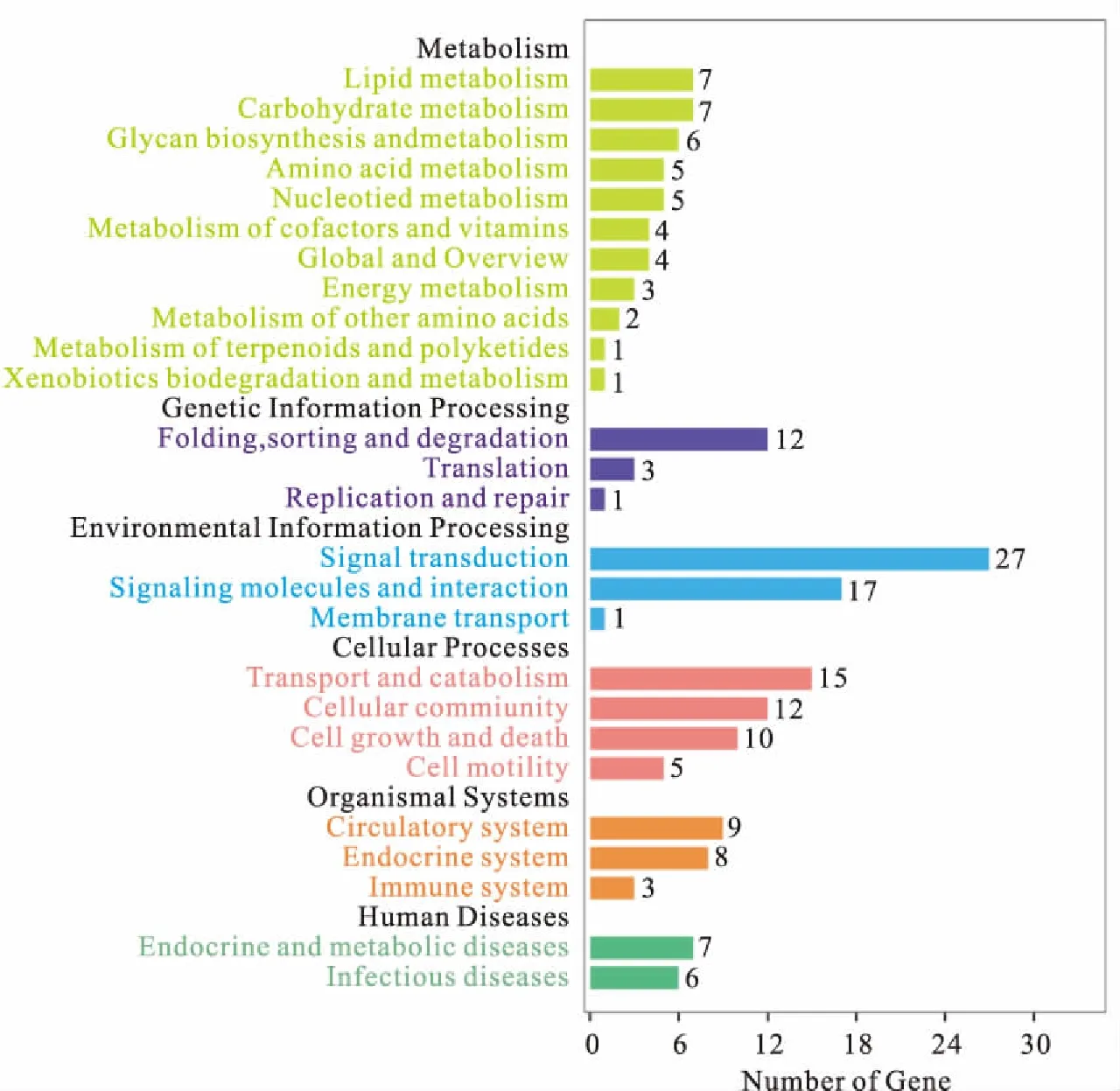
图3 差异表达miRNA的KEGG分析Fig.3 Analysis of KEGG on the differential expression of the miRNAs
MiR-375是一类特异性高表达于胰腺组织的非编码小RNA,对胰岛B细胞分化、胰岛素分泌及糖、脂代谢具有重要的调控作用。研究表明,miR-375直接调控多种胰岛组织中特异性转录因子的表达,参与调控胰岛B细胞分化、胰岛素合成与分泌等生物学功能[16]。MiR-375还参与脂肪细胞分化,并与主要在肝脏和脂肪组织中表达的脂联素受体2(AdipoR2)的3′非编码区结合调控AdiPoR2蛋白的表达,调节机体组织器官的脂代谢过程[17]。动物饵料的脂肪含量显著高于植物饵料,本研究中动物饵料组miR-375-3p表达量显著低于植物饵料组,推测高的脂肪含量抑制了miR-375的表达。MiR-375可直接作用于糖酵解途径中的乳酸脱氢酶B的mRNA和蛋白质的表达,影响糖代谢过程,在维持糖稳态方面起重要作用[18]。本研究结果表明蚯蚓组miR-375-3p表达显著低于浮萍组,推测机体可能通过调控miR-375的表达来维持糖稳态。
MiR-217是miRNAs家族的重要成员,参与糖代谢、肿瘤发生、细胞衰老及血管生成等生物过程。MiR-217参与糖代谢主要是通过Sirt1靶基因进行作用,研究证明在高糖培养的RMCs中,miR-217通过调节Sirt1/HIF-1α通路促进炎症反应及纤维化,为Sirt1在糖尿病肾病中发挥保护作用[19]。Fiorentino等[20]研究发现,在高糖处理后miR-217表达升高,并通过下调其靶基因Sirt l的表达。在本研究中,A组miR-217-5p表达量显著低于C组,推测可能是由于浮萍含有更高的淀粉和纤维素导致miR-217表达升高,但是否是由于下调其靶基因Sirt l的表达来实现调控的还有待进一步研究。
MiR-182属于miR-183/96/182簇(cluster)的一员,在多种细胞和组织中表达,参与糖、脂代谢。MiR-182的异常表达可能导致代谢性疾病发生[21]。研究证明,在2型糖尿病小鼠模型的血清、胰腺及胰岛素敏感组织如肝脏、脂肪和骨骼肌中miR-182的表达与正常对照组相比显著下降,表明miR-182在肝脏及其他组织中的低表达可能参与2型糖尿病的发生[21]。研究证明miR-182 启动子的转录活性可以被脂质合成调控因子SREBP-2(sterol regulatory element-binding proteins 2)激活,而miR-182则通过下调 Fbxw7(F-box and WD repeat domain containing 7)和Insig2(insulin induced gene 2)这两SREBP的负调节因子间接促进细胞核内SREBP的聚积,从而形成一个内源性脂质代谢的调控环路,表明miR-182 参与了细胞内脂质代谢的调控[22]。在3T3- L1前脂肪细胞分化过程MiR-182呈下调趋势,表明miR-182 可能还参与脂肪细胞的分化调控[23]。本研究结果表明动物饵料组miR-182-5p表达量低于植物饵料组,推测低的脂肪含量通过提高miR-182-5p的表达量来抑制脂肪细胞分化。
除上述高表达的差异miRNA外,miR-129-5p,miR-218a等也与代谢相关。研究发现miR-218 转染后可以抑制胶质瘤细胞系中的糖代谢水平[24]。MiR-129-5p是miRNA家族成员之一,上调表达的miR-129-5p可以促进肿瘤细胞的凋亡[25]。栾文康等[26]研究发现转染miR-129-5p后细胞葡萄糖消耗量和乳酸生成量较对照组均明显降低,说明miR-129-5p明显影响了细胞的糖代谢水平。本研究中动物饵料组和混合饵料组的ccr-miR-218a-3p和miR-129-5p表达量显著高于植物饵料组,推测此时动物饵料组和混合饵料组的鲤肝细胞的糖代谢水平受到了抑制,可能与饵料低的淀粉含量相关。
本研究对差异表达的 miRNA 靶基因进行 KEGG 注释,发现涉及到代谢相关通路主要有柠檬酸循环(TCA循环)、糖基磷脂酰肌醇(GPI)-锚定生物合成、脂肪代谢等通路的调节。三羧酸循环是三大营养素(糖类、脂类、氨基酸)的最终代谢通路,又是糖类、脂类、氨基酸代谢联系的枢纽,此代谢途径出错可能导致血糖代谢异常,引发糖尿病。GPI的核心结构由乙醇胺磷酸盐、三个甘露糖苷、葡糖胺以及纤维醇磷脂组成,被证实是蛋白与细胞膜结合的唯一方式。脂肪代谢途径是脂肪在细胞中的合成和降解,包括脂肪分解或储存以获取能量,这些脂肪是从食物中获得的,或者是由动物的肝脏合成的。本研究KEGG注释结果显示,所获得的差异表达的miRNA参与鲤的代谢信号通路,推测这些miRNAs在鲤代谢不同营养物质中发挥重要作用,miRNA与对应的靶基因可能发生的调控作用还有待进一步研究。

