RFWD3在肝细胞癌中的表达及其临床相关性研究
王维杰,金婉婉,潘洁,王立博,朱荣涛,李健,张弛弦,梁若鹏
(郑州大学第一附属医院,河南 郑州 450052,1.肝胆胰外科,2.急诊科)
肝细胞癌(HCC)是世界上最常见的恶性肿瘤之一,占全球新增病例的50%以上,具有高侵袭性和高病死率的特点。尽管近年来HCC的治疗取得了显著进步,但肝癌切除术后5年复发率仍高达70%,且大多数患者于术后2年内复发[1-3]。我国是乙肝大国,每年约有35/10万人因HCC死亡,仅次于肺癌[4]。尽管医学研究不断深入,但HCC的早期诊断率依然偏低,即使对早期的HCC行根治性切除,五年生存率也仅为60%左右[5-6]。
毛细血管扩张性共济失调症突变基因(ataxia telangiectasia-mutated,ATM)和共济失调毛细血管扩张以及Rad3相关基因(ataxia telangiectasia-mutated and Rad-3 related,ATR)是DNA损伤反应中的两个关键位点,ATM和ATR信号转导依赖于中心支架蛋白(replication protein A,RPA)。近期的研究发现,RFWD3能介导RPA的泛素化,并通过作用于多重赖氨酸残基参与到ATM/ATR通路,应对DNA损伤反应[7-9],而DNA损伤反应异常是肿瘤发生发展的重要机制之一。目前RFWD3在HCC中的具体作用仍不明确,其表达情况及其与HCC预后的关系也尚不清楚,本研究旨在通过检测HCC临床标本中RFWD3的表达情况,并结合数据库资源和临床资料,探索RFWD3与HCC预后的相关性。
1 材料和方法
1.1 临床样本和资料收集
本研究中所有标本均来源于2014年1月至2017年12月在郑州大学第一附属医院肝胆胰外科接受HCC切除术的患者,且已于术前取得了患者的知情同意。入组标准:所有患者均为初次手术,且术前未进行放化疗,无其他相关合并症。标本切除后立即在-80 ℃环境中妥善保存,术后病理皆证实为HCC。随机选取40对HCC组织及癌旁正常肝脏组织进行后续检测,同时采集患者的性别、年龄、乙肝表面抗原表达、和肿瘤大小及分期等资料。
1.2 RT-PCR法测定RFWD3转录水平的表达
采用TRIzol(Invitrogen公司)提取组织总RNA,进而用分光光度计测定RNA浓度。利用逆转录试剂盒(Promega公司),依照说明书步骤将RNA逆转录成cDNA。之后利用qRT-PCR测定双链DNA染料SYBR Green PCR Master Mixture(美国AB公司)。
1.3 Western blotting和免疫组化(immunohistochemistry,IHC)法检测RFWD3的表达
(1)Western blotting:将HCC组织和癌旁组织分别制成匀浆,提取蛋白质并采用分光光度计测定其浓度,分别计算标本的上样量。利用SDS-PAGE分离,然后转移至PVDF膜(聚偏二氟乙烯膜),再将膜放入用1×TBST配制的5%脱脂牛奶中,室温下封闭2 h,之后弃牛奶加入一抗(1:400稀释)和GAPDH(1:3 000稀释),接着置于4 ℃摇床上孵育过夜,用1×TBST洗涤3次,于室温下加入用辣根过氧化物酶标记的二抗(1:3 000稀释),孵育2 h,再次用1×TBST洗涤3次后检测抗原抗体的免疫反应活性。将上述步骤于相同条件下重复3次,结果取均值。(2)IHC:肝癌和癌旁组织常规脱水、透明、浸蜡、包埋及切片。4 μm石蜡切片用于RFWD3免疫组化染色,光镜下捕片、观察并分析。
1.4 GEPIA数据库分析
在GEPIA数据库中检索RFWD3在HCC以及癌旁正常肝组织中的生物学信息,计算RFWD3的表达量,分析其与HCC总生存率和无瘤生存期的相关性。
1.5 统计学分析
应用GraphPad-Prism(Windows version-5.0)软件进行统计学分析。数据结果用(±s)表示,用Mann Whitneyt检验比较不同样本之间的差异,采用Pearsonχ2检验分析临床特征与RFWD3表达的相关性,以上结果均设定P<0.05为差异有统计学意义。
2 结果
2.1 RT-PCR检测各样品中RFWD3基因转录水平的表达
运用RT-PCR技术检测40例HCC组织及其癌旁组织中RFWD3的mRNA表达量,如图1所示,RFWD3的mRNA在HCC组织中的相对表达水平为(1.19±0.11),在癌旁组织中的相对表达水平为(0.35±0.04)。与癌旁组织相比,HCC组织中RFWD3的mRNA表达显著升高,差异具有统计学意义(P<0.001)。
2.2 Western blotting和IHC检测各样品的RFWD3表达量和临床相关性分析

图1 40例HCC组织及其癌旁组织的RT-PCR显示,与癌旁组织相比,RFWD3的mRNA在HCC组织中的表达显著升高(P<0.001)
运用Western blotting和IHC技术检测40对HCC组织及其癌旁组织中RFWD3的表达量,如图2所示,HCC组织及其癌旁组织中均有RFWD3表达,通过灰度值分析发现,与癌旁组织相比,HCC组织中RFWD3的表达显著升高(P<0.001),IHC染色进一步证实HCC癌组织中RFWD3阳性率显著增加。
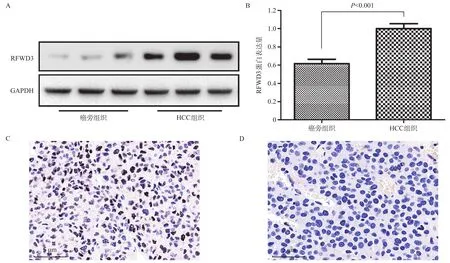
图2 40例HCC组织及其癌旁组织的Western boltting和IHC显示,与癌旁组织相比,RFWD3在HCC组织中的表达量显著升高(P<0.001)
临床资料(表1)分析发现,RFWD3的表达情况与HCC肿瘤大小之间存在显著相关性(P=0.033),然而与患者的性别、年龄、乙肝表面抗原表达情况和TNM分期之间无显著相关性(P>0.05)。
为消除抽样误差对研究结果的影响,我们从GEPIA数据库中提取了部分关于RFWD3在HCC组织以及正常肝组织中表达的数据[10],分析结果显示,与正常肝组织相比,RFWD3在HCC组织中的表达量显著增高(图3A),同时,在HCC患者中,RFWD3的高表达也伴随着更低的总体生存率和无瘤生存期(P<0.05) (图3B和3C)。
3 讨论
HCC是最常见的癌症之一,具有高发病率、易转移和预后差等特点,严重危害着人类的健康[11-13]。研究表明,HCC术后复发涉及肿瘤自身特征、手术相关因素及患者自身情况等诸多方面,早期复发多表现为局部浸润、肝内播散和肿瘤自身生物学特征改变,晚期复发则主要表现为致癌因素如肝炎、肝硬化等导致的新发病灶形成[3]。为了更好地治疗和预防HCC,目前已有很多研究试图阐明其发生发展的分子机制,目前已知的HCC的发生发展与抑癌基因缺失、原癌基因激活、DNA甲基化、肿瘤的血管生成等多种因素密切相关,但主导因素并不明确。随着分子生物学研究的不断进展,现认为HCC是体内诸多生物信号转导通路的相互作用下所产生的结果[14-15]。细胞的信号转导通路通过一系列的正负反馈行为相互作用,从而调控细胞的复制、转录和翻译等一系列生物学行为,影响着HCC的侵袭、转移、耐药和肿瘤的复发[16-18]。因此,探索HCC发生的关键调控基因,明确其信号转导通路进而阐明其调控机制,对提高HCC的早期诊断率和改善患者预后有着极为重要的临床意义。
RFWD3作为ATM/ATR的磷酸化底物作用于多重赖氨酸残基,从而参与DNA损伤修复的过程[8,19-20]。查阅RFWD3相关研究发现,缺乏RFWD3表达可能会导致一系列疾病,尤其是恶性肿瘤的发生[19-20]。Fu等[21]学者率先报道RFWD3可与Mdm2形成RFWD3-Mdm2泛素酶复合物,从而正向调节P53的稳定性来应对DNA损伤修复。Elia和Feeney等学者的研究表明,在DNA损伤发生后,RFWD3在被停止的复制叉处聚积,与复制蛋白A (RPA)共同定位,并通过其WD40域在C端与RPA相结合,在同源重组之后促进复制叉的重新启动[7],同时促进RPA介导的DNA损伤反应[22],而DNA损伤修复异常是肿瘤进展的重要机制之一。目前RFWD3的功能尚不明确,且无研究证实其在 HCC中的表达水平及与HCC患者预后的相关性。

表1 临床资料参数和RFWD3表达相关性
我们首先利用RT-PCR技术,检测了40例接受手术切除的HCC患者的癌及癌旁组织中RFWD3的mRNA表达量,结果显示HCC标本中RFWD3的mRNA表达量明显高于癌旁组织。同时,运用Western boltting和IHC技术,对40例HCC组织和癌旁组织进行RFWD3蛋白的定量检测,从表达水平上得到了相同的结果。以上结果提示RFWD3基因的上调可能参与了HCC的发生发展。
此外,我们根据HCC组织和癌旁组织中RFWD3的表达情况,结合临床资料,运用Pearson Chi-Squared检验分析RFWD3的表达量与HCC预后的关系,结果显示HCC组织中RFWD3的高表达与肿瘤大小之间存在显著相关,与肿瘤的TNM分期有正相关趋势,但无统计学意义,提示RFWD3的高表达很可能是HCC的一个不良预后因素;与此相对应,HCC组织中RFWD3的表达量与患者的性别、年龄以及乙肝表面抗原表达情况之间无显著相关性。以上结果提示RFWD3基因的上调可能参与了HCC的发生和发展,与HCC患者的预后密切相关。
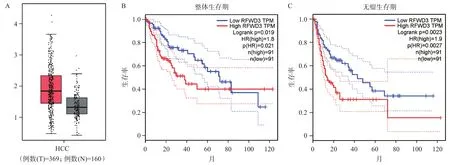
图3 GEPIA数据库结果
鉴于本研究样本量偏小,我们从GEPIA数据库中提取大量HCC患者的数据来进一步验证我们的结果,以减小抽样误差[10]。首先选取369例HCC组织和160例正常肝脏组织的数据,分析结果显示RFWD3在HCC组织中的表达量显著高于正常肝脏组织,该结果与我们的研究结果相互印证。之后我们又从HCC患者中分别选取RFWD3高表达和低表达数据各91例,分析结果显示,RFWD3高表达的HCC患者总体生存率和无瘤生存期远低于RFWD3低表达的患者,提示RFWD3的高表达是HCC的一个重要不良预后因素,这与我们的研究结果RFWD3高表达和HCC肿瘤大小呈成正相关这一结果也是一致的。因此,RFWD3基因的高表达可能参与了HCC的发生和发展,同时也可能是HCC一个重要的不良预后因素。
综上所述,RFWD3基因的高表达可能是HCC一个重要的不良预后因素,以RFWD3这一功能基因为切入点,进一步揭示其介导HCC进展的生物学调控机制,将可能成为认识和探索HCC发病机制的一个新的研究方向,为HCC的临床诊治提供新的理论基础。