保留脾血管的腹腔镜胰体尾切除术安全性初探
田全发,乔建梁,靳君华,郑卫华,张俊晶
(1.内蒙古医科大学附属医院 肝胆胰脾外科,内蒙古 呼和浩特 010030;2.内蒙古医科大学 外科学重点实验室,内蒙古 呼和浩特 010050)
脾脏作为人体最大的免疫器官,对维持机体正常功能具有重要意义。对于胰腺体尾部良性或低度恶性肿瘤,局部切除就能够达到根治目的。因此,保留脾脏的胰体尾切除术已然成为治疗胰腺体尾部良性或低度恶性肿瘤的首选术式。腹腔镜下操作与传统开腹胰体尾切除术相比,创伤更小,且加速患者康复,更易被患者接受。腹腔镜保留脾脏的胰体尾切除术(laparoscopic spleen preserving distal pancreatectomy,LSPDP)包括保留脾血管的LSPDP(Kimura法)和不保留脾血管的LSPDP(Warshaw法)。Kimura法可避免因脾脏血供异常而导致的并发症,是更为理想的保脾方式[1]。但由于脾脏动静脉紧邻胰腺,解剖关系复杂,走行长,Kimura法更容易损伤脾血管,其应用受到了很大程度的限制。Warshaw法指发现脾动静脉难以游离时,离断脾动静脉,保留胃短动脉以保证脾脏的血供[2]。其优点是手术较Kimura法简单,适用于瘤体紧邻脾脏血管或者无法完整切除瘤体;缺点是大大减少了脾脏的血供,术后发生脾梗死的几率增加[3]。我院肝胆外科完成5例Kimura法LSPDP,疗效满意,现对LSPDP的安全性进行简要分析,以期对初期尝试行Kimura法的医师有所帮助。
1 资料和方法
1.1 一般资料
2015年1月至2019年6月我院收治的良性或低度恶性胰体尾病变者5例,其中男1例,女4例,年龄25~63岁,平均(37.60±14.72)岁。瘤体位于胰腺体或尾部,肿瘤大小为3~6 cm,平均(4.32±1.10)cm,所有患者均接受详细的术前评估,包括腹部增强CT或磁共振成像、肿瘤标记物和超声内镜检查。
1.2 手术方法
全组5例均由肝胆胰脾外科具有丰富的胰腺肿瘤手术经验的主刀医师和助手完成。所有患者均接受LSPDP。具体操作步骤如下:全麻联合硬膜外麻醉,仰卧分腿位,于剑突下2 cm、脐与剑突连线中下1/3处、左侧腹直肌外侧缘平脐处、左腋前线平脐处分别行0.5、1.2、1.2、0.5 cm切口置入Trocar,作为主刀和助手的操作孔,Trocar位置亦可围绕手术区域整体移动;脐部偏左侧1 cm置入1.2 cm Trocar作为观察孔。首先探查脏器表面,看是否存在肿瘤转移或合并疾病情况(见图1)。离断胃结肠韧带及脾胃韧带,探查胰腺肿物,辨认与周围脏器如脾脏、胃及后腹膜界限。从肠系膜上动脉左侧正常情况下胰腺上缘显露脾动脉,采用4-0线悬吊,超声刀继续向脾门方向游离脾动脉,直至脾动脉入脾门。从肠系膜上动脉左侧游离胰腺下缘直至脾门,胰腺后方打通隧道,脾静脉位于胰腺后方,将肿瘤近侧胰腺与脾静脉一同悬吊,将脾静脉从胰腺实质剥离;脾静脉单独悬吊,距肿物1 cm处胰头方向使用切割闭合器离断胰腺组织,近侧断端采用可吸收线间断缝合,拟切除胰腺组织断端缝合一针作为牵引线,向脾门方向,从胰腺实质剥离脾动静脉,依次结扎或缝合进入胰腺实质的分支血管(见图2)。当脾静脉分支直径小于0.1 cm可用超声刀直接离断,大于0.1 cm时可Hem-o-lok夹闭后离断。游离时尽量靠近脾静脉,远离胰腺组织。遇到主干有出血情况,血管悬吊线悬吊,确认出血点;悬吊不理想情况下,可置入纱布压挤,缓慢移动直至找到出血点。确认出血点后,其近远侧采用Bull Dog阻断,血管缝合线缝合,完整切除瘤体连同胰腺组织(见图3)。
将瘤体连同胰腺组织装进标本袋,经Trocar孔(可适当延长切口)取出,标本术中冰冻,证实肿瘤性质及切缘是否符合要求。于胰腺断端旁放置20#硅胶引流管及14#聚乙烯管各一根,从操作孔引出固定(见图4)。
1.3 围手术期处理
术后常规给予生长抑素(思他宁)6 mg/24 h,持续泵入,维持3 d。术后1、3、5、7 d常规检测引流液淀粉酶量。同时给予抗感染、抑酸及营养支持治疗[4],胰腺断端旁引流管如引流液少且淀粉酶不高,连续3次检测后可拔出;如引流管中淀粉酶测定高于正常上限的3倍且引流量>50 mL/d,维持引流管引流,直至引流液减少或消失,影像学复查无积液后拔除。
2 结果
2.1 术中及术后情况
5例手术均顺利完成,无中转开腹,无围手术期死亡;病理证实均为良性或者低度恶性肿瘤,其中胰腺囊肿1例,黏液性囊腺瘤2例,浆液性囊腺瘤1例,慢性胰腺炎症合并假性囊肿1例,术后测量肿物直径范围为3.0~6.3 cm,平均4.32 cm;手术时间3.0~8.5 h,平均(5.7±1.82)h;出血量50~300 mL,平均(130±98.49)mL。术后第4~12 d拔管,第7~14 d出院,术后平均住院时间(9.52±2.21)d。术后随访,无肿瘤复发。A级胰瘘1例。
2.2 术后并发症情况
按照Clavien外科并发症分级标准:I级并发症1例,II级并发症1例,为胰瘘合并迟发性出血,保守治疗治愈;并发症发生率为40%(2/5)。按照国际胰瘘研究小组(ISGPF)标准:本组术后发生生化瘘1例,持续引流近2周后愈合,发生率20%(1/5)。术后随访2个月至2年,患者生活质量良好,与术前基本一致。
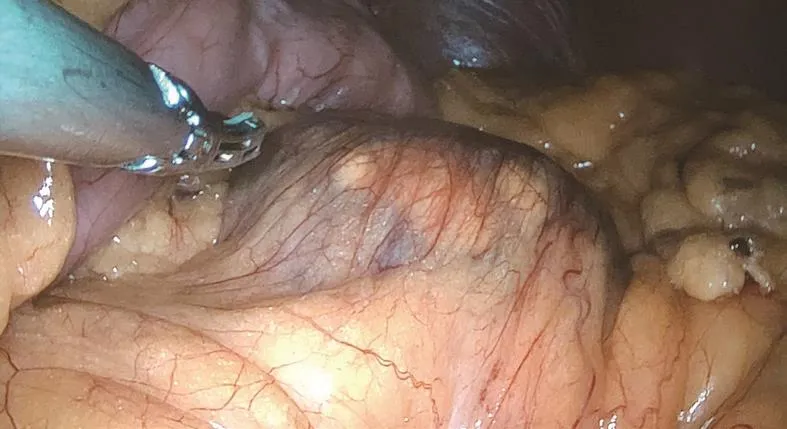
图1 腔镜探查肿物

图2 移除标本,脾动静脉保留

图3 切除标本

图4 Trocar布局
3 讨论
脾脏在先天免疫和后天免疫中起着重要作用[5]。脾脏切除后并发症,主要是易感染、易形成血栓栓塞[6-7]及增加癌症发病率[8],甚至会引起严重的脾切除术后感染(OPSI)。感染风险随相关并发症和脾切除术后的时间间隔而变化[9],OPSI的发生率在脾切除术后的前两年风险最高,且这种风险终生存在。因此,要尽量避免“无辜性脾切除”。胰体尾病变时是否行保留脾血管LSPDP应根据肿瘤性质、大小,胰体尾与脾脏血管、脾门结构的关联等等来确定。良性或者介于良恶性之间肿瘤是行保留脾血管LSPDP的指征,而恶性肿瘤不管大与小均应包括淋巴结清扫以及联合脾切除,列为保留脾血管LSPDP的禁忌证。有文献报道,肿瘤大小是影响保留脾血管 LSPDP成功率的关键因素。对于此问题,笔者认为应辩证对待,肿瘤与血管关系密切,即使直径偏小,保留血管亦存在较大的风险性;而与血管解剖关系清晰,直径偏大,手术亦是可尝试的。笔者所在单位因为是初期行保留脾血管LSPDP,对指征把握相对严格,肿瘤最大直径未超过6.3 cm,而该肿物也是外生型。血管与胰腺组织关系也需要考量[10-11],当血管尤其是脾静脉有全部被包绕或者近2/3被包绕,此类患者行保留脾血管LSPDP,出血风险较高,有时甚至是不可控的,需中转开腹解决。本组病例术前完善影像学检查,尤其对血管与胰腺组织关系经过细致评估,对于脾静脉完全被包绕患者术前规划为Warshaw法或联合脾脏的切除[12-14]。
保留脾血管LSPDP开展的医院越来越多,并逐渐向基层普及,而在大的医疗中心甚至已经开展前瞻性研究,但保留脾血管LSPDP与开腹手术、不保留脾血管的LSPDP以及联合脾脏切除手术等等存在很大不同,对于初期开展保留血管的LSPDP,一定应具备以下条件:(1)术者及第一助手需有丰富的临床经验,尤其是开腹经验,如果遇到困难如血流控制不住或粘连紧密等应及时中转开腹。(2)腔镜技术的掌握需经历一段学习曲线,基本功要扎实,尤其缝合技术要过关,手术团队能独立完成腔镜下血管吻合;完成学习曲线后,临床要有开展较为复杂的腔镜手术经历。笔者所在团队前期在本地率先开展腹腔镜下胰腺十二指肠切除术、腹腔镜下半肝切除术等复杂手术,为保留脾血管LSPDP的开展打下扎实的临床基础。(3)保留脾血管LSPDP成功率与诸多因素有关,手术团队围手术期评估得当,早期阶段指征把握严格,当技术成熟稳定时,可扩大指征。笔者所在团队早期把握这个原则,病例选择适当,所实施病例基本都是按照术前规划,无中转开腹病例。(4)游离脾血管为手术关键,腹腔镜有放大视野功能,这是腹腔镜技术优势,在游离血管时充分利用这种优势[15]。脾血管悬吊后,拟切除胰腺断端缝扎作为牵引,超声刀与吸引器配合沿血管壁撸、刮,过程需轻柔,切勿撕、拉、扯,易致血管壁破裂出血。同时注意有无分支。笔者认为如分支血管直径小于0.1 cm,可直接超声刀离断。如大于0.1 cm,可钳夹夹闭后再离断。如果术中不慎动脉出血,Bull Dog先钳夹脾动脉近心端;如果静脉出血,Bull Dog先钳夹脾静脉远心端,或收缩悬吊线止血,或纱布轻推后移,然后仔细寻找出血点,5-0 Prolene单线8字缝合止血点。本组病例游离血管过程均有不同程度出血,腔镜下得以修复,未造成不良后果。
保留脾血管LSPDP的术后并发症与开腹胰腺手术相似[16-17],胰瘘、出血是其主要并发症,但与胰腺十二指肠切除术相比,其并发症发生率较低、严重程度较轻。国际胰瘘研究组于2005年统一了定义标准及分级,并于2016年进行了补充:将A级瘘改为生化瘘;B级瘘需与临床相关并影响术后进程,如术后经皮穿刺或内镜穿刺属于B级瘘;当B级瘘需要手术或并发有单个或多个器官衰竭或死亡时则为C级瘘。胰瘘的发生原因是复杂的,并非单一因素所决定。本组5例LSPDP中,A级胰瘘合并延迟性出血1例,给予双套管每天冲洗,直至每天引流液引出量小于10 mL,同时行腹部CT判定无胰周积液时拔除引流管,患者治愈出院。上述患者合并有延迟性出血,考虑胰瘘在前,胰瘘可能是导致出血的原因,控制胰瘘也就控制了出血。文献亦有报道,术后短期出现大出血,考虑与血管医源性损伤或者分支血管开放有关,本组病例未见此种情况,但随着病例数的增多,此种情况发生概率增加,再次手术是有效解决途径[18-19]。
综上所述,保留脾血管 LSPDP在严把手术指征、围手术期精心准备的前提下,初期尝试行保留脾血管的腹腔镜胰体尾切除术是安全可行的。