鸭坦布苏病毒的血凝性
王小蕾,刘月焕,段会娟,刘立新,杨志远,赵际成,潘洁,刘瑞华,赵文奇,田方杰,吕金宝,林健
鸭坦布苏病毒的血凝性
王小蕾1,刘月焕1,段会娟1,刘立新1,杨志远1,赵际成1,潘洁1,刘瑞华1,赵文奇2,田方杰2,吕金宝3,林健1
(1北京市农林科学院畜牧兽医研究所,北京 100097;2北京农学院,北京 102206;3内蒙古农业大学,呼和浩特 010018)
【】研究鸭坦布苏病毒是否具有血凝性,确定其凝集的红细胞种类和血凝反应条件。鸭坦布苏病毒以不同稀释度经脑内途径接种1—3日龄的BALB/c乳鼠,观察乳鼠发病情况;收集发病乳鼠鼠脑,参照文献记载的方法用蔗糖-丙酮提纯病毒液;以适当灭活剂灭活病毒,观察灭活后的病毒液性状,并以6日龄SPF鸡胚进行灭活检验;参照文献记载的方法初步测定病毒液与鸡、鸭、鹅、鸽、猪红细胞悬液的反应性;比较并确定鸭坦布苏病毒进行血凝反应的适宜红细胞悬液浓度;比较pH6.0—7.0的反应体系对病毒血凝效价的影响;比较4℃、室温和37℃对病毒血凝反应结果的影响。乳鼠接种鸭坦布苏病毒后6日,1﹕10稀释接种组的乳鼠出现严重的临床症状,表现为四肢抽搐,瘫痪等。大部分乳鼠处于濒死状态,1﹕50和1﹕100稀释接种组的乳鼠症状稍轻于1﹕10稀释接种组乳鼠的症状;提纯后鸭坦布苏病毒液呈淡红色澄明液体,用甲醛灭活后病毒液性状无明显改变,但用β-丙内酯后产生大量絮状沉淀,性状发生明显改变;病毒液可以凝集鸡、鸭、鹅、鸽、猪红细胞悬液;不同浓度红细胞悬液的比较结果显示,病毒液与0.33%的红细胞悬液作用时凝集图形清晰稳定;通过不同pH反应体系的比较,发现病毒液在pH 6.0—6.8时均可发生血凝反应,当pH为6.0—6.2时凝集效价最高;通过不同反应温度的比较,证实病毒液在4℃、室温和37℃时均具有血凝性,但4℃时的血凝反应时间明显延长。乳鼠增殖的鸭坦布苏病毒提纯后具有广谱的血凝性,可以凝集鸡、鸭、鹅、鸽和猪的红细胞,血凝性稳定,在4℃、室温和37℃下均可以与鹅红细胞凝集,以0.33%浓度的红细胞悬液血凝为宜,反应最适pH为6.0—6.2。
鸭坦布苏病毒;血凝;反应条件
0 引言
【研究意义】2010 年春季开始,在浙江、江苏、山东、河北和北京等地区相继暴发了一种以鸭产蛋下降为主要特征的疫病,经病原学研究证实该病是由黄病毒科黄病毒属中鸭坦布苏病毒(duck Tembusu virus,DTMUV)引起[1-3]。北京鸭、樱桃谷鸭、金定鸭、麻鸭、康贝尔鸭和鹅等禽类均可发病,给养鸭业造成了巨大的经济损失[4]。黄病毒属成员多数具有血凝性,如黄热病病毒、流行性乙型脑炎病毒、登革热病毒等可以凝集鸡红细胞[5],利用这种血凝特性可以进行疫病的诊断与抗体检测[6-10],具有操作简单、敏感性高、特异性强、结果易于判定的优点。鸭坦布苏病毒同属于黄病毒属,研究其是否具有血凝特性,进而利用该特性研制鸭坦布苏病毒抗体检测方法,对该病的实验室血清学诊断和免疫监测等将有重要的实际临床应用价值。【前人研究进展】坦布苏病毒首次于1968年在Sarawak地区的蚊子体内分离到,曾一度认为家禽可能是病毒的自然宿主[11]。2000年,研究人员报道了一种新的名为Sitiawan的黄病毒感染鸡后能够引起鸡生长发育受阻[12],Sitiawan病毒与坦布苏病毒核酸的同源性为92%。我国从鸭体内分离到的坦布苏病毒与Bagaza病毒的核酸高度同源[13-14]。在鸭坦布苏病防控上,有多家单位投入了对疫苗及其免疫效果的研究[15-18],市场上也有了商品化的疫苗,但在鸭坦布苏病毒抗体检测技术方面,姬希文和LI等进行了ELISA 抗体检测试剂盒的研究[19-20],WANG等建立了一种乳胶凝集诊断方法用于抗体的快速检测[21],DENG等研制了检测DTMUV抗体的双抗原夹心式免疫层析试纸条[22],目前还没有商品化的诊断试剂。在鸭坦布苏病毒血凝性研究方面,现有资料表明,普通方法增殖的鸭坦布苏病毒对红细胞无凝集特性[23-28],尚无鸭坦布苏病毒血凝抑制试验的研究报道。【本研究切入点】现有资料报道鸭坦布苏病毒通过接种鸭胚、鸡胚、鸭胚成纤维细胞、vero细胞和BHK-21细胞等增殖[23,25-27,29],本研究通过改进鸭坦布苏病毒增殖工艺,将鸭坦布苏病毒接种乳鼠脑组织,收获含病毒的脑组织,经丙酮处理后暴露病毒的血凝活性。【拟解决的关键问题】对鸭坦布苏病毒是否具有血凝性进行研究,确定其凝集的红细胞种类和血凝反应条件。
1 材料与方法
本研究于2015年8月至2016年10月在北京市农林科学院畜牧兽医研究所完成。
1.1 材料
1.1.1 病毒 鸭坦布苏病毒HB株F4代,由北京市农林科学院畜牧兽医研究所分离、鉴定和保存。
1.1.2 实验动物 1—3日龄的BALB/c乳鼠,由购自北京维通利华实验动物技术有限公司的成年BALB/c鼠繁殖而来。6日龄SPF鸡胚,购自北京梅里亚维通实验动物技术有限公司。
1.1.3 红细胞 鹅、鸭、鸽、猪红细胞分别采自北京周边养殖场的健康动物,鸡红细胞采自SPF鸡,购于北京梅里亚维通实验动物技术有限公司。
1.1.4 96孔U型微量板 购自Greiner公司
1.1.5 主要试剂 丙酮购自国药集团化学试剂北京有限公司;甲醛购自北京益利精细化学品有限公司;β-丙内酯购自Alfa Aesar公司;阿氏液、PBS(0.01 mol·L-1, pH 7.2)、0.5%乳汉液按常规方法配制;pH 9.0 BABS配制方法:1.5 mol·L-1NaCl溶液80 ml,0.5 mol·L-1H3BO3溶液100 mL,1 mol·L-1NaOH溶液24 mL,牛血清白蛋白1 g,加蒸馏水至1 000 mL ;VAD的配制方法参见文献[30],使反应体系的pH为6.0—7.0。
1.2 病毒增殖
将F4代毒种用灭菌PBS 进行1﹕10、1﹕50、1﹕100稀释,以0.025 mL/只的剂量分别经脑内途径接种1—3日龄乳鼠。乳鼠接种后继续由母鼠哺乳,攻毒后4—10日,观察不同稀释度的病毒液接种乳鼠后,乳鼠出现临床症状、死亡时间和死亡数。
1.3 病毒提纯
接种后6日,观察到接种的乳鼠出现瘫痪等临床症状,二氧化碳安乐死后收获乳鼠。取鼠脑,参照文献记载的方法[30-31]用蔗糖-丙酮处理脑组织,提取病毒液。
1.4 灭活剂和灭活时间的确定
将上述制备的病毒液平均分为6组,其中3组分别加入终浓度为0.05%、0.1%、0.15%的甲醛,另外3组分别加入终浓度为0.0125%(1/8000)、0.025%(1/4000)和0.05%(1/2000)的β-丙内酯溶液,摇匀后置2—8℃条件下灭活。于灭活后24、48、72、96、120 h分别取样进行灭活检,每份样品经卵黄囊途径接种5枚6日龄SPF鸡胚,每胚0.2 mL,置37℃孵育。24 h照胚,在24 h内死亡的鸡胚判为非特异性死亡,非特异性死亡应不超过1枚。24 h后,每日照胚2次,观察至168 h,鸡胚全部存活,判为灭活完全。24—168 h有死胚及时取出,收获胚体,盲传1代,如无鸡胚死亡,判为灭活完全。
1.5 红细胞悬液的制备
将采集的各种动物血液,分别与等量阿氏液混合。使用前用PBS洗涤3次,前两次1 500 r/min,离心10 min,最后1次以同样的转速离心15 min,根据试验设计,将沉积的红细胞分别用VAD配制成所需浓度的红细胞(V/V)悬液,置4—8℃备用。
1.6 HA测定
96孔U型微量板,从第1孔至第12孔,每孔加入BABS 50 μL,吸取灭活后的病毒液50 μL,依次作2倍系列稀释。按试验设计加入不同种、不同浓度或不同pH值VAD配制的红细胞。设不加样的红细胞对照孔。立即在微量板振摇器上摇匀,放入湿盒,置设定温度下作用50—60 min,观察凝集反应。当对照孔中的红细胞呈显著纽扣状时判定结果。以使红细胞完全凝集的最高稀释度作为判定终点。比较凝集图形、清晰度和稳定程度。
2 结果
2.1 病毒增殖
接种后6日,1﹕10稀释组的20只乳鼠出现严重的临床症状,表现为四肢抽搐,瘫痪等。除3只乳鼠死亡(3/20)外,其余乳鼠处于濒死状态。1﹕50和1﹕100稀释组的193只和120只乳鼠症状稍轻于1﹕10稀释组乳鼠的症状,分别有6只(6/193)和4只(4/120)乳鼠死亡(表1)。死亡鼠弃去,进行无害化处理,发病鼠收获用于制备抗原。

表1 毒种不同稀释倍数接种后乳鼠发病情况
N表示乳鼠状态正常;A表示少量乳鼠出现运动失调;B表示部分乳鼠出现运动失调;C表示有个别乳鼠死亡,其余乳鼠出现行动困难、蹬腿、惊厥现象
N: The status of the sucking mice is normal; A: A few of the sucking mice appear ataxia; B: Some of the sucking mice appear ataxia; C: A small part of the sucking mice are dead, and others appear difficulty in moving, kicking and convulsions
2.2 病毒提纯及灭活
约74 g鼠脑组织匀浆,经蔗糖-丙酮提纯,共提取出408 mL病毒液,呈淡红色澄明液体(图1)。用终浓度为0.05%、0.1%、0.15%的甲醛,分别灭活24、48、72、96和120 h,灭活后的病毒液性状无明显改变,灭活检验接种的5枚鸡胚均存活。
其余病毒液原计划用β-丙内酯溶液灭活,由于加入终浓度为0.0125%的β-丙内酯后瞬间病毒液产生大量絮状沉淀,性状发生明显改变(图2),其他2种浓度的试验未继续进行(表2)。
2.3 HA测定
2.3.1 不同动物红细胞测定灭活病毒液的HA效价和凝集图形 鸡、鹅、鸭、鸽、猪的红细胞用反应终体系为pH 6.2的VAD配制成0.33%的红细胞悬液,分别与甲醛灭活后的病毒液在37℃作用50—60 min。结果显示,病毒液可以凝集上述红细胞,且HA效价基本一致,为1﹕256—1﹕512(表3)。其中,猪红细胞沉降慢,在同一反应时间和条件下,对照孔红细胞不能完全沉降至孔底形成实心点状,而是形成环状,结果不易判定;鸽、鹅、鸭和鸡(雏鸡和育成鸡)的红细胞的凝集图形清晰稳定。

图1 灭活前的病毒液

图2 β-丙内酯灭活(左)和甲醛灭活(右)的病毒液
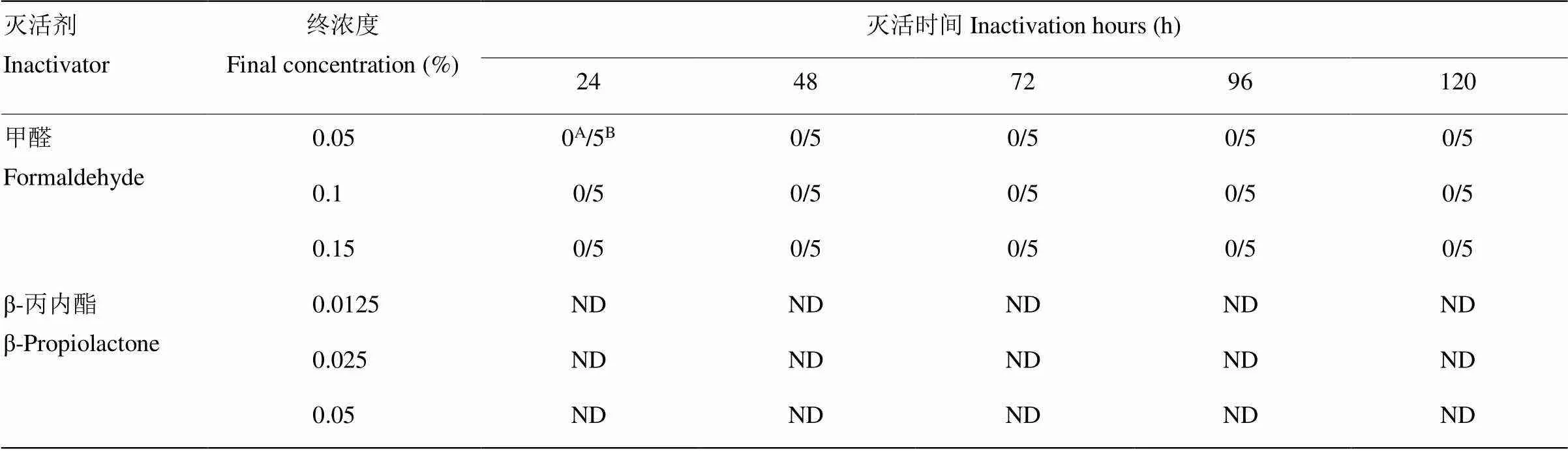
表2 病毒液的灭活试验
A表示死亡鸡胚数;B表示灭活检验所用的鸡胚数;ND表示没有进行相关检验
A: No. of dead chicken embryo; B: No. of total chicken embryo used in inactivation test; ND: Not done
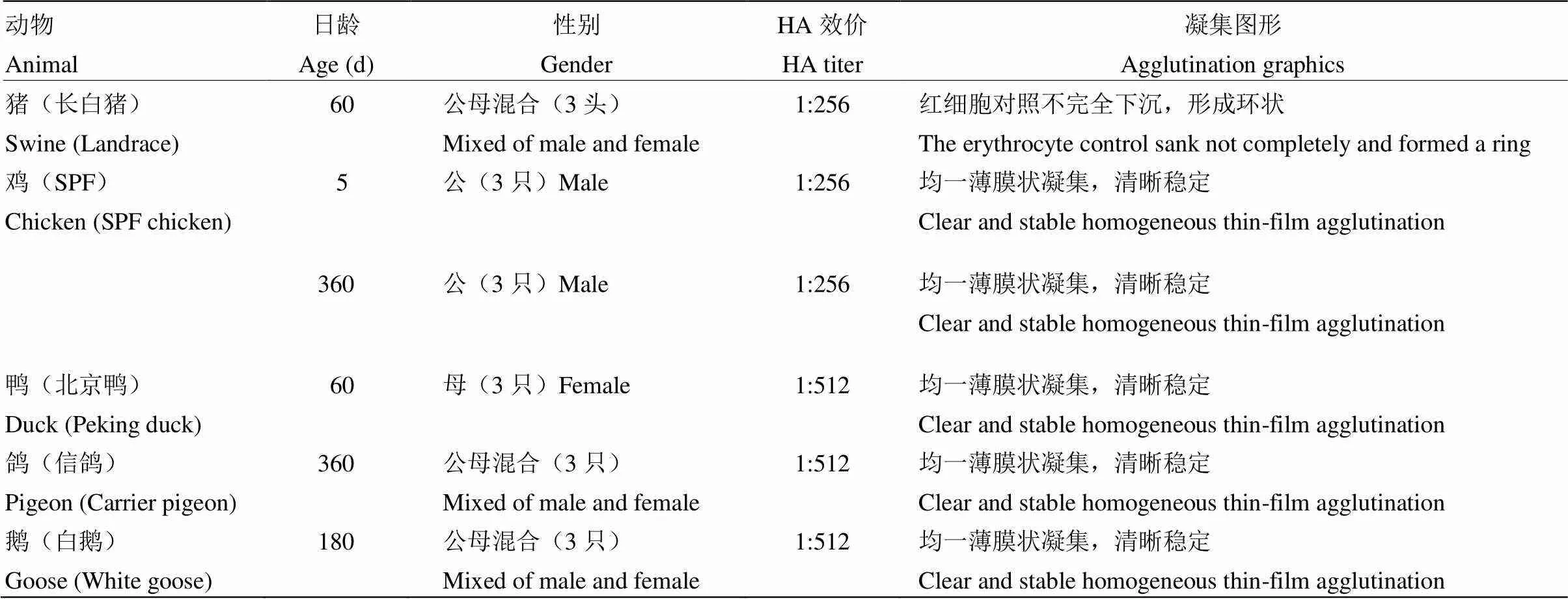
表3 不同动物红细胞的HA效价和凝集图形
2.3.2 不同浓度鹅红细胞的HA效价和凝集图形 用反应终体系为pH 6.2的VAD配制成0.2%、0.33%、0.5%、1%的鹅红细胞悬液,分别与甲醛灭活后的病毒液在37℃作用50—60 min。结果显示,0.2%鹅红细胞的HA效价最高,为1:1 024,但血凝图形过小,不清晰,结果不易判定;1%鹅红细胞的HA效价最低,为1:128,出现解凝现象。0.33%鹅红细胞的HA效价为1:512,凝集图形清晰稳定,是比较理想的红细胞浓度(表4)。
2.3.3 不同pH值反应体系对HA效价的影响 鹅红细胞用不同VAD配制0.33%的红细胞悬液,分别与甲醛灭活后的病毒液在37℃作用50—60 min。试验结果表明,反应体系的pH值对HA效价和凝集图形有显著的影响,随着pH值的升高,病毒液的HA效价降低,凝集图形变得不稳定(表5)。
2.3.4 不同反应温度对HA效价的影响 用反应终体系为pH 6.2的VAD配制成0.33%的鹅红细胞悬液,分别与甲醛灭活后的病毒液在4℃、37℃及室温作用50—60 min,观察反应结果。37℃及室温下反应病毒液的HA效价及凝集图形差别不大;4℃条件下作用60 min后,病毒液与红细胞出现凝集现象,但红细胞对照沉降不完全,无法判定HA效价,过夜作用后,红细胞对照沉降完全,凝集图形清晰,HA效价与37℃反应时相同。这表明鸭坦布苏病毒在4℃时仍具有血凝性(表6)。

表4 不同浓度鹅红细胞的HA效价和凝集图形

表5 不同pH值反应体系对HA效价的影响

表6 不同反应温度对HA效价的影响
3 讨论
据文献报道,黄病毒大多能够凝集鹅、鸽和新生雏鸡的红细胞,但其血凝素易于破坏,而且血凝反应要求比较严格的pH域[32]。鸭坦布苏病毒属于黄病毒属Ntaya病毒群,但在前期的报道中,用鸡胚、鸭胚、鸭胚成纤维细胞、vero细胞和BHK-21增殖的鸭坦布苏病毒不能凝集鸡、鸭、鹅的红细胞[23-28]。笔者参考流行性乙型脑炎病毒血凝抑制试验抗原的制备方法,用乳鼠脑组织增殖鸭坦布苏病毒并用丙酮处理提纯病毒液,进行了血凝性的研究。
为保证生物安全,对病毒液先进行灭活。β-丙内酯和甲醛是两种常用的病毒灭活剂,出人意料的是,提纯后澄明的病毒液加入β-丙内酯很快就有异物产生,该现象表明,提纯的病毒液中可能存在与β-丙内酯起化学反应的物质或者病毒可直接与β-丙内酯发生化学反应,因此,β-丙内酯不能用于灭活提纯的鸭坦布苏病毒液。终浓度为0.05%的甲醛2—8℃作用24h即可完全灭活病毒,且后续的试验结果表明,灭活后的病毒液仍具有血凝性。
提纯的病毒液可与鸡、鸭、鹅、鸽等禽红细胞发生凝集反应,也可以凝集哺乳动物猪的红细胞,相比之下与禽红细胞的血凝反应更稳定。我们曾采取同样的方法处理鸭胚增殖的病毒液(尿囊液),但病毒没有暴露出对鹅红细胞的凝集特性(内部资料),可能与尿囊液中抑制物的化学结构和性质不同(对丙酮的敏感性)有关。
红细胞浓度会影响血凝图形。红细胞浓度过低,红细胞对照孔的沉淀图形过小,不利于观察判定。本研究中,采用0.33%或0.5%的红细胞与鸭坦布病毒进行血凝反应易于观察到血凝现象,因采用0.5%红细胞悬液时有解凝迹象,0.33%红细胞悬液更为合适。黄病毒对血凝反应的pH要求比较严格,如东方马脑炎病毒、西方马脑炎病毒要求pH 6.4左右,登革热病毒1型和2型、流行性乙型脑炎病毒、西尼罗河病毒等要求pH 7.0[5]。通过研究发现,鸭坦布苏病毒血凝反应适宜的pH为6.0—6.8,当pH为6.0—6.2时,HA效价最高,且凝集图形清晰稳定。某些病毒的血凝作用具有温度依赖性,只能在某个温度范围内才出现血凝现象;但另一些病毒可以在4℃、室温和37℃呈现统一的血凝作用[32]。试验结果表明鸭坦布苏病毒可以在4℃、室温和37℃与鹅红细胞凝集。钮慧敏等用蔗糖丙酮法提纯的鼠脑抗原也能凝集0.5%鹅红细胞,HA效价为1:32[29],可能与具体操作方法和血凝条件不同有关。
以乳鼠增殖的鸭坦布苏病毒具有血凝性,HA效价较高,为后续建立检测鸭坦布苏病毒抗体的血凝抑制试验奠定了基础,这将有助于对该病的实验室血清学诊断和免疫监测。
4 结论
乳鼠增殖的鸭坦布苏病毒提纯后具有广泛的血凝性,可以凝集鸡、鸭、鹅、鸽和猪的红细胞,血凝性稳定,在4℃、室温和37℃下均可以与鹅红细胞凝集,以0.33%浓度的红细胞悬液血凝为宜,反应最适pH为6.0—6.2。
[1] YAN P, ZHAO Y, ZHANG X, XU D, DAI X, TENG Q, YAN L, ZHOU J, JI X, ZHANG S, LIU G, ZHOU Y, KAWAOKA Y, TONG G, LI Z. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China., 2011, 417(1): 1-8.
[2] SU J, LI S, HU X, YU X, WANG Y, LIU P, LU X, ZHANG G, HU X, LIU D, LI X, SU W, LU H, MOK N S, WANG P, WANG M, TIAN K, GAO G F. Duck egg-drop syndrome caused by BYD virus, a new Tembusu-related flavivirus., 2011, 6(3):e18106.
[3] CAO Z, ZHANG C, LIU Y, LIU Y, YE W, HAN J, MA G, ZHANG D, XU F, GAO X, TANG Y, SHI S, WAN C, ZHANG C, HE B, YANG M, LU X, HUANG Y, DIAO Y, MA X, ZHANG D. Tembusu virus in ducks, china., 2011, 17(10): 1873-1875.
[4] 张大丙.鸭出血性卵巢炎的研究进展.中国家禽,2011, 33(14): 37-38.
ZHANG D B. Research progress of duck hemorrhagic ovaritis., 2011, 33(14):37-38.(in Chinese).
[5] CASALS J, BROWN L V. Hemagglutination with arthropod-borne viruses., 1954, 99(5):429-449.
[6] LUKMAN N, SALIM G, KOSASIH H, SUSANTO N H, PARWATI I, FITRI S, ALISJAHBANA B, WIDJAJA S, WILLIAMS M. Comparison of the hemagglutination inhibition test and IgG ELISA in categorizing primary and secondary dengue infections based on the plaque reduction neutralization test., 2016, 2016:5253842.
[7] CHA G W, CHO J E, JU Y R, HONG Y J, HAN M G, LEE W J, CHOI E Y, JEONG Y E. Comparison of four serological tests for detecting antibodies to Japanese encephalitis virus after vaccination in children., 2014, 5(5): 286-291.
[8] SANCHINI A, DONOSO-MANTKE O, PAPA A, SAMBRI V, TEICHMANN A, NIEDRIG M. Second international diagnostic accuracy study for the serological detection of West Nile virus infection., 2013, 7(4):e2184.
[9] 高群, 冯琦璞, 王宇.猪乙型脑炎诊断技术.北京农业,2011(12):92-93.
GAO Q, FENG Q P, WANG Y. Pig encephalitis diagnosis., 2011(12):92-93.(in Chinese)
[10] ZHDANOV V M, PYRIKOVA A P, FADEEVA L L. Use of the haemagglutination-inhibition test in the study of museum strains of neuroviruses., 1961, 24:743-748.
[11] PLATT G S, WAY H J, BOWEN E T, SIMPSON D I, HILL M N, KAMATH S, BENDELL P J, HEATHCOTE O H. Arbovirus infections in Sarawak, October 1968-February 1970 Tembusu and Sindbis virus isolations from mosquitoes., 1975, 69(1):65-71.
[12] KONO Y, TSUKAMOTO K, ABD H M, DARUS A, LIAN T C, SAM L S, YOK C N, Di KB, LIM K T, YAMAGUCHI S, NARITA M. Encephalitis and retarded growth of chicks caused by Sitiawan virus, a new isolate belonging to the genusFlavivirus., 2000,63(1/2):94-101.
[13] YUN T, ZHANG D, MA X, CAO Z, CHEN L, NI Z, YE W, YU B, HUA J, ZHANG Y, ZHANG C. Complete genome sequence of a novel Flavivirus, duck Tembusu virus, isolated from ducks and geese in China., 2012,86(6):3406-3407.
[14] TANG Y, DIAO Y, YU C, GAO X, JU X, XUE C, LIU X, GE P, QU J, ZHANG D. Characterization of a Tembusu virus isolated from naturally infected house sparrows () in Northern China., 2013,60(2):152-158.
[15] LIN J, LIU Y, WANG X, YANG B, HE P, YANG Z, DUAN H, XIE J, ZOU L, ZHAO J, PAN J. Efficacy evaluation of an inactivated duck Tembusu virus vaccine., 2015,59(2):244-248.
[16] LI G, GAO X, XIAO Y, LIU S, PENG S, LI X, SHI Y, ZHANG Y, YU L, WU X, YAN P, YAN L, TENG Q, TONG G, LI Z. Development of a live attenuated vaccine candidate against duck Tembusu viral disease., 2014, 450-451:233-242.
[17] 于可响, 马秀丽, 袁小远, 刘存霞, 胡峰, 凌红丽, 李玉峰, 黄兵.鸭坦布苏病毒鸡胚弱化毒株的选育.中国农业科学,2016, 49(14): 2822-2829.
YU K X, MA X L, YUAN X Y, LIU C X, HU F, LING H L, LI Y F, HUANG B. Selection of a live chicken embryo attenuated duck tembusu virus vaccine., 2016, 49: 2822-2829. (in Chinese)
[18] 韩春华, 赵际成, 段会娟, 林健, 杨志远, 谢佳, 潘洁, 王小蕾, 刘立新, 刘月焕.鸭坦布苏病毒病灭活疫苗(HB株)母源抗体的消长规律.中国农业科学,2016, 49(14):2837-2843.
HAN C H, ZHAO J C, DUAN H J, LIN J, YANG Z Y, XIE J, PAN J, WANG X L, LIU L X, LIU Y H. Dynamic study on maternal antibody of duck tembusu virus disease inactivated vaccine (HB Strain)., 2016, 49(14): 2837-2843.(in Chinese)
[19] 姬希文, 闫丽萍, 颜丕熙, 李国新, 张七斤, 李泽君.鸭坦布苏病毒抗体间接ELISA检测方法的建立.中国预防兽医学报,2011, 33(8):630-634.
JI X W, YAN L P, YAN P X, LI G X, ZHANG Q J, LI Z J. Establishment of an indirect ELISA for detection of antibody against duck Tembusu virus., 2011, 33(8):630-634.(in Chinese)
[20] LI X, LI G, TENG Q, YU L, WU X, LI Z. Development of a blocking ELISA for detection of serum neutralizing antibodies against newly emerged duck Tembusu virus., 2012, 7(12):83.
[21] WANG Q, WEN Y, YIFAN H, WU Y, CAI Y, XU L, WANG C, LI A, WU B, CHEN J. Isolation and identification of Duck tembusu virus strain lH and development of latex-agglutination diagnostic method for rapid detection of antibodies., 2014, 58(4):616-622.
[22] DENG J, LIU Y, JIA R, WANG M, CHEN S, ZHU D, LIU M, SUN K, ZHAO X, YIN Z, CHEN A. Development of an immunochromatographic strip for detection of antibodies against duck Tembusu virus., 2017, 249:137-142.
[23] 李玉峰, 马秀丽, 于可响, 王友令, 高巍, 黄兵, 徐怀英, 吴静, 王生雨, 王莉莉, 秦卓明.一种从鸭新分离的黄病毒研究初报.畜牧兽医学报,2011(6):885-891.
LI Y F, MA X L, YU K X, WANG Y L, GAO W, HUANG B, XU H Y, WU J, WANG S Y, WANG L L, QIN Z M. A brief report of flaviviruses newly isolated from duck., 2011(6):885-891.(in Chinese)
[24] 施少华, 傅光华, 万春和, 程龙飞, 陈红梅, 黄振洲, 黄瑜.鹅源坦布苏病毒的分离及初步鉴定.中国兽医杂志,2012, 48(12):37-40.
SHI S H, FU G H, WAN C H, CHENG L F, CHEN H M, HUANG Z Z, HUANG Y. Isolation and identification of Tembusu virus strain from goose., 2012, 48(12): 37-40. (in Chinese)
[25] 潘金金, 邹晓艳, 李鑫, 宿春虎, 柴茂, 姜逸, 胡艳芬, 赵国, 王彦红, 石火英, 陈素娟, 彭大新.鹅源坦布苏病毒SHYG株的分离与鉴定.中国农业科学,2013,46(5):1044-1053.
PAN J J, ZOU X Y, LI X, SU C H, CHAI M, JIANG Y, HU Y F, ZHAO G, WANG Y H, SHI H Y, CHEN S J, PENG D X. Isolation and identification of Tembusu virus strain SHYG from goose., 2013,46(5):1044-1053.(in Chinese)
[26] 张敬峰, 李银, 赵冬敏, 黄欣梅, 周晓波, 刘宇卓.鸭源坦布苏病毒株NJX-4的分离鉴定及部分生物学特性.江苏农业科学,2013, 41(11):228-229.
ZHANG J F, LI Y, ZHAO D M, HUANG X M, ZHOU X B, LIU Y Z. Isolation and identification of Duck-derived Tembusu virus strain NJX-4 and its biological characteristics., 2013, 41(11):228-229.(in Chinese)
[27] 王钰, 王经满, 曹瑞兵.鸭坦布苏病毒XZ-2012株的分离鉴定与基因变异分析.南京农业大学学报,2015, 38(3):446-452.
WANG Y, WANG J M, CAO R B. Isolation and gene variation character of duck Tembusu virus strain XZ-2012., 2015, 38(3):446-452.(in Chinese)
[28] 王善辉, 李云龙, 成子强.鸭坦布苏病毒江苏XZ株的分离和鉴定.中国畜牧兽医,2013, 40(11):185-188.
WANG S H, LI Y L, CHENG Z Q. Isolation and identification of duck-origin Tembusu virus Jiangsu XZ strain.,2013, 40(11):185-188.(in Chinese)
[29] 钮慧敏, 李银, 黄欣梅, 赵东敏, 刘宇卓, 张敬峰, 刘飞, 李彤彤, 周晓波, 李祥瑞.鹅黄病毒JS804株的生物学特性.江苏农业学报,2012(2):454-456.
NIU H M, LI Y, HUANG X M, ZHAO D M, LIU Y Z, ZHANG J F, LIU F, LI T T, ZHOU X B, LI X R. Pathogenic biological characteristics of flavivirus strain JS804 in geese., 2012(2):454-456.(in Chinese)
[30] Manual of Diagnostic Tests and Vaccines for Terrestrial Animals (2017). http://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2. 01.10_JEV.pdf.
[31] CLARKE D H, CASALS J. Techniques for hemagglutination and hemagglutination-inhibition with arthropod-borne viruses., 1958, 7(5):561-573.
[32] 殷震, 刘景华. 动物病毒学. 第2版. 北京: 科学出版社, 1997.
YIN Z, LIU J H.. 2nd ed. Beijing: Science Press, 1997.(in Chinese)
Hemagglutinating Activity of Duck Tembusu Virus
WANG XiaoLei1, LIU YueHuan1, DUAN HuiJuan1, LIU LiXin1, YANG ZhiYuan1, ZHAO JiCheng1, PAN Jie1, LIU RuiHua1, ZHAO WenQi2, TIAN FangJie2, LÜ JinBao3, LIN Jian1
(1Institute of Animal Husbandry and Veterinary Medicine, Beijing Academy of Agricultural and ForestrySciences, Beijing 100097;2Beijing University of Agriculture, Beijing 102206;3Inner Mongolia Agricultural University, Hohhot 010018)
【】The objective of this paper was to study the hemagglutinating activity of duck Tembusu virus (DTMUV). 【】The DTMUV was inoculated intracerebrally in the 1-3-day-old sucking mice of BALB/c in different dilution to observe the morbidity. The brains of sucking mice were collected and purified according to the referenced methods. The purified virus fluid was inactivated by suitable inactivator, followed by the inactivated inspection in 6-day-old SPF chicken embryo. The virus fluid was evaluated the hemagglutinating activity with the erythrocyte suspension of chicken, duck, goose, pigeon and swine. The concentration of the erythrocyte suspension used in the hemagglutination test was compared to select the proper concentration. The pH value of the reaction system between 6.0-7.0 and the reaction temperature including 4℃, room temperature and 37℃were compared. 【】In the 6 day after inoculation , the sucking mice inoculated with 1:10 dilution appeared severe clinical symptoms including twitch, paralysis, and most of them were in agonal stage, while the symptoms of the sucking mice inoculated with 1:50 and 1:100 dilution were slighter. The purified DTMUV fluid was pinkey and clarified. It could be inactivated by formaldehyde but not β-propiolactone that would produce lots of flocks and change the property of the fluid. The DTMUV could hemagglutinate with the erythrocyte suspension of chicken, duck, goose, pigeon and swine, and the agglutination graphics was clear and stable when the concentration of the erythrocyte suspension was 0.33%. The hemagglutinating activity of DTMUV could be showed when the reaction system pH value was 6.0-6.8, while the highest hemagglutination titer appeared during the pH 6.0-6.2. Furthermore, the hemagglutinating activity could be appeared at 4℃, room temperature and 37℃, respectively, although the time required for hemagglutination at 4℃ was much longer. 【】The DTMUV proliferated in the sucking mice of BALB/c had a broad spectrum of hemagglutinating activity that could hemagglutinate with the erythrocyte suspension of chicken, duck, goose, pigeon and swine. The hemagglutinating activity was stable and could hemagglutinate with the goose erythrocyte at 4℃, room temperature and 37℃. The suitable reaction conditions were 0.33% concentration of the erythrocyte suspension and pH 6.0-6.2 of the reaction system.
duck Tembusu virus; hemagglutinating activity;reaction conditions

10.3864/j.issn.0578-1752.2019.23.022
2019-04-23;
2019-07-01
国家重点研发计划项目(2016YFD0500800)、北京市农林科学院科技创新能力建设专项(KJCX20160401)
王小蕾,E-mail:wangxl227@126.com。
林健,E-mail:dblinjian@sina.com
(责任编辑 林鉴非)

