利用TRV-HIGS技术鉴定核盘 菌致病相关的分泌蛋白基因
远俊虎,丁一娟,杨文静,闫宝琴,柴亚茹,梅家琴,钱伟
利用TRV-HIGS技术鉴定核盘 菌致病相关的分泌蛋白基因
远俊虎,丁一娟,杨文静,闫宝琴,柴亚茹,梅家琴,钱伟
(西南大学农学与生物科技学院,重庆 400715)
【】由核盘菌()引起的菌核病是我国油菜种植上的主要问题,严重威胁着菜籽产量及品质。分泌性蛋白在病原菌致病过程中起着重要作用,核盘菌基因组中包含大量编码分泌性蛋白的基因,本研究旨在鉴定并筛选与致病性相关的分泌蛋白基因,揭示核盘菌的致病机理,为菌核病防控提供重要靶标。采用SMART软件对核盘菌在侵染抗病、感病甘蓝过程中差异表达明显的8个具有信号肽的候选基因进行蛋白质结构域的分析,随后将SMART分析得到的结构域分别于SCOP、Pfam、PDB数据库进行功能注释。利用基因特异性引物进行目的基因特异片段的PCR扩增,构建pTRV2-Gene和pTRV2-GFP载体。随后等量混合含有pTRV1及pTRV2-Gene,pTRV1及pTRV2-GFP载体的重悬菌液。室温静置3 h后,利用针筒浸润法将pTRV2-Gene载体及对照(TRV-GFP)侵染5—6周龄的本氏烟()。侵染植株于黑暗环境中培养48 h后,再置于正常光照条件的环境中生长7 d。将直径6 mm的核盘菌PDA菌丝块接种于侵染9 d后的烟草叶片叶腹的中央,其中带菌面紧贴叶片,随后将接种植株培养48 h后统计病斑面积。提取接种48 h后的病斑及病斑周围组织叶片(距腐烂组织边缘1 cm左右)的RNA,利用特异引物进行目的基因的qRT-PCR,计算目的基因在携带TRV-HIGS载体的烟草植株中的相对表达量。SMART及结构域注释预测这8个候选基因可能参与了蛋白、核酸或多糖的水解,影响植物的免疫反应,参与核盘菌对药物耐受性的调节及生物素合成。核盘菌接种携带这8个基因的TRV-HIGS载体及对照载体的烟草,48 h后对照植株的病斑面积平均为3.44 cm2,除外,其余7个候选基因的TRV-HIGS植株上的病斑面积相比对照植株均显著减小(≤0.05),其病斑面积介于1.63—2.61 cm2。qRT-PCR结果显示,这7个致病相关的候选基因在核盘菌侵染烟草过程中的基因表达水平均显著低于对照(≤0.05)。利用TRV介导的HIGS技术成功地对核盘菌中8个未知功能的分泌蛋白基因进行了功能鉴定,筛选到7个可能与核盘菌致病性相关的基因,其中对核盘菌致病性影响最大的预测可能参与核盘菌生物素合成,同时及预测可能参与影响植物的免疫反应。
核盘菌;TRV-HIGS;本氏烟;分泌蛋白;致病性;实时荧光定量PCR
0 引言
【研究意义】核盘菌()是一种寄主范围十分广泛的病原真菌,可以侵染包括油菜、马铃薯、棉花、番茄、大豆、烟草等多种重要作物在内的400多种植物[1],造成作物产量损失,且防治困难。研究表明,除了草酸等致病因子外[2],分泌蛋白(secretory protein)在核盘菌与植物互作中也起着重要作用[3-11],但大多数分泌蛋白在核盘菌致病方面的功能还亟待确定。利用烟草脆裂病毒(,TRV)介导的寄主诱导基因沉默(host-induced gene silencing,HIGS)技术快速挖掘核盘菌致病相关分泌蛋白基因,对明确核盘菌致病机理,进一步安全防控菌核病具有重要意义。【前人研究进展】目前,针对核盘菌致病性的研究主要集中于草酸等致病因子[2]。分泌蛋白是一类由内质网/高尔基体途径分泌到细胞外,具有信号肽结构,且在生物体发育及防御等生理过程中起着重要作用的蛋白质[12]。近年来研究发现,核盘菌的一些分泌蛋白参与了其与寄主的互作过程,如SSCP1和SsSSVP1可分别与寄主植物中的PR1和QCR8蛋白互作,促进寄主植物细胞的死亡,从而利于核盘菌的侵染[3-4];SSITL蛋白参与了核盘菌抑制寄主JA/ET信号途径介导的局部和系统性抗病反应[5]。另外有研究表明一些分泌蛋白可能参与了核盘菌的生长发育过程,比如SsCVNH在核盘菌菌核发育中发挥重要作用[6],Ss-Rhs1和Ss-Caf1则参与了核盘菌复合侵染垫的形成[7-8]。DERBYSHIRe等分别通过生物信息学的方法预测到核盘菌中存在78个和70个候选分泌蛋白[9-10];Ding等[11]利用RNA-seq鉴定到在核盘菌侵染寄主过程中有93个含有信号肽的差异表达基因。这些研究表明核盘菌基因组中存在大量编码分泌性效应蛋白的基因,但是它们是否都参与核盘菌致病性的生物学功能仍不清楚。RNA干扰(RNA interference,RNAi)技术是揭示生物体基因功能的一种反向遗传学研究手段。早期有学者分别利用携带特定基因片段的不同病毒载体侵染本氏烟(),导致特定靶基因的沉默[13],从而建立了病毒介导的基因沉默(virus-induced gene silencing,VIGS)技术。由于VIGS技术操作简便,周期性短,能在当代快速获取表型,继而对基因功能进行分析[14],故该技术在植物基因功能研究中展示出广阔的应用前景[15]。目前常用的病毒载体有PVXB[16]、PGMV[17]、TRV[18]及BSMV[19]等。其中TRV载体与其他病毒载体相比具有诱导基因沉默效率高,持久性长,对宿主不会造成明显伤害等优点,因而被广泛应用[20]。HIGS技术是在VIGS技术上发展而来的,它通过将含有病原物目的基因片段的反义发夹结构的载体转染到寄主植物中,产生病原物特定序列的双链RNA(dsRNA),经过植物体加工后产生siRNA,从而在病原菌侵染过程中沉默病原菌特定基因[21]。近年来,HIGS技术在植物-病原菌互作研究中已被大量应用,并且成功获得了一系列抗性增强的寄主材料[22-23]。由于病毒载体介导的基因瞬时沉默技术周期短,体系成熟,因此多数研究将VIGS与HIGS技术结合起来,利用病毒介导的HIGS技术来快速鉴定病原菌致病基因的功能[24]。Qi等[22]首先利用BSMV介导的HIGS技术,在大麦中瞬时表达BSMV-PsCPK1,初步确定了在增强大麦条锈病抗性中的作用,随后利用HIGS技术获得持久稳定抗性的转基因大麦株系;Xu等[23]利用TRV介导的HIGS技术在棉花中成功鉴定了黄萎病G蛋白信号基因的功能;Andrade等[25]在烟草中表达了核盘菌几丁质合成酶基因的dsRNA,获得了菌核病抗性增强的T1代转基因烟草,证实了HIGS技术在核盘菌基因功能研究中的可行性。因此,利用病毒介导的HIGS技术可以作为鉴定核盘菌致病基因功能的有效手段。【本研究切入点】笔者实验室前期研究中鉴定到核盘菌在侵染过程中有93个具有信号肽结构的差异表达基因,但其中大多数基因的功能还不清楚[11]。因此,本研究采用TRV介导的HIGS技术对其中8个未知功能基因进行功能鉴定。【拟解决的关键问题】利用TRV介导的HIGS技术在本氏烟中瞬时表达靶向8个未知功能的核盘菌基因的siRNA,通过菌核病抗性评价及基因表达量分析,筛选与核盘菌致病性相关的候选基因,探究利用TRV介导的HIGS技术快速鉴定核盘菌致病相关基因的可行性,为进一步解析核盘菌的致病机制打下基础。
1 材料与方法
试验于2018年11月至2019年5月在西南大学农学与生物科技学院油菜资源研究所完成。
1.1 试验材料
供试本氏烟、核盘菌野生菌株1980、pTRV1及pTRV2等相关载体均由重庆市油菜工程技术研究中心提供。大肠杆菌()DH5、农杆菌()GV3101等购自北京全式金生物技术有限公司(TransGen Biotech)。
本氏烟培养于实验室光照培养箱中,参数设定为28℃,18 h光照,光照强度8 000 lx;20℃,6 h黑暗。
1.2 候选基因序列分析
前期对核盘菌侵染甘蓝叶片和茎秆过程中的差异基因进行了分析,发现在侵染茎秆过程中有93个具有分泌信号肽结构的核盘菌差异表达基因[11]。选择其中8个在感病甘蓝的叶片及茎秆中表达量都显著高于抗病甘蓝的基因作为候选基因,并在NCBI数据库(https://www.ncbi.nlm.nih.gov/protein/?term=)下载它们的蛋白序列,利用SMART软件(http://smart.embl- heidelberg.de/)进行基因编码多肽的序列结构分析。随后将SMART分析得到的结构域分别在Pfam(http://pfam.xfam.org/)、PDB(http://www.rcsb.org/)以及SCOP(http://scop.mrc-lmb.cam.ac.uk/scop/)数据库中进行功能注释。
1.3 TRV-HIGS载体的构建
从核盘菌基因组数据库(http://www.broadinstitute. org/annotation/genome/sclerotinia_sclerotiorum/MultiDownloads.html)中下载8个核盘菌候选基因的编码序列,用Primer Premier 5设计特异引物,并加入相应的酶切位点(引物信息见表1)。以核盘菌野生型菌株1980不同生长阶段的混合cDNA为模板,用基因特异引物进行PCR扩增,将扩增片段胶回收后连接到pGEMT-Easy载体,转化至大肠杆菌DH5。挑选阳性单克隆送Invitrogen公司测序,培养测序正确的克隆(菌株)提取质粒。用限制性内切酶组合RI/I分别对阳性克隆质粒和pTRV2进行双酶切,将目的片段与骨架进行连接,转化大肠杆菌后进行菌落PCR,选取阳性克隆扩大培养并提取pTRV2-Gene载体的质粒。将重组质粒转化至农杆菌GV3101,挑选阳性单克隆的菌液加入50%的甘油1﹕1等体积混合于2 ml离心管中,保存于-80℃。利用相同方法成功构建了对照重组质粒pTRV2-GFP。
1.4 TRV-HIGS载体侵染烟草
烟草侵染参照Liu等[26]的方法进行。分别活化pTRV1、pTRV2-Gene及pTRV2-GFP,挑取单克隆预培养后,扩大培养至OD=0.8左右。随后5 000 r/min离心15 min,弃上清,收集菌体后用重悬液(10 mmol·L-1MgCl2,10 mmol·L-1MES,150mmol·L-1AS)重悬至OD=0.8—1.6。等量混合pTRV1及pTRV2-Gene,pTRV1及pTRV2-GFP,室温静置3 h后,用针筒浸润法对5—6周龄的烟草进行侵染。暗培养48 h后,在正常光照条件下培养7 d。试验重复3次,每次重复侵染3株烟草。
1.5 菌核病抗性鉴定
在马铃薯培养基(PDA)平板上活化核盘菌野生型菌株1980,用直径6 mm的打孔器取生长2 d的边缘菌丝用于接种。在TRV-HIGS载体侵染烟草9 d后,将直径6 mm的核盘菌PDA菌丝块接种于侵染后的烟草叶片左右叶腹的中央,带菌面紧贴叶片。接种后,将接种植株置于可控温控湿房间内,其中温度设置为22℃,相对湿度保持在85%左右。接种48 h后统计病斑的长径和短径,利用公式S =π×a×b/4计算病斑面积(其中a代表病斑长轴长度,b代表病斑短轴长度),并利用SAS软件进行统计学分析。

表1 本试验所用引物信息
序列中斜体及下划线处字母代表相应的酶切位点The italicized and underlined letters represent the cleavage sites in the sequence
1.6 候选基因的实时荧光定量PCR(qRT-PCR)
取接种48 h后的病斑及病斑周围组织叶片(距腐烂组织边缘1 cm左右),采用TRIzol®试剂分离提取总RNA,采用Bio RAD的iScriptTMcDNA Synthesis Kit试剂盒将RNA样品反转录成cDNA。采用Bio-Rad的iTaqTMUniversal SYBR®Green Supermix试剂盒,利用CFX96TMreal-time PCR仪进行荧光定量扩增,反应程序:95℃预变性30 s,95℃变性5 s,60℃退火20 s,72℃延伸20 s,40个循环。每个样本重复3次,采用2-ΔΔCT法[27]计算目的基因表达量。每个基因的qRT-PCR引物信息见表1,其中内参基因为核盘菌基因()。
2 结果
2.1 候选基因表达及蛋白结构域分析
图1为8个候选基因在侵染感病、抗病甘蓝叶片上的表达热图。为了进一步了解这8个候选基因的功能,分析了其蛋白质结构域。SMART分析显示,这8个具有信号肽结构的候选基因具有不同类型的SCOP功能域,其中有4个候选基因(、、和)具有不同类型的PDB功能域,此外有4个基因具有不同类型Pfam功能域,其中具有Glyco_hydro_7结构域,具有ASP结构域,具有NPP1结构域,具有Pro-kuma_activ结构域。则包含重复结构域(表2)。将SMART分析得到的候选基因的结构域分别在Pfam、PDB以及SCOP数据库中进行了功能注释,随后对这8个候选可能参与的功能进行了预测。可能参与核盘菌对药物耐受性的调节,可能参与多糖的水解,可能参与蛋白的水解,可能参与诱导植物的病原相关分子模式(pathogen-associated molecular pattern,PAMP)引发的免疫反应(PAMP-triggered immunity,PTI)或物质的异构化过程,可能参与生物素合成,可能参与核酸分子磷酸基团的水解,可能参与坏死诱导蛋白或毒素的产生从而诱导植物的效应蛋白所引发的免疫反应(effector-triggered immunity,ETI),可能参与肽链或蛋白质的水解过程(表2)。

核盘菌候选基因在接种抗、感甘蓝茎秆(A)0、12、24 h和叶片(B) 0、6、12 h后的表达量Relative expression levels of candidate genes in the susceptible and resistant B. oleracea after inoculation with S. sclerotiorum in stem (A) post 0, 12, 24 h and leaf (B) post 0, 6, 12 h。Rs:抗病甘蓝材料的茎秆resistant B. oleracea stem;Ss:感病甘蓝材料的茎秆susceptible B. oleracea stem;Rl:抗病甘蓝材料的叶片resistant B. oleracea leaf;Sl:感病甘蓝材料的叶片susceptible B. oleracea leaf。以lg (FPKM+1)值绘制基因表达量的热图,红色表示高表达基因,蓝色表示低表达基因。颜色从红到蓝,表示lg (FPKM+1)从大到小。基因表达热图构建方法见文献[11] The lg (FPKM+1) value was used for the heatmap. Red indicated high expression genes and blue indicated low expression genes. The colors ranged from red to blue, indicating that lg (FPKM+1) from large to small. The heatmap was conducted according to reference [11]

表2 候选基因的结构域功能分析
2.2 TRV-HIGS载体构建及侵染
扩增8个基因的片段,克隆入载体pTRV2,并利用RI/I对pTRV2-gene进行酶切检测,结果显示在8个pTRV2-Gene质粒的泳道均能检测到目的条带大小的片段(图2),表明成功构建了8个基因的TRV-HIGS载体。利用相同方法克隆GFP(绿色荧光蛋白)片段,并成功构建了阳性对照载体pTRV2-GFP。
分别将pTRV1、pTRV2-GFP及pTRV2-Gene的重组质粒转化农杆菌 GV3101后,侵染5—6周龄的烟草。提取侵染9 d后携带TRV-Gene重组质粒的烟草植株叶片的DNA,利用表1中的引物进行目的片段的PCR检测。结果显示,侵染烟草叶片部位均能检测到相应大小的目的基因片段(图3-A)。同时将侵染9 d后的携带TRV-GFP载体的烟草植株叶片进行荧光信号观察,发现叶片组织存在绿色荧光信号(图3-C),而侵染不含重组质粒的重悬液的烟草没有检测到荧光信号(图3-B)。

M: Marker; 1: SS1G_00263; 2:SS1G_04945; 3:SS1G_03181; 4: SS1G_04343; 5: SS1G_03146; 6: SS1G_02250; 7: SS1G_11912; 8: SS1G_07655
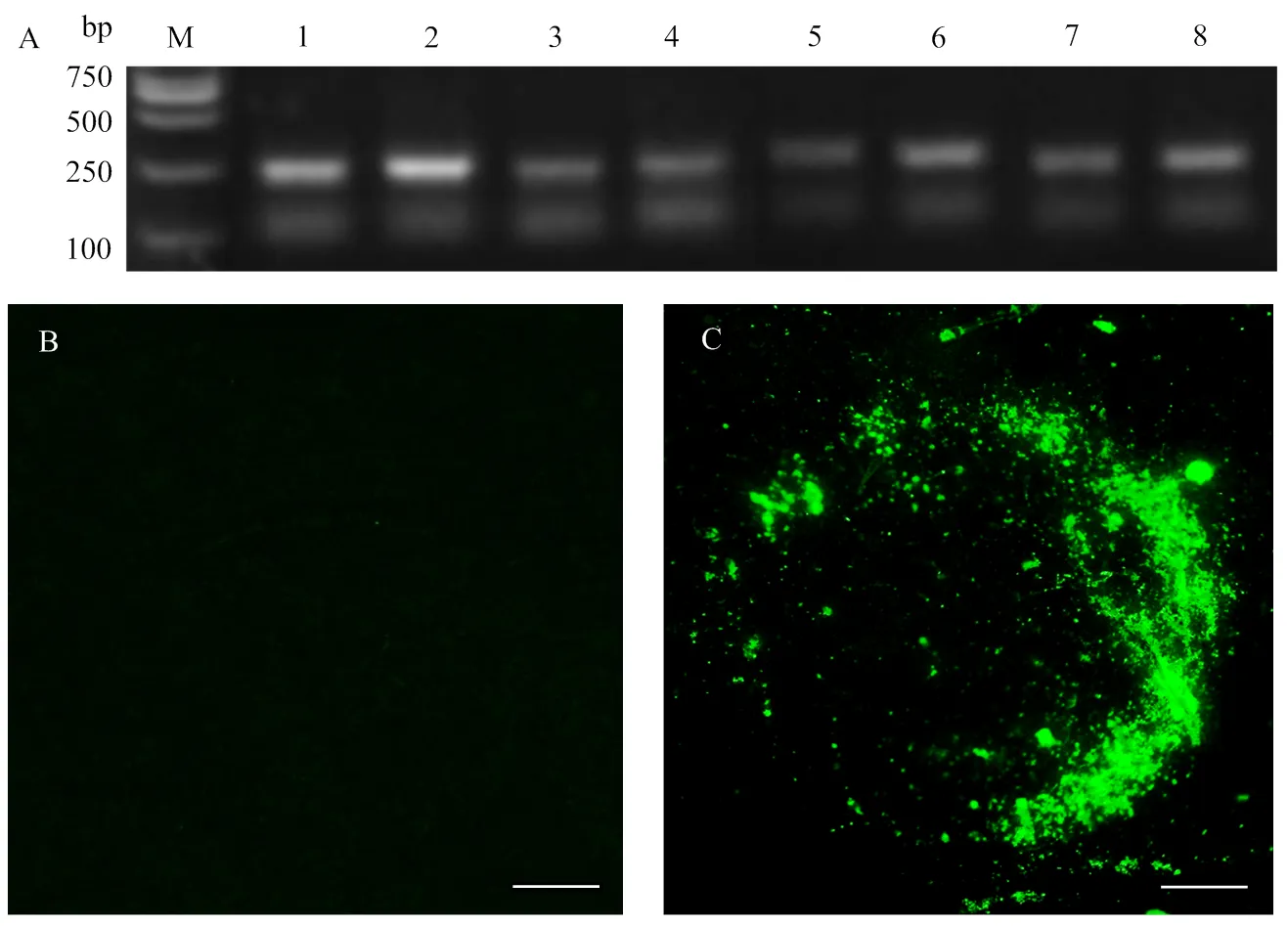
A:注射含有TRV-Gene重组质粒9 d后的烟草植株的PCR鉴定The identification of N. benthamiana at 9 days post TRV-Gene inoculation. M: Marker; 1: SS1G_00263; 2: SS1G_04945; 3: SS1G_03181; 4: SS1G_04343; 5: SS1G_03146; 6: SS1G_02250; 7: SS1G_11912; 8: SS1G_07655;B:注射不含重组质粒的重悬液9 d后的烟草植株的GFP信号观察GFP signal observation of N. benthamiana at 9 days after suspension without recombinant vectors inoculation;C:注射TRV-GFP载体9 d后的烟草植株的GFP信号观察GFP signal observation of N. benthamiana at 9 days post TRV-GFP inoculation。标尺Bar = 30 μm
2.3 目的基因的表达分析
核盘菌接种TRV-HIGS烟草植株48 h后,提取病斑及周围组织RNA,进行目的基因的qRT-PCR分析。结果显示,与对照植株中的目的基因表达量相比,在TRV-HIGS烟草植株上基因表达水平与对照差异不显著(>0.05),其余7个基因在所对应的TRV-HIGS烟草植株上的基因表达水平均显著低于对照(≤0.05),基因表达水平较对照相比下降了26.0%—89.3%(图4)。

*:差异显著significant difference (P≤0.05);ns:差异不显著no significant difference (P>0.05)
2.4 TRV-HIGS烟草植株的菌核病抗性
为了分析这8个基因对核盘菌致病性的影响,在农杆菌侵染烟草9 d后进行核盘菌活体接种。结果发现在接种48 h后,除的TRV-HIGS烟草植株的病斑面积与对照差异不显著外(>0.05),其余7个基因所对应的TRV-HIGS烟草植株的病斑面积相比对照植株均显著减小(≤0.05)(图5-A、5-B)。其中对照TRV-GFP植株的平均病斑面积为3.44 cm2,而携带7个有差异基因的烟草植株的病斑面积介于1.63—2.61 cm2,的TRV-HIGS烟草植株上的平均病斑面积最小(图5-B)。

TRV-HIGS转基因烟草活体接种核盘菌48 h后的发病情况(A)及病斑大小统计(B),柱上不同字母表示差异显著(P≤0.05)Phenotypes (A) and lesion sizes (B) of TRV-HIGS N. benthamiana at 48 hours post inoculation with S. sclerotiorumin vivo. Different letters on the columns indicate significant difference (P≤0.05)
3 讨论
目前基于转录后基因沉默(post-transcriptional gene silencing,PTGS)原理研究寄主-病原菌互作主要集中于两个方面,一方面是利用VIGS等技术筛选寄主的抗病基因。VIGS是指利用重组病毒载体沉默植物内源基因的技术[14],目前利用该技术已经成功挖掘出了一系列植物抗病基因[15,28-30]。在植物抗菌核病研究中,也有研究者利用VIGS技术在烟草及番茄中筛选到了抗菌核病基因,如[29]、[30]、[30]等;另一方面利用HIGS等技术鉴定病原菌致病基因。HIGS是通过寄主植物作为媒介间接沉默病原菌内源基因的技术,主要用于创制抗性材料和病原菌致病基因的功能鉴定两个方面[18-19]。由于病毒载体介导的HIGS技术具有快速、操作简单等优点,因而在鉴定病原菌致病基因的研究中得到越来越多的应用[19,22,24]。其中,BSMV介导的HIGS技术在小麦条锈病、叶锈病等病原菌未知功能基因的鉴定中发挥着巨大作用[19,22]。本研究利用TRV载体,以GFP基因作为对照,采用农杆菌注射的方法在烟草上建立了利用TRV介导的HIGS鉴定核盘菌致病相关基因的技术体系。菌核病抗性鉴定结果显示7个携带候选基因的烟草植株的病斑面积与对照相比显著减小,表现为烟草的抗病性增强。qRT-PCR结果显示在侵染TRV-HIGS烟草植株过程中,核盘菌这7个候选基因的表达被显著抑制。研究结果证实了TRV介导的HIGS技术可以用于快速筛选核盘菌致病相关基因。
分泌蛋白是核盘菌致病的关键“武器”之一[31]。目前针对分泌蛋白的研究主要集中在两个方面:一方面分泌蛋白与核盘菌自身菌核、附着胞结构形成相关[6-8];另一方面分泌蛋白可参与抑制宿主植物的抗病反应,诱导宿主植物细胞性坏死[5]。因此挖掘核盘菌致病相关的分泌蛋白对于解析核盘菌致病机理十分重要。本研究中,通过蛋白质保守结构域预测到可能参与生物素合成。生物素为生物体内关键酶发挥作用所必需的辅因子,有研究显示鸭疫里默氏杆菌()生物素突变菌株的致病力及生长速度较野生型菌株显著减弱[32]。本研究结果显示携带的TRV-HIGS烟草植株病斑面积减少到对照的47.4%。结合这些研究,推测生物素可能是核盘菌致病力的重要因子。此外,本研究预测到具有GntR家族成员的保守结构域。HAYDON等[33]研究表明,GntR家族成员能够利用其保守结构域通过变构效应与代谢产物结合来调控基因转录;曾洁[34]证明了重组耻垢分枝杆菌()对抗生素万古霉素非常耐受。本研究中发现的沉默显著影响了核盘菌的致病性,因而推测编码的分泌蛋白在侵染过程中可能参与了核盘菌对药物或植物抗菌物质等的调节过程。
植物的免疫系统可分为两道防线[35]:第一道防线是病原相关分子模式引发的免疫反应(PTI);第二道防线是病原菌产生的效应蛋白所引发的免疫反应(ETI)。有研究证实是核盘菌编码的一个可以被植物识别的保守PAMP[4],而病原菌侵染过程需要多种PAMP协同作用。在本研究中,预测到具有翻译延伸因子的保守结构域,同时验证了其与核盘菌致病力相关。Kunze等[36]利用细菌的翻译延伸因子EF-Tu 的保守肽段elf18处理植物后能引起植物产生PTI反应。根据这些研究,推测可能是与核盘菌致病力相关的一种PAMP,是提高宿主菌核病抗性的关键因子。此外,预测可能编码坏死诱导蛋白和毒素,坏死诱导蛋白能够触发植物体的ETI反应,诱导植物体产生强烈的过敏反应,引起植物细胞死亡[35]。菌核病抗性鉴定结果也证实参与影响了核盘菌的致病性,故推测通过影响植物的ETI反应,从而参与核盘菌的致病过程。
除了参与物质合成及药物耐受性调节、植物免疫反应相关外,这7个与核盘菌致病力相关的候选基因中还有部分参与编码水解酶类,主要包括酸性蛋白酶(、)和细胞壁降解酶()。后续将利用基因敲除、超表达等技术获得核盘菌转化子来深入解析这7个基因的功能,以期拓宽目前对分泌蛋白功能的认知,进一步解析核盘菌的致病机理。同时,这些致病相关的基因将为下一步利用HIGS技术创制持久稳定的高抗菌核病油菜材料提供重要靶标。
4 结论
利用TRV介导的HIGS技术成功筛选到了7个与核盘菌致病性相关的编码分泌蛋白的基因,其中对核盘菌致病性影响最大。此外,预测可能参与核盘菌生物素合成,及可能参与影响植物的免疫反应。
[1] BOLAND G J, HALL R. Index of plant hosts of.,1994, 16(2): 93-108.
[2] SEIFBARGHI S, BORHAN M H, WEI Y, Coutu C, Robinson S J, Hegedus D D. Changes in thetranscriptome during infection of., 2017, 18: 266.
[3] YANG G, TANG L, GONG Y, XIE J, FU Y, JIANG D, LI G, COLLINGE D B, CHEN W, CHENG J. A cerato-platanin protein SsCP1 targets plant PR1 and contributes to virulence of., 2018, 217(2): 739-755.
[4] LYU X, SHEN C, FU Y, XIE J, JIANG D, LI G, CHENG J. A small secreted virulence-related protein is essential for the necrotrophic interactions ofwith its host plants.,2016, 12(2): e1005435.
[5] ZHU W, WEI W, FU Y, CHENG J, XIE J, LI G, YI X, KANG Z, DICKMAN M B, JIANG D. A secretory protein of necrotrophic fungusthat suppresses host resistance., 2013, 8(1): e53901.
[6] LYU X, SHEN C, FU Y, XIE J, JIANG D, LI G, CHENG J. Comparative genomic and transcriptional analyses of the carbohydrate- active enzymes and secretomes of phytopathogenic fungi reveal their significant roles during infection and development., 2015, 5: 15565.
[7] YU Y, XIAO J, ZHU W, YANG Y, MEI J, BI C, QIAN W, QING L, TAN W. Ss-Rhs1, a secretory Rhs repeat-containing protein, is required for the virulence of., 2017, 18(8): 1052-1061.
[8] XIAO X, XIE J, CHENG J, LI G, YI X, JIANG D, FU Y. Novel secretory protein Ss-Caf1 of the plant-pathogenic fungusis required for host penetration and normal sclerotial development., 2014, 27(1): 40-55.
[9] DERBYSHIRe M, DENTON-GILES M, HEGEDUS D,SeifbarghIS, Rollins J, van KanJ, SeidlM F, FainoL, MbengueM, NavaudO, RaffaeleS, Hammond-KosackK, HeardS, OliverR. The complete genome sequence of the phytopathogenic fungusreveals insights into the genome architecture of broad host range pathogens., 2017, 9(3): 593-618.
[10] GUYON K,Balagué C, ROBY D, Raffaele S. Secretome analysis reveals effector candidates associated with broad host range necrotrophy in the fungal plant pathogen., 2014, 15: 336.
[11] DING Y, MEI J, CHAI Y, YU Y, SHAO C, WU Q, DISI J O, LI Y, WAN H, QIAN W. Simultaneous transcriptome analysis of host and pathogen highlights the interaction betweenand., 2019, 109(4): 542-550.
[12] KRAUSE C, RICHTER S, KNӦLL C, Jürgens G. Plant secretome—from cellular process to biological activity., 2013, 1834(11): 2429-2441.
[13] KUMAGAI M H, DONSON J, DELLA-CIOPPA G, HARVEY D, HANLEY K, GRILL L K. Cytoplasmic inhibition of carotenoid biosynthesis with virus-derived RNA., 1995, 92(5): 1679-1683.
[14] BURCH-SMITH T M, ANDERSON J C, MAETIN G B, DINESH- KUMAR S P. Application and advantages of virus-induced gene silencing for gene function studies in plants., 2004, 39(5): 734-746.
[15] ROBERTSON D. VIGS vectors for gene silencing: Many targets, many tools., 2004, 55: 495-519.
[16] RUIZ M T, VOINNET O, BAULCOMBE D C. Initiation and maintenance of virus-induced gene silencing., 1998, 10(6): 937-946.
[17] KJEMTRUP S, SAMPSON K S, PEELE C G, NGUYEN L V, CONKLING M A, THOMPSON W F, ROBERTSON D. Gene silencing from plant DNA carried by a Germinivirus., 1998, 14(1): 91-100.
[18] SONG Y, THOMMA B P. Host-induced gene silencing compromises Verticillium wilt in tomato and., 2018, 19(1): 77-89.
[19] PANWAR V, MCCALLUM B, BAKKEREN G. Host-induced gene silencing of wheat leaf rust funguspathogenicity genes mediated by the., 2013, 81(6): 595-608.
[20] 田焕焕, 覃瑞, 刘虹, 刘清云, 李刚. 病毒诱导基因沉默(VIGS)在禾本科植物中的研究进展. 植物学研究, 2014, 3: 91-104.
TIAN H H, QIN R, LIU H, LIU Q Y, LI G. Progress of virus induced gene silence (VIGS) system in the studies of Gramineae plant., 2014, 3: 91-104. (in Chinese)
[21] NOWARA D, GAY A, LACOMME C, SHAW J, RIDOUT C, DOUCHKOV D, HENSEL G, KUMLEHN J, SCHWEIZER P. HIGS: host-induced gene silencing in the obligate biotrophic fungal pathogen., 2010, 22(9): 3130-3141.
[22] QI T, ZHU X, TAN C, LIU P, GUO J, KANG Z, GUO J. Host-induced gene silencing of an important pathogenicity factorf. sp.enhances resistance of wheat to stripe rust., 2018, 16(3): 797-807.
[23] XU J, WANG X, LI Y, ZENG J, WANG G, DENG C, GUO W. Host-induced gene silencing of a regulator of G protein signalling gene () confers resistance to Verticillium wilt in cotton.,2018, 16(9): 1629-1643.
[24] 赵玉兰, 苏晓峰, 程红梅. 利用寄主诱导的基因沉默技术验证大丽轮枝菌糖代谢相关基因的致病力. 中国农业科学, 2015, 48(7): 1321-1329.
ZHAO Y L, SU X F, CHENG H M. Verification ofpathogenicity of glycometabolism related genes by using host-induced gene silencing method., 2015, 48(7): 1321-1329. (in Chinese)
[25] ANDRADE C M, TINOCO M L, RIETH A F, MAIA F C, ARAGᾸO F J. Host-induced gene silencing in the necrotrophic fungal pathogen., 2016, 65(4): 626-632.
[26] LIU E W, PAGE J E. Optimized cDNA libraries for virus-induced gene silencing (VIGS) using tobacco rattle virus., 2008, 4: 5.
[27] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod., 2001, 25(4): 402-408.
[28] ZHENG Z, NONOMURA T, APPIANO M, PAVAN S, Matsuda Y, Toyoda H, Wolters A M A,Visser R GF, BaiY. Loss of function inorthologs reduces susceptibility of pepper and tomato to powdery mildew disease caused by., 2013, 8(7): e70723.
[29] 吕琳慧, 徐幼平, 任至玄, 康冬, 王继鹏, 蔡新忠. Ca2+信号通路对本氏烟叶位介导的核盘菌抗性的影响. 浙江大学学报(农业与生命科学版), 2014, 40(6): 605-610.
LÜ L H, XU Y P, REN Z X, KANG D, WANG J P, CAI X Z. Effect of Ca2+signaling pathway on leaf position-associated resistance toin.2014, 40(6): 605-610. (in Chinese)
[30] 王继鹏. 菌龄对核盘菌致病性的影响及植物抗核盘菌分子机制[D]. 杭州: 浙江大学, 2015.
WANG J P. Molecular mechanisms underlying effect of mycelial age on pathogenicity ofand plant resistance to this fungus[D]. Hangzhou: Zhejiang university, 2015. (in Chinese)
[31] 吴健, 周永明, 王幼平. 油菜与核盘菌互作分子机理研究进展. 中国油料作物学报, 2018, 40(5) : 721-729.
WU J, ZHOU Y M, WANG Y P. Research progress on molecular mechanisms of-interaction., 2018, 40(5): 721-729. (in Chinese)
[32] 任晓梅. 鸭疫里默氏杆菌生物素合成相关基因生物学特性分析及应用[D]. 北京: 中国农业科学院, 2018.
REN X M. Biological characterization of biotin-synthesis associatedgeneand its application[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in chinese)
[33] HAYDON D J, GUEST J R. A new family of bacterial regulatory proteins., 1991, 79(2/3): 291-295.
[34] 曾洁. 结核分枝杆菌GntR家族转录因子Rv1152在万古霉素耐受中的分子机理研究[D]. 重庆: 西南大学, 2016.
ZENG J. The underlying molecular mechanisms ofGntR family transcription factor Rv1152 in vancomycin resistance[D]. Chongqing: Southwest University, 2016. (in chinese)
[35] CHISHOLM S T, COAKER G, DAY B,Staskawicz B J. Host-microbe interactions: Shaping the evolution of the plant immune response., 2006, 124(4): 803-814.
[36] KUNZE G, ZIPFEL C, ROBATZEK S,Niehaus K, Boller T, Felix G. The N terminus of bacterial elongation factor Tu elicits innate immunity inplants., 2004, 16(12): 3496-3507.
Identification of genes encoding secretory proteins related to the pathogenicity ofusing TRV-HIGS
YUAN JunHu, DING YiJuan, YANG WenJing, YAN BaoQin, CHAI YaRu, MEI JiaQin, QIAN Wei
(College of Agronomy and Biotechnology, Southwest University, Chongqing 400715)
【】Sclerotinia stem rot (SSR) caused byis the main problem in rapeseed planting in China, which causes serious yield and quality loss. Secretory proteins play an important role in the pathogenesis of pathogens. The genome ofcontains a large number of genes encoding secretory proteins. The objective of this study is toidentify and screen the secretory protein genes related to pathogenicity, reveal the pathogenic mechanism of, and to provide an important target for the prevention and control of SSR. 【】SMART software was used to analyze the protein domains of 8 candidate genes with signal peptides that were differentially expressed in the process ofinfecting the susceptible and resistantlines, then the domains obtained by SMART analysis were annotated in SCOP, Pfam and PDB databases. The fragment with the length of around 300 bp in the encoding region of these genes was cloned into pTRV2 vector together with the GFP fragment. The suspension of pTRV1 was mixed equally with pTRV2-Gene and pTRV2-GFP, respectively. After 3 hours at room temperature, pTRV2-Gene vector and control (pTRV2-GFP) were transformed into 5-6 week-old leaves ofusing syringe infiltration method. Subsequently, the infiltrated plants were cultured in dark for 48 hours and then grown in the normal light for 7 days.PDA mycelium blocks ofwith a diameter of 6 mm were used to inoculate the infiltrated leaves of tobacco at the 9th day after transformation, in which the carrying surface was close to the leaves. After 48 hours of inoculation, the lesion size was measured and RNA from necrotic and infected tissues (around 1 cm from the edge of necrotic tissue) was extracted. qRT-PCR analysis was carried out to estimate the relative expression of target gene inlines carrying TRV-HIGS vector. 【】The putative functions of these 8 genes predicated with SMART and domain annotation were involved in the hydrolysis of proteins, nucleic acids or polysaccharides, the immunity response of host plants, and the tolerance to drugs and biotin synthesis of.The average lesion area of control carrying TRV-GFP was 3.44 cm2at 48 hours post inoculation of. Except for one line (), the lesion area of other 7 lines carrying TRV-HIGS vector was significantly lower than that of the control plants (≤0.05), ranging from 1.63 to 2.61 cm2. qRT-PCR analysis showed that the gene expression level of these 7 genesin the TRV-HIGS lines was significantly lower than that of the control (≤0.05). 【】Eight secretory protein genes with unknown function inwere successfully identified by TRV-HIGS technique. Seven genes related to the pathogenicity ofwere screened out. Among them,with the strongest effect on the pathogenicityofmay be involved in the synthesis of biotin, andandmay be involved in the immune response of host.
; TRV-HIGS;; secretory protein; pathogenicity; qRT-PCR

10.3864/j.issn.0578-1752.2019.23.008
2019-05-28;
2019-08-14
国家自然科学基金(31801395,31971978)、中国博士后科学基金(2018M633305)、西南大学本科生创新创业项目(X201910635284)、西南大学神农班创新创业项目
远俊虎,E-mail:jhyuan1998@163.com。丁一娟,E-mail:dding1989@163.com。远俊虎和丁一娟为同等贡献作者。
钱伟,E-mail:qianwei666@hotmail.com
(责任编辑 岳梅)

